修回日期: 2006-04-21
接受日期: 2006-04-30
在线出版日期: 2006-10-18
目的: 探讨卵圆细胞在大鼠肝癌发生、发展过程中的作用.
方法: 60只SD大鼠随机分为对照组(n = 12)和实验组(n = 48). 用化学致癌剂3'-甲基-4-二甲基氨偶氮苯(3'-Me-DAB)诱发大鼠肝癌, 通过免疫组织化学、RT-PCR, Western blot技术对大鼠诱癌过程(4, 8, 12, 16, 20, 24 wk)中肝组织内卵圆细胞及p53基因表达的变化进行动态的检测.
结果: 诱癌4 wk, 大鼠肝门管区及坏死区内均见大量卵圆细胞, 这些细胞呈OV-6染色阳性. 诱癌16 wk, 肝组织内可见癌结节形成, 癌结节内外均可见有卵圆细胞聚集, 部分增生的卵圆细胞P53阳性反应, 二者的分布区域基本一致. 诱癌20 wk后大鼠肝癌组织内的p53 mRNA(F = 4.78, P<0.05), P53蛋白水平均显著升高(F = 2.46, P<0.05).
结论: 卵圆细胞贯穿了大鼠受化学诱癌剂作用后发生肝癌的全过程, 与肝癌的发生有着密切的联系; 其机制可能与p53基因的突变有关.
引文著录: 朱言亮, 陈孝平, 张万广, 裘法祖. 大鼠实验性肝癌发生中卵圆细胞的变化. 世界华人消化杂志 2006; 14(29): 2830-2833
Revised: April 21, 2006
Accepted: April 30, 2006
Published online: October 18, 2006
AIM: To discuss the role of oval cells in the carcinogenesis and progression of hepatocellular carcinoma.
METHODS: A total of 60 male Sprague Dawley rats were divided into experiment group (n = 48) and control group (n = 12). 3'-methyl-4-dimethylaminoazobenzene (3'-Me-DAB) was used to induce hepatocellular carcinoma, and the presence of oval cells, the expression of p53 gene and P53 protein were dynamically (4, 8, 12, 16, 20, 24 wk) detected by immunohistochemistry, reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: Large numbers of oval cells appeared in the periportal regions 4 wk after the induction of carcinoma, and these cells were OV-6-positive. Cancer nodules were observed at the 16th wk, and the oval cells were located in and around the cancer nodule. A part of these proliferated cells were P53-positive, and the two kinds of cells were almost located in the same region. Twenty weeks after cancer induction, the levels of p53 mRNA (F = 4.78, P < 0.05) and P53 protein in the cancer tissues of rat liver were significantly elevated (F = 2.46, P < 0.05).
CONCLUSION: Oval cells are involved in the process of rat hepatocarcinogesis induced by 3'-Me-DAB, and its mechanism may be related to the mutation of p53 gene.
- Citation: Zhu YL, Chen XP, Zhang WG, Qiu FZ. Role of oval cells in carcinogenesis of experimental hepatocellular carcinoma in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(29): 2830-2833
- URL: https://www.wjgnet.com/1009-3079/full/v14/i29/2830.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i29.2830
成体干细胞(adult stem cells, ASC)的研究是生命科学中一个应用前景极为广阔的领域. 目前有研究认为, 肿瘤的发生可能与ASC的异常分化有关, 并由此提出了肿瘤干细胞的概念[1]. 卵圆细胞(oval cell)作为肝脏内的干细胞其在肝癌发生中的作用一直是肝癌发生学研究中的重要课题. 我们通过化学诱癌剂3'-甲基-4-二甲基氨偶氮苯(3'-Me-DAB)诱发大鼠肝癌的发生, 动态观察卵圆细胞及p53基因的表达在肝组织中的变化, 探讨卵圆细胞与实验性肝癌的发生关系, 以期对肝癌的癌变机制及其发生学提供进一步的实验依据.
体质量140±20 g的♂SD大鼠60只, 购自同济医学院动物实验中心, 3'-Me-DAB购自东京化成工业株式会社, 小鼠抗大鼠OV-6抗体购自R&D公司, 小鼠抗大鼠P53抗体购自Zymed公司, 山羊抗小鼠IgG二抗及化学发光ECL系统购自上海申能博彩公司, 免疫组化SABC试剂盒购自武汉博士德, 总RNA提取试剂TRIzol, 逆转录试剂盒及Taq DNA聚合酶购自深圳晶美生物技术有限公司. p53和内参照β-actin引物自行设计并由上海生工生物公司合成.
将60只大鼠随机分为正常组(12只)和实验组(48只). 正常组和实验组再随机分成6个亚组, 每个亚组分别为2只和8只. 正常组大鼠常规喂饲和饮水; 实验组大鼠喂饲0.6 g/L的DAB饲料, 常规饮水. 二组大鼠于肝癌造模后4, 8, 12, 16, 20及24 wk分别处死一个亚组的大鼠, 取出肝脏后立即置-70 ℃冰箱冷冻保存待用. 另留一部分以40 g/L中性甲醛溶液固定, 常规石蜡包埋, 5 µm连续切片, 行光镜及免疫组织化学染色鉴定.
1.2.1 SABC法: 取大鼠肝脏组织石蜡切片标本, 常规脱蜡和水化后, 30 g/L过氧化氢灭活内源性过氧化物酶, 抗原热修复后以50 g/L BSA封闭, 室温20 min, 以消除背景染色, 然后加入第一抗体工作液(小鼠抗大鼠OV-6抗体1:100; 小鼠抗大鼠P53抗体1:100)4 ℃过夜, PBS洗2 min×3次, 加入生物素标记的第二抗体(山羊抗小鼠IgG)室温处理20 min, 加SABC复合物37 ℃孵育20 min, DAB室温显色, 镜下控制反应时间, 苏木素轻度复染、脱水、透明、封片, 显微镜下观察. 以PBS缓冲液代替一抗作阴性对照.
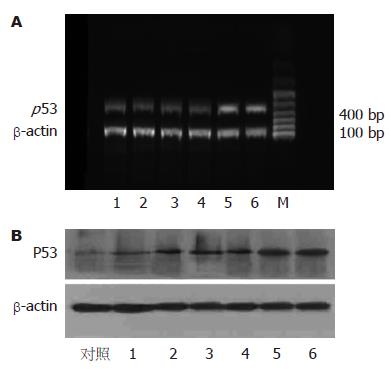
1.2.2 RT-PCR检测p53 mRNA: 总RNA提取和逆转录反应按试剂盒说明书进行操作. 内参照β-actin 引物: 上游: 5'-TCCACCACCCTGTTGCTGTA-3', 下游: 5'-ACCACAGTCCATGCCATGCCATCAC-3'(扩增片段126 bp), p53引物: 上游: 5'-ATGACTGCCATGGAGGAGTCACAG-3', 下游: 5'-CTAGCAGTTTGGGCTTTCCTCCTTG-3'(扩增片段488 bp); PCR反应条件: 94 ℃ 2 min, 94 ℃ 1 min, 56 ℃ 50 s, 72 ℃ 1 min, 30个循环, 72 ℃延伸10 min, 扩增体系50 µL. 用15 g/L琼脂糖凝胶电泳PCR产物, SybrGreenⅠ染色, 凝胶成像系统和图像分析系统观察并半定量计算PCR产物的相对表达量, 结果以目的基因与β-actin mRNA的灰度值比值表示.
1.2.3 三去污剂法提取组织总蛋白: 配置三去污裂解液, 临用前加入100 mg/L苯甲基磺酰氟(PMSF)和1 g/L抑肽酶, 预冷后取200mL与0.1 g组织一起加入匀浆器研磨, 冰上作用30 min, 收集裂解液, 12 000 r/min离心10 min, 取上清, 置于-70 ℃备用.
1.2.4 Western blot检测P53蛋白表达: 取50 µg提取的总蛋白, SDS-PAGE凝胶电泳, 电转移至硝酸纤维素膜, 丽春红染色证实转移成功, 一抗封闭过夜, 二抗孵育1 h, 加发光底物ECL及增强剂, 暗室内曝光, 洗片. 一抗: 小鼠抗大鼠P53抗体1:2000稀释, 二抗: 羊抗小鼠IgG抗体1:500稀释.
统计学处理 采用SPSS 10.0软件包, 所有数据以mean±SD表示, 数据比较采用单因素方差分析.
第1例HCC发生于16 wk, 未至时间点死亡的大鼠不计数, 至实验结束24 wk时止, 实验组HCC发生率为66.7%(14/21); 正常组大鼠无HCC发生.
诱癌4 wk, 大鼠肝门管区及坏死区内均见大量卵圆细胞, 这些细胞呈OV-6染色阳性(图1A). 诱癌16 wk始, 肝组织表面散在肉眼可见的粟粒样大小的结节, 肝脏质地变硬, 镜下可见癌结节形成(图1B), 癌结节内外均可见有卵圆细胞聚集(图1C), 部分增生的卵圆细胞P53阳性反应, 二者的分布区域基本一致(图1D). 正常组大鼠肝组织未见显著性变化.
肝组织的内参照β-actin mRNA表达水平接近(图2A), 表明他可以作为衡量p53 mRNA表达水平相对高低的参照. 大鼠肝癌组织内的p53 mRNA水平(4, 8, 12, 16, 20, 24 wk分别为1.042±0.416, 1.063±0.188, 1.109±0.515, 1.096±0.262, 4.164±0.874和3.559±0.694)在诱癌20 wk以后显著升高(F = 4.78, P<0.05); 而正常组大鼠肝组织内的P53 mRNA水平无明显变化.
从实验早期(8 wk)至HCC发生前, 已可在实验组大鼠的肝组织内检出突变的P53蛋白(图2B). 证明p53基因突变发生在肝细胞发生癌变之前; 正常组无HCC发生, 也未检出P53蛋白及p53突变, 提示p53基因突变是启动细胞癌变过程中非常重要的因素. 同大鼠肝癌组织内p53 mRNA的表达水平相似(4, 8, 12, 16, 20, 24 wk分别为117±35, 268±74, 325±39, 302±68, 841±107和854±143), 在诱癌20 wk以后P53蛋白的表达呈显著性升高(F = 2.46, P<0.05).
卵圆细胞被认为是肝脏内的干细胞, 在创伤修复、细胞移植、基因治疗和器官功能重建方面具有广阔的应用前景. 但另一方面, 卵圆细胞的异常分化过程也会导致肝脏肿瘤的发生[2-3]. 对卵圆细胞与肝癌的关系进行研究以探讨卵圆细胞发生转化的分子机制从而阻断其恶变, 甚至逆转其异常分化有助于我们进一步在细胞水平上认识肿瘤的发病机制, 并最终找到治疗肿瘤安全有效的方法. 关于原发性肝癌的细胞学起源有二种学说[4]: 其一认为来源于分化成熟的细胞, 通过去分化过程演变而来; 其二是由肝内未分化的干细胞或卵圆细胞异常分化所致. 目前多数研究结果支持卵圆细胞参与肝癌发生的假说[5-7], 其依据包括: (1)在许多肝脏肿瘤的实验动物模型中可以观察到卵圆细胞增生的现象; (2)卵圆细胞在形态上与过渡细胞、小肝细胞、嗜碱性细胞、胆管上皮细胞有过渡, 提示上述细胞均由卵圆细胞分化而来; (3)将转化的卵圆细胞株接种到裸鼠或新生大鼠体内可诱导胆管上皮癌和肝细胞癌的发生. 我们的实验也支持卵圆细胞参与了肝癌发生, 主要证据有: (1)卵圆细胞贯穿了DAB诱发大鼠肝癌发生、发展的全过程. 从诱癌4 wk至20 wk肝癌结节的形成, 均可看到卵圆细胞的聚集, 可见卵圆细胞对肝癌的发生、发展起到重要作用; (2)卵圆细胞在诱癌过程中有p53基因表达产物的检出, 表现在部分增生的卵圆细胞呈P53阳性反应, 其与OV-6阳性细胞的分布区域基本一致, 这表明卵圆细胞的异常增生可能为致癌物作用后癌基因的异常激活所引起的. 大量研究显示, 细胞癌变及恶性肿瘤的形成是多因素、多阶段、多基因变异所致的结果, 其癌变过程的每一个阶段都存在癌基因和抑癌基因一系列的变化. p53基因是迄今发现的与人类肿瘤相关性最高的一种抑癌基因, p53基因的缺失和突变可引起细胞恶性增殖, 导致肿瘤的发生[8-9]. 我们的实验显示, 诱癌末期, 肝癌组织中p53 mRNA, P53蛋白的表达水平均有显著升高(P<0.05), 表明p53的突变参与了化学致癌剂DAB诱发的大鼠肝癌的发生, 其可能是通过卵圆细胞的异常增生、分化而引起了肝癌的发生. 我们的实验没有提供直接的证据证实p53突变导致卵圆细胞异常分化为癌细胞, 在下一步的实验中, 我们将对纯化的卵圆细胞施以致癌因素的影响, 观察卵圆细胞是否能诱变为肝癌细胞以及诱癌过程中p53的动态变化, 从而为原发性肝癌起源于肝脏干细胞的异常分化提供更为直接的证据.
总之, 我们认为卵圆细胞贯穿了大鼠受化学诱癌剂作用后发生肝癌的全过程, 与肝癌的发生有着密切的联系, 其机制可能与p53基因的突变有关, 但具体机制仍有待于进一步的研究.
肝癌是最常见恶性肿瘤之一, 到目前为止, 肝癌发生的细胞学机制仍不十分清楚. 近几年成人干细胞的研究提示, 肝癌的发生与干细胞密切相关, 并由此提出了肿瘤干细胞的概念. 较多研究资料显示, 肝干细胞是肝细胞癌和胆管细胞癌的祖细胞. 由于肝干细胞更新迅速, 生命期长, 极易成为致癌因子的靶细胞. 若肝癌起源于干细胞这一学说得到证实, 将改变人们对肝癌发生机制的认识, 极大地促进肝癌相关研究进展, 有可能在起源细胞水平找到彻底治愈肝癌的措施.
目前原发性肝癌的细胞起源学说认为他由肝卵圆细胞成熟受阻、异常分化而来, 其间有多个癌基因和/或抑癌基因共同调控使肝卵圆细胞向肝癌细胞转化, 具体机制还不详. 目前已证实了白血病干细胞的存在, 但在实体瘤中尚无确凿的证据. 关于肝干细胞增殖分化异常与肝癌发生密切相关的观点更多是基于理论与现象的推测, 尚迫切需要通过进一步的实验分离鉴定肝干细胞, 探索其向肿瘤演进的机制.
Huang et al研究Hoxa-13基因在乙型肝炎病毒/丙型肝炎病毒相关的肝癌病例中的表达情况时发现, Hoxa-13基因在来源于肝干细胞的肝癌细胞系中表达, 而不在来源于肝细胞及胆管细胞的肝癌细胞系中表达, 因而推测其对于肝干细胞向肝癌细胞的转化具有重要意义. Ruch et al认为卵圆细胞的分化与其表达的Connexin的种类和与之发生细胞间缝隙连接信息交流(GJIC)的细胞种类有关. GJIC受阻可能决定卵圆细胞是否进展为恶性肿瘤.
1 干细胞: 指具有无限自我复制、自我更新的全能或多能分化能力的细胞群, 可分化为多种细胞系并形成组织和器官.
2 肿瘤干细胞: 肿瘤由不同类型的癌细胞组成, 只有极少数癌细胞亚群能无限增殖并具有致瘤源性, 这类肿瘤细胞与干细胞的自我更新机制相似, 将这部分肿瘤细胞称为肿瘤干细胞.
本文实验方法可靠, 结论可信, 具有一定的学术水平.
电编: 张敏 编辑:潘伯荣
| 1. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 2. | Becker R, Luthgens B, Oesch F, Dienes HP, Steinberg P. Ha-rasVal12 but not p53Ser247 leads to a significant neoplastic transformation rate of the putative rat liver stem cells (oval cell). Carcinogenesis. 1996;17:2635-2640. [PubMed] [DOI] |
| 3. | Hooth MJ, Coleman WB, Presnell SC, Borchert KM, Grisham JW, Smith GJ. Spontaneous neoplastic transformation of WB-F344 rat liver epithelial cells. Am J Pathol. 1998;153:1913-1921. [PubMed] [DOI] |
| 4. | Sell S. Is there a liver stem cell? Cancer Res. 1990;50:3811-3815. [PubMed] |
| 5. | Lowes KN, Brennan BA, Yeoh GC, Olynyk JK. Oval cell numbers in human chronic liver diseases are directly related to disease severity. Am J Pathol. 1999;154:537-541. [PubMed] [DOI] |
| 6. | Libbrecht L, De Vos R, Cassiman D, Desmet V, Aerts R, Roskams T. Hepatic progenitor cells in hepatocellular adenomas. Am J Surg Pathol. 2001;25:1388-1396. [PubMed] [DOI] |
| 8. | Levine AJ, Finlay CA, Hinds PW. P53 is a tumor suppressor gene. Cell. 2004;116:S67-69. [PubMed] [DOI] |
| 9. | Itoh T, O'Shea C, Linn S. Impaired regulation of tumor suppressor p53 caused by mutations in the xeroderma pigmentosum DDB2 gene: mutual regulatory interactions between p48(DDB2) and p53. Mol Cell Biol. 2003;23:7540-7553. [PubMed] [DOI] |