修回日期: 2006-07-28
接受日期: 2006-08-10
在线出版日期: 2006-09-28
目的: 探讨受体全血预先经门静脉输入供体对大鼠肝移植排斥反应的作用.
方法: 采用异系大鼠肝移植模型, 供体为ACI大鼠, 受体为LEW大鼠. 将实验组受体大鼠全血1 mL经门静脉输入供体肝内, 7 d后将处理后的供体肝脏移植于受体. 经门静脉将生理盐水1 mL输入对照组供体肝内, 7 d后将此供体肝脏移植于受体. 观察大鼠生存时间, 分期分批处死大鼠, 从移植肝及受体脾分离T淋巴细胞, 测定移植肝及受体脾内中供体来源活化T淋巴细胞的比例, 检测细胞因子mRNA的表达.
结果: 肝移植大鼠生存时间: 实验组31.7±7.6 d, 对照组11.1±2.1 d. 两组差异显著(P< 0.05). 移植后7 d从移植肝分离的浸润T淋巴细胞分析结果: 实验组OX76+CD4+细胞25.6%, OX76+CD8+细胞26.6%; 对照组OX76+CD4+细胞6.2%, OX76+CD8+细胞7.4%. 实验组移植肝内有大量供体来源的活化T淋巴细胞. 实验组肝内OX76+CD8+细胞可见IL-10 mRNA及IFN-γ mRNA的表达.
结论: 受体血预先经门静脉输入供体, 可以延长异系大鼠肝移植生存时间. 有限的移植物抗宿主反应, 可能是这种肝移植排斥反应抑制的机制.
引文著录: 王凤山, 山口康雄, 古桥隆, 张佳林, 程颖, 刘永锋. 受体血预先经门静脉输入供体延长肝移植大鼠生存时间. 世界华人消化杂志 2006; 14(27): 2673-2678
Revised: July 28, 2006
Accepted: August 10, 2006
Published online: September 28, 2006
AIM: To investigate the effect of pretransplant intraportal administration of recipient blood into the donor on the survival of rat hepatic allograft.
METHODS: Male LEW (RT1) and ACI (RT1a) rats were used as liver transplant recipients and donors, respectively. In experimental group, 7 d prior to transplantation, ACI donors were anesthetized with ether and transfused with freshly heparinized LEW recipient blood (1 mL) via the portal vein. In control group, the rats only received 1 mL normal saline 7 d before transplantation. The serum levels of interferon-γ (IFN-γ) were determined after transplantation. Immunocompetent cells from the donors were identified with anti-donor classⅡ MHC (RT1Ba) (OX-76) antibodies. The number of donor-derived CD4+ and CD8+ T cells in hepatic allograft or recipient spleen was examined. Reverse transcription-polymerase chain reaction was used to detect the mRNA expression of cytokines in the allograft.
RESULTS: LEW rats transplanted with hepatic allograft from ACI rats survived a mean of 11.1 ± 2.1 d. Intraportal preadministration of recipient LEW blood significantly increased the survival of LEW recipients with ACI livers to 31.7 ± 7.6 d (P < 0.05). The serum level of IFN-γ was significantly increased in the experimental group as compared with that in the control group. Cellular infiltration of the hepatic allograft in experimental group was significantly lower than that in the control group. The ratio of OX76+CD4+ or OX76+CD8+ T cells to CD4+ or CD8+ cells was significantly greater in hepatic allograft pretreated with LEW recipient blood than that in the controls (OX76+CD4+ cells: 25.6% vs 6.2%, P < 0.05; OX76+CD8+ cells: 26.6% vs 7.4%, P < 0.05), but not in recipient spleen. OX76+CD8+ T cells from hepatic allograft in the experimental group expressed IFN-γ and interleukin-10 mRNA, but not interleukin-2 mRNA.
CONCLUSION: Pretransplant intraportal infusion of recipient blood to the donor rats prolonged the survival of hepatic allograft, which may be associated with the regional graft-versus-host reaction.
- Citation: Wang FS, Yamaguchi Y, Furuhashi T, Zhang JL, Cheng Y, Liu YF. Prolonged survival of rat hepatic allograft after pretransplant intraportal infusion of recipient blood to the donor. Shijie Huaren Xiaohua Zazhi 2006; 14(27): 2673-2678
- URL: https://www.wjgnet.com/1009-3079/full/v14/i27/2673.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i27.2673
肝移植已经成为治疗各种终末期肝病公认的有效手段, 全球已累计实施肝移植近十万例, 5 a人/移植肝生存率为74.2%/66.1%. 尽管有效免疫抑制剂的广泛应用大大改善了临床肝移植的预后, 但免疫排斥反应依然是影响移植患者长期存活及生存质量的关键问题. 长期应用非特异性的免疫抑制剂造成显著的并发症发生率和较高的死亡率, 特别是引起严重感染和恶性肿瘤. 如果能实现供者特异性免疫抑制, 而同时保留受者免疫系统的全部功能, 即移植耐受, 可以避免因长期应用非特异性的免疫抑制剂带来的诸多问题. 纯系啮齿类动物实验研究提示, 肝移植比较容易诱导免疫耐受, 但免疫耐受机制尚不十分明确[1-4]. 移植后供体与受体微嵌合的形成、Th2型辅助T淋巴细胞的优势以及供体树突细胞向受体淋巴器官的迁移等可能是产生免疫耐受的部分机制[5-11]. 本研究将受体全血预先经门静脉输入供体, 然后进行异系大鼠肝移植, 探讨该方法对大鼠肝移植排斥反应的作用.
采用异系大鼠原位肝移植模型[12]. 供体为♂ACI大鼠(RT1a), 体质量220-250 g. 受体为♂LEW大鼠(RT1), 体质量220-250 g. 麻醉为持续乙醚吸入麻醉. 分实验组(n = 8)和对照组(n = 8).
先采取实验组受体大鼠肝素化全血, 将受体大鼠全血1 mL开腹经门静脉输入供体肝内. 1 wk后将此供体肝脏移植于受体大鼠, 采用改良的两袖套法进行原位肝移植[12] . 将对照组供体大鼠开腹, 经门静脉注入生理盐水1 mL. 1 wk后将此供体肝脏移植于受体大鼠. 检测项目: (1)移植前检测供体肝脏的CD4+及CD8+细胞: 受体大鼠全血1 mL经门静脉输入供体肝内1 wk后, 切取此肝脏, 使用小鼠抗大鼠CD4及CD8抗体进行免疫组织化学染色, 观察此时大鼠肝脏CD4+及CD8+细胞, 并与正常大鼠肝脏对照; (2)观察肝移植大鼠生存时间, 测定肝移植术后肝功能变化; (3)检测血清细胞因子: 移植后分期分批对移植大鼠采血, 分离血清, 使用酶联免疫试剂盒(Rat Immunoassay Kit, BioSource International, Camarillo, CA), 采用ELISA法测定血清中IL-2, IFN-γ的水平; (4)分期观测移植肝组织学变化; (5)进行移植肝内浸润T细胞分析: 移植后分期分批处死大鼠, 将移植肝粉碎, 提取移植肝的浸润细胞, 去除红细胞, 采用mAb免疫沉降法, 使用小鼠抗大鼠CD4及CD8抗体, 分离CD4+及CD8+细胞. 用供体大鼠(ACI)MHCⅡ类抗原特异性抗体OX-76(Serotec, Oxford, England)与CD4+以及CD8+细胞反应, 再用荧光标记OX-76抗体, 然后应用流式细胞仪(Becton Dickinson, Mountain View, CA)检测移植肝的CD4+以及CD8+细胞中OX-76阳性细胞的比例, 即来源于供体的CD4+及CD8+细胞的比例; (6)进行移植后受体脾内T细胞分析: 移植后分期分批将受体脾脏粉碎, 提取脾淋巴细胞, 用同样方法分离CD4+及CD8+细胞, 用供体大鼠(ACI)OX-76与CD4+以及CD8+细胞反应, 再用荧光标记OX-76抗体, 然后应用流式细胞仪检测脾的CD4+以及CD8+细胞中OX-76阳性细胞的比例, 即检测受体脾中来源于供体的CD4+及CD8+细胞的比例; (7)检测移植肝内浸润T细胞的细胞因子mRNA表达: 分离OX76+CD8+细胞后, 从OX76+CD8+细胞提取总RNA, 逆转录后, 进行PCR扩增[13], 参数为: 变性95℃ 60 s, 退火55℃ 60 s,延伸72℃ 40 s, 共25个循环. 扩增产物于15 g/L琼脂糖凝胶电泳, 溴化乙啶显色观察.细胞因子IL-2, IL-10, IFN-γ的引物序列参见文献[14].
统计学处理 使用SPSS统计软件对实验数据进行统计分析, 计量资料比较采用非配对t检验, 计数资料比较采用χ2检验, P<0.05认为组间差异显著.
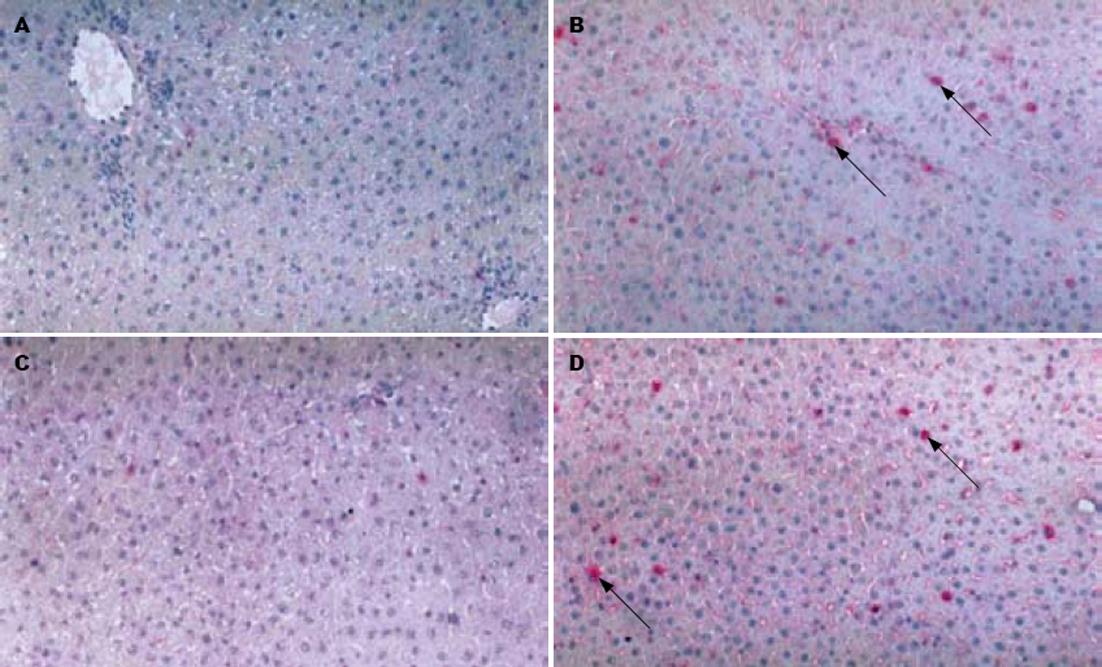
受体大鼠全血1 mL经门静脉输入供体肝内1 wk后, 与正常大鼠相比, 在供体肝脏可见大量CD4+及CD8+细胞(图1).
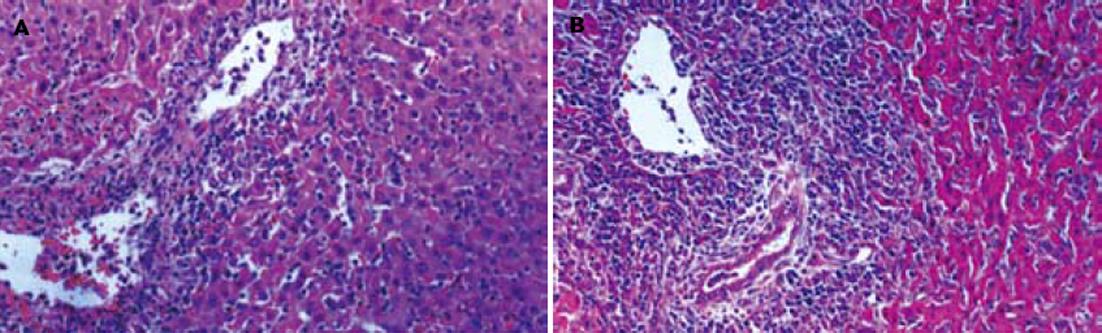
实验组生存时间31.7±7.6 d, 对照组11.1±2.1 d, 实验组大鼠的生存时间明显延长, 两组差异显著(P<0.05). 移植后4 d及7 d血清总胆红素及谷丙转氨酶测定两组无显著差异. 肝移植后4 d, 实验组血清IFN-γ显著高于对照组(276.2±157.3 ng/L vs 112.0±63.7 ng/L)(P = 0.03), 肝移植后7 d, 两组血清IFN-γ无显著差异(11.6±1.6 ng/L vs 18.5±10.7 ng/L). 肝移植后4, 7 d两组血清IL-2水平无显著差异(527.3±186.4 ng/L vs 469.0±170.7 ng/L)、(241.5±90.9 ng/L vs 210.2±113.8 ng/L). 移植后7 d, 移植肝HE染色切片观察, 实验组移植肝汇管区内的淋巴细胞浸润明显少于对照组(图2). 移植后14 d, 实验组移植肝小叶结构不规整, 汇管区可见淋巴细胞浸润. 移植后21 d, 实验组移植肝小叶结构紊乱, 汇管区可见淋巴细胞浸润, 并可见肝纤维化.
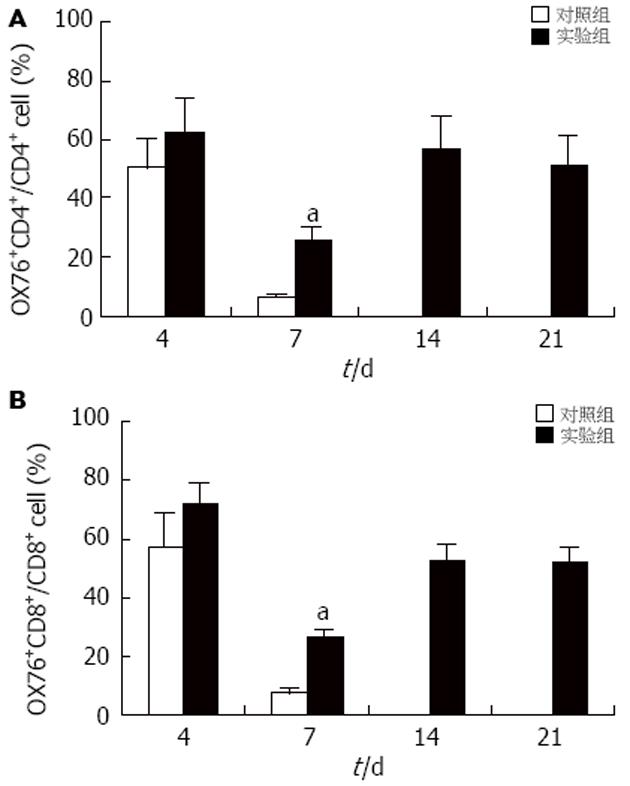
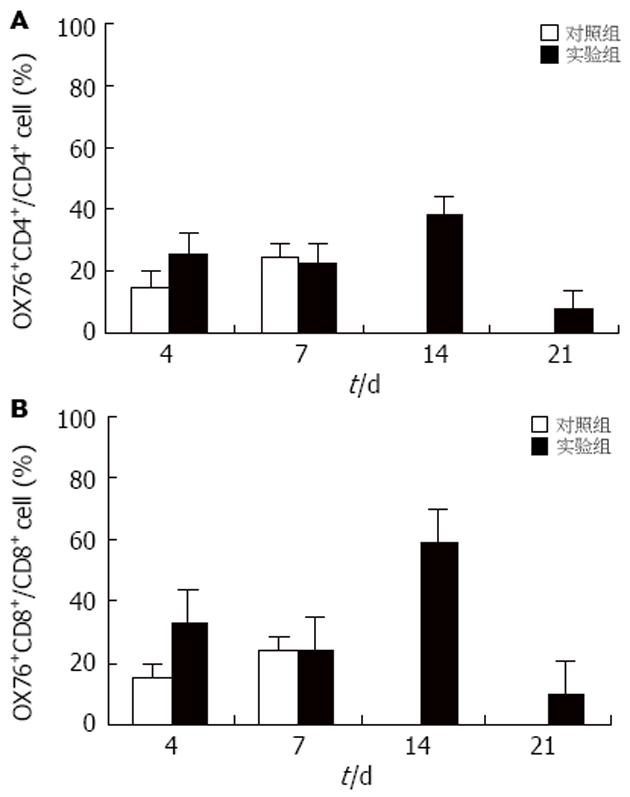
移植后4 d, 实验组与对照组移植肝内浸润T淋巴细胞中供体来源的CD4+及CD8+细胞的比例无显著差异. 移植后7 d, 实验组OX76+CD4+细胞: 25.6%, OX76+CD8+细胞: 26.6%. 对照组OX76+CD4+细胞: 6.2%, OX76+CD8+细胞7.4%. 实验组发现多量供体来源的T淋巴细胞. 移植后14, 21 d实验组移植肝内仍有多量供体来源的T淋巴细胞(图3). 移植后4 d, 实验组与对照组受体脾内T淋巴细胞中供体来源的CD4+及CD8+细胞的比例无显著差异. 移植后7 d, 实验组OX76+CD4+细胞: 22.5%, OX76+CD8+细胞: 24.1%. 对照组OX76+CD4+细胞: 24.0%, OX76+CD8+细胞: 43.3%. 受体脾内T淋巴细胞中供体来源的CD4+及CD8+细胞的比例实验组与对照组也无显著差异(图4).
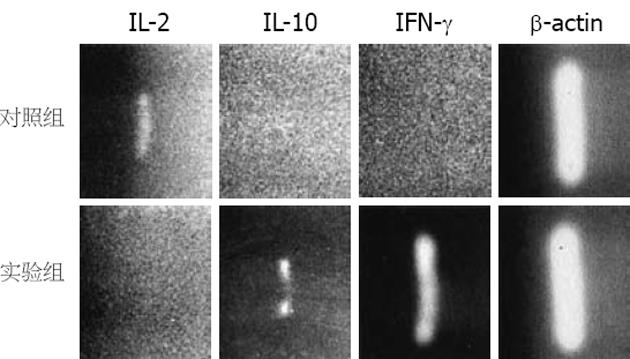
移植后7 d, 实验组肝内OX76+CD8+细胞可见IL-10 mRNA及IFN-γ mRNA的表达, 对照组肝内OX76+CD8+细胞可见IL-2 mRNA的表达(图5).
诱导移植免疫耐受一直是研究者不断追求的目标, 肝脏作为免疫特惠器官, 其免疫耐受诱导的研究比较多. 肝脏是一个富含MHC抗原的重要器官, 含有大量的非实质过客细胞, 这些来自骨髓的细胞, 包括淋巴细胞, 树突状细胞, 枯否氏细胞等, 在免疫应答过程中起着相当重要的作用[15]. 成功诱导耐受的实验都是针对受者T细胞的, 有4种机制可能导致T细胞在移植中对供体的耐受[16-17]: (1)清除, 通过细胞凋亡去除特异性的T细胞或T细胞克隆; (2)无能, T细胞的功能性无反应或失活而不伴有细胞死亡; (3)调节或抑制, 抗原特异性T细胞仍然保留在外周血循环中, 但其免疫反应性被其他细胞抑制或改变了, 这种调节是抗原特异性模式; (4)忽略, T细胞忽略一种抗原, 尽管这一抗原在体内表达, T细胞却保持无反应性. 诱导移植耐受的方法大多依赖于灭活抗供者MHC/抗原肽复合物的T细胞, 这种情况下, 当病毒抗原肽被供者MHC分子提呈时, 患者将不能对抗同种异体移植物的病毒, 同种异体移植物的细胞内感染的影响可能是破坏性的. 这也是移植耐受诱导成功应用临床所面临的挑战. 有研究证明, 在成功诱导免疫耐受的移植肝内, 存在有大量来自供体的活化淋巴细胞, 供体的淋巴细胞与受体的淋巴细胞共存于移植肝内, 并相互作用, 有可能抑制了受体对移植肝的排斥作用[18].
本研究将受体血液预先输入供体肝内, 延长了大鼠肝移植生存时间. 受体血细胞进入供体肝内, 一部分将被供肝枯否氏细胞捕捉, 由于受体血细胞在肝内的刺激, 可使供体肝内产生大量树突状细胞及活化的T淋巴细胞. 将此肝脏移植后, 供体肝内的T淋巴细胞再次接受受体抗原的刺激, 供肝来源的活化T淋巴细胞进一步增殖, 从而对抗受体T淋巴细胞的排斥作用, 即移植物抗宿主反应(GVHR). 本实验显示实验组血液中IFN-γ的增高, 提示移植后早期供受体间免疫反应强烈. RT-PCR结果显示, 实验组肝内OX76+CD8+细胞有IFN-γ mRNA的表达, 提示供体源性CD8+细胞具有较强免疫活性. 对照组肝内OX76+CD8+细胞虽然可见IL-2 mRNA的表达, 但OX76+CD8+细胞比例显著少于实验组, 未能形成有效的作用. 另外实验组肝内OX76+CD8+细胞也有IL-10 mRNA的弱表达,说明OX76+CD8+细胞可能具有双重性, 也可能有抑制排斥反应的作用, 使GVHR不至于过于强烈.
微嵌合是在受体体内供者造血干细胞的低水平存在, 这些造血干细胞分化形成的供者白细胞谱系可引起有限的移植物抗宿主反应, 这可以部分抵消受体的排斥反应[19]. 双向移植排斥理论即器官移植复流后, 发生细胞移动, 移植物中的过客细胞进入受体体内分布于全身组织, 受者的白细胞也进入移植物, 在免疫抑制剂的作用下, 双方均无法消灭对方而共存. 本研究也证明了免疫耐受时微嵌合的存在. 移植肝对受者的免疫系统也会产生反作用, 包括抑制受者细胞毒T淋巴细胞(CTL)及清除CTL. 正是这种受者与供者之间的攻击与反攻击达到平衡状态, 才是出现免疫耐受的一个重要原因. 本研究预先增强供肝对受体的免疫活性, 即增强供体T细胞的活性, 确实抑制了肝移植免疫排斥反应.有关机理有待进一步研究, 供体肝免疫活性增强,实验组肝内发现大量供体来源的CD4+及CD8+T淋巴细胞, 而受体脾内T淋巴细胞中供体来源的CD4+及CD8+细胞的比例实验组与对照组无显著差, 诱导了有限的GVHR, 可能是这种肝移植免疫排斥反应抑制的机制. 我们也曾在实验中增加门静脉输血次数, 即移植前2 wk及1 wk分别给供体经门静脉输受体血1 mL, 没能再显著延长异系大鼠肝移植生存时间. 另外, 在移植物迁移到受体的细胞中, 树突状细胞是主要的, 树突状细胞起源于骨髓, 其作用是捕捉抗原并将其信息表达给T细胞或B细胞, 使之产生免疫效应[20-21]. Thomson et al研究证明肝脏源性的树突状细胞的重要特性就是在活体内能迁移至外周淋巴组织的T细胞依赖区[22-23]. 有关树突状细胞在这种肝移植免疫排斥反应抑制中的作用有待于进一步研究.
肝移植已经成为治疗各种终末期肝病公认的有效手段. 尽管有效免疫抑制剂的广泛应用大大改善了临床肝移植的预后, 但免疫排斥反应依然是影响移植患者长期存活及生存质量的关键问题. 如果能实现供者特异性免疫抑制, 而同时保留受者免疫系统的全部功能, 即移植耐受, 一直是研究者不断追求的目标.
本文报道了受体全血预先经门静脉输入供体对大鼠肝移植排斥反应的作用, 探讨新的肝移植免疫耐受诱导方法. 研究表明, 受体血预先经门静脉输入供体, 可以延长异系大鼠肝移植生存时间. 诱导供肝来源的活化T淋巴细胞增殖, 抑制了受体T淋巴细胞的排斥作用.
作者采用异系大鼠肝移植模型, 将受体大鼠血经门静脉输入供体肝内后的行肝脏移植, 观察到接受受体鼠血输注的供体肝的大鼠生存时间明显长于对照组, 结论认为移植物抗宿主反应可能是延长这种肝移植生存时间的机制. 该研究有一定创新性和科学价值.
电编: 李琪 编辑:张焕兰
| 3. | 肖 文斌, 刘 玉兰, 陈 国栋, 尤 鹏, 孙 君泓. 肝移植自发免疫耐受大鼠CD8+CD28-T抑制细胞的生物学特性. 中华微生物和免疫学杂志. 2004;24:639-643. |
| 5. | Furuhashi T, Yamaguchi Y, Wang FS, Uchino S, Okabe K, Ohshiro H, Kihara S, Yamada S, Mori K, Ogawa M. Hepatic CCR7lowCD62LlowCD45RClow allograft dendritic cells migrate to the splenic red pulp in immunologically unresponsive rats. J Surg Res. 2005;124:29-37. [PubMed] [DOI] |
| 6. | Asakura H, Ku G, Kataoka M, Flye MW. Regulatory cells develop after the spontaneous acceptance of rat liver allografts. Surgery. 2004;136:532-536. [PubMed] [DOI] |
| 7. | Sun Z, Wada T, Maemura K, Uchikura K, Hoshino S, Diehl AM, Klein AS. Hepatic allograft-derived Kupffer cells regulate T cell response in rats. Liver Transpl. 2003;9:489-497. [PubMed] [DOI] |
| 8. | Gassel HJ, Otto C, Klein I, Steger U, Meyer D, Gassel AM, Timmermann W, Ulrichs K, Thiede A. Persistence of stable intragraft cell chimerism in rat liver allografts after drug-induced tolerance. Transplantation. 2001;71:1848-1852. [PubMed] [DOI] |
| 9. | Meyer D, Loffeler S, Otto C, Czub S, Gassel HJ, Timmermann W, Thiede A, Ulrichs K. Donor-derived alloantigen-presenting cells persist in the liver allograft during tolerance induction. Transpl Int. 2000;13:12-20. [PubMed] |
| 10. | Demetris AJ, Murase N, Fujisaki S, Fung JJ, Rao AS, Starzl TE. Hematolymphoid cell trafficking, microchimerism, and GVH reactions after liver, bone marrow, and heart transplantation. Transplant Proc. 1993;25:3337-3344. [PubMed] |
| 11. | Qian S, Lu L, Fu F, Li Y, Li W, Starzl TE, Fung JJ, Thomson AW. Apoptosis within spontaneously accepted mouse liver allografts: evidence for deletion of cytotoxic T cells and implications for tolerance induction. J Immunol. 1997;158:4654-4661. [PubMed] |
| 12. | Kamada N, Calne RY. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage. Transplantation. 1979;28:47-50. [PubMed] [DOI] |
| 13. | Frohman MA, Dush MK, Martin GR. Rapid production of full-length cDNAs from rare transcripts: amplification using a single gene-specific oligonucleotide primer. Proc Natl Acad Sci USA. 1988;85:8998-9002. [PubMed] [DOI] |
| 14. | Nomura M, Yamashita K, Murakami M, Takehara M, Echizenya H, Sunahara M, Kitagawa N, Fujita M, Furukawa H, Uede T. Induction of donor-specific tolerance by adenovirus-mediated CD40Ig gene therapy in rat liver transplantation. Transplantation. 2002;73:1403-1410. [PubMed] [DOI] |
| 19. | Starzl TE, Rao AS, Murase N, Demetris AJ, Thomson A, Fung JJ. Chimerism and xenotransplantation. New concepts. Surg Clin North Am. 1999;79:191-205. [PubMed] [DOI] |
| 20. | Steinman RM. The dendritic cell system and its role in immunogenicity. Annu Rev Immunol. 1991;9:271-296. [PubMed] [DOI] |
| 21. | Steinman RM, Inaba K, Turley S, Pierre P, Mellman I. Antigen capture, processing, and presentation by dendritic cells: recent cell biological studies. Hum Immunol. 1999;60:562-567. [PubMed] [DOI] |
| 22. | Lu L, Woo J, Rao AS, Li Y, Watkins SC, Qian S, Starzl TE, Demetris AJ, Thomson AW. Propagation of dendritic cell progenitors from normal mouse liver using granulocyte/macrophage colony-stimulating factor and their maturational development in the presence of type-1 collagen. J Exp Med. 1994;179:1823-1834. [PubMed] [DOI] |