修回日期: 2006-07-08
接受日期: 2006-08-10
在线出版日期: 2006-09-28
目的: 对Ro 60反义核酸在逆转胃癌细胞多药耐药中作用进行研究.
方法: 克隆Ro 60编码基因, 构建Ro 60编码基因的反义真核表达载体, 将其转导入SGC7901细胞, 应用半定量RT-PCR技术, 对基因转染细胞进行鉴定, 通过MTT法进行体外药物敏感性分析, 借助流式细胞仪检测细胞内蓄积的阿霉素.
结果: 成功构建了Ro 60反义真核表达载体, 应用脂质体介导法将其转导入SGC7901-VCR, Ro 60反义真核表达载体转染SGC7901-VCR 细胞后, Ro 60的表达量明显下降, 体外药物敏感性实验提示其对长春新碱、丝裂霉素、顺铂、阿霉素的敏感性增加, 转染反义表达载体的SGC7901-VCR细胞与未转染和转染空载体的细胞相比, IC50值(mg/L)有显著的下降(7.66±0.45 vs 19.56±0.38, 17.48±0.85; 0.84±0.03 vs 1.62±0.06, 1.80±0.03; 0.51±0.03 vs 0.87±0.03, 0.88±0.03; 0.22±0.01 vs 0.52±0.02, 0.43±0.03, 均P<0.01), 细胞内阿霉素蓄积有显著的增加(51.94±1.26 mg/L vs 36.27±0.98, 37.01±0.91 mg/L, P<0.01).
结论: Ro 60反义真核表达载体转染 SGC7901 后能够抑制胃癌细胞的多药耐药表型.
引文著录: 韩全利, 张希东, 丁杰, 金晓维, 杨玲, 王新, 张学庸, 樊代明. Ss-A/Ro核蛋白60 ku亚单位反义核酸逆转胃癌细胞多药耐药. 世界华人消化杂志 2006; 14(27): 2668-2672
Revised: July 8, 2006
Accepted: August 10, 2006
Published online: September 28, 2006
AIM: To investigate the possible function of Ro 60 antisense nucleic acid in multidrug resistant cell line of gastric cancer.
METHODS: Ro 60 antisense eukaryotic expression vector was constructed using DNA recombination technique, then transfected into SGC7901-VCR by LipofectamineTM2000. Drug sensitivity assay was performed using MTT assay, and IC50 values of gastric cancer cells to chemotherapy drugs were calculated. The intracellular accumulation of adriamycin in gastric cancer cells was measured using fluorescence-activated cell sorting.
RESULTS: The expression level of Ro 60 in SGC7901-VCR cells was decreased after transfection with antisense genes. In vitro drug sensitivity assay show that SGC7901-VCR cells transfected with Ro 60 antisense genes showed significantly increased sensitivity to vincristine (IC50: 7.66 ± 0.45 mg/L vs 19.56 ± 0.38, 17.48 ± 0.85 mg/L, P < 0.01), mitomycin (IC50: 0.84 ± 0.03 mg/L vs 1.62 ± 0.06, 1.80 ± 0.03 mg/L, P < 0.01), cisplatin (IC50: 0.51 ± 0.03 mg/L vs 0.87 ± 0.03, 0.88 ± 0.03 mg/L, P < 0.01) and adriamycin (IC50: 0.22 ± 0.01 mg/L vs 0.52 ± 0.02, 0.43 ± 0.03 mg/L, P < 0.01), as compared with SGC7901-VCR and SGC7901-VCR-pcDNA3.1 cells. As showed by flow cytometry, the intracellular accumulation of adriamycin in the cells transfected with Ro 60 antisense gene was markedly increased in comparison with that in SGC7901-VCR or SGC7901-VCR-pcDNA3.1 cells (51.94 ± 1.26 mg/L vs 36.27 ± 0.98, 37.01 ± 0.91 mg/L, P < 0.01).
CONCLUSION: After transfected into multidrug resistant cell line of gastric cancer, Ro 60 antisense nucleic acid can inhibit the multidrug resistant phenotype of gastric cancer.
- Citation: Han QL, Zhang XD, Ding J, Jin XW, Yang L, Wang X, Zhang XY, Fan DM. Reversal of multidrug resistance in gastric cancer cell line by Ss-A/Ro ribonucleoprotein 60-ku subunit antisense nucleic acid. Shijie Huaren Xiaohua Zazhi 2006; 14(27): 2668-2672
- URL: https://www.wjgnet.com/1009-3079/full/v14/i27/2668.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i27.2668
肿瘤细胞的多药耐药(multidrug resistance, MDR)[1-4]是导致肿瘤化疗失败的主要原因, 逆转肿瘤细胞的耐药性是提高肿瘤化疗疗效的关键. Ss-A/Ro ribonucleoprotein 60 ku subunit(Ro 60)是在耐长春新碱的胃癌细胞系SGC7901/VCR与SGC7901的差示比较中发现在SGC7901/VCR中高表达的基因[5], 初步研究表明, Ro 60对胃癌的MDR起到促进的作用[6-7]. 为了深入探讨Ro 60与MDR的关系, 同时也探讨在基因水平逆转 MDR 的方法, 我们以SGC7901/VCR耐药细胞株为靶细胞模型, 设计针对Ro 60 mRNA的反义核酸, 进行MDR逆转实验.
人胃癌细胞耐药亚系SGC7901/VCR由第四军医大学消化病研究所保存; RPMI 1640及胰蛋白酶购自Hyclone公司; 胎牛血清购自浙江金华公司; T4 DNA连接酶、IPTG、X-gal及dNTP购自上海生工公司; DNA胶回收试剂盒购自华舜公司; Taq酶及各种限制性DNA内切酶购自TaKaRa公司; 质粒DNA提取试剂盒购自Omega公司; LipofectamineTM2000购自Gibco 公司.
1.2.1 Ss-A/Ro 60的克隆: 利用RNA提取试剂盒提取SGC7901/VCR的总RNA, 逆转录制备cDNA, 以RT-PCR克隆Ro 60编码基因, 上游引物: 5' ATA ACG AGG GAG AGG AGA AAG G 3'; 下游引物: 5'GTG TCC ACC TGC ACT CCA TGT C 3', 按Taq 酶说明书中反应体系行PCR反应, PCR产物行10 g/L琼脂糖凝胶电泳分离, 并以DNA胶回收试剂盒回收纯化该片段.
1.2.2 Ro 60反义表达载体的构建及转染: 本研究选取了Ro 60 cDNA中1011位-1733位, 长度为723 bp的片段作为反义RNA的靶序列, 应用EcoRⅤ, BamHⅠ双酶切技术克隆此片段, 然后将此片段克隆重组至真核表达载体pcDNA3.1/V5-His中, 使该片段反向连接在pcDNA3.1/V5-His载体CMV启动子的下游. 按照脂质体说明书的操作步骤, 将Ro 60反义表达载体和pcDNA3.1/V5-His空载体分别转导入对数生长中期的耐药胃癌细胞SGC7901/VCR中, 并用300 mg/L G418对转染细胞进行筛选.
1.2.3 转染细胞Ro 60基因表达的检测: 应用半定量RT-PCR技术, 检测Ro 60在反义基因转染细胞及对照细胞中的表达.
1.2.4 体外药物敏感性实验: 收获对数生长中期的基因转染细胞及其对照细胞, 按照每孔103接种入96孔板, 置于细胞培养箱中按常规培养; 将阿霉素(ADM)、顺铂(CCDP)、丝裂霉素(MMC)、长春新碱(VCR)按不同的浓度加入细胞中, 每个浓度设4个复孔, 继续培养72 h后, 按常规方法加入MTT及DMSO, 于490 nm处测A值, 计算细胞的存活率: 细胞存活率 = (实验组A值-空白对照组A值)/(阴性对照组A值-空白对照A值)×100%; 同时计算细胞对每种药物的IC50值.
1.2.5 细胞内ADM蓄积的检测: 收获对数生长中期的细胞, 按照每孔8×103个细胞接种入6孔板中; 培养过夜后, 每孔加入ADM至终浓度为5 mg/L, 继续培养1 h, 收获细胞, 以PBS洗涤细胞后, 上流式细胞仪检测细胞内的ADM荧光强度[8].
统计学处理 应用SPSS 11.0统计软件包, 对各组均数进行t检验.
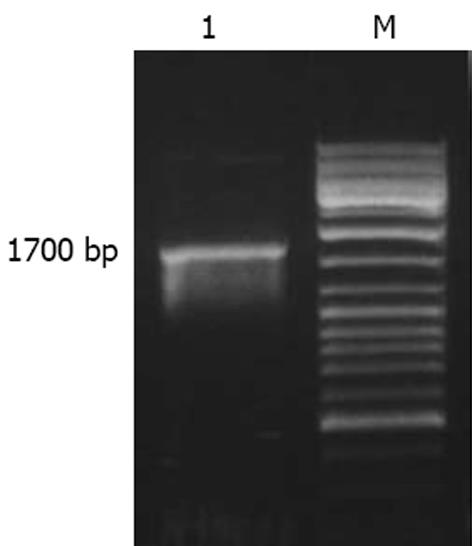
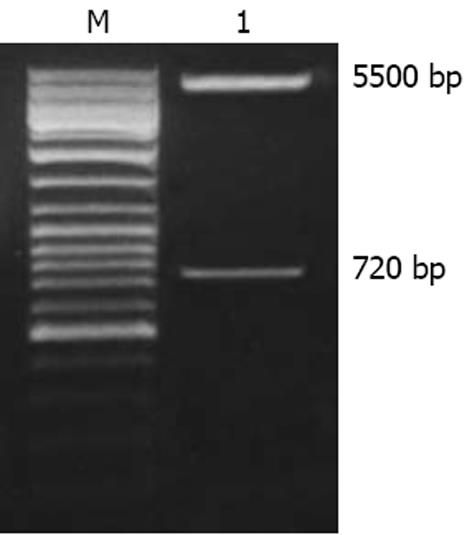
通过对SGC7901/VCR细胞的cDNA进行PCR扩增(图1), PCR产物经与pUCm-T载体连接、转化感受态细菌, 获得了有阳性cDNA片段的重组T载体; 应用EcoRⅤ, BamHⅠ双酶切技术克隆Ro 60 cDNA中1011位-1733位的片段, 然后将此片段克隆重组至真核表达载体pcDNA3.1/V5-His中, 使该片段反向连接在pcDNA3.1/V5-His载体CMV启动子的下游, 并通过限制酶切技术对构建的反义表达载体进行了鉴定(图2).
将构建成功的Ro 60的反义表达载体和pcDNA3.1/V5-His空载体通过脂质体介导法分别转导入对数生长中期的耐药胃癌细胞SGC7901/VCR, 经过3 mo的G418筛选, 获得了稳定转染的抗性细胞, 分别将其命名为VCR-anti, VCR-pc.
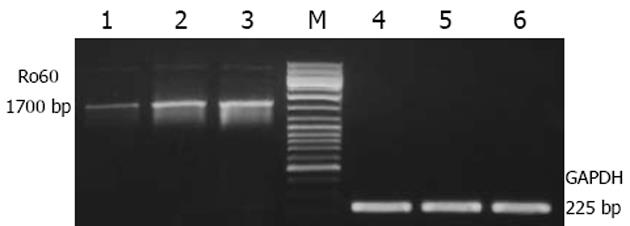
应用半定量RT-PCR技术, 检测了Ro 60在反义基因转染细胞及对照细胞中的表达情况, 结果表明, 与SGC7901/VCR细胞和转染有空载体的SGC7901/VCR细胞相比, 转染有反义基因的SGC7901/VCR细胞中的Ro 60的表达量明显降低(图3).
下调Ro 60在耐药细胞SGC7901/VCR的表达, 可增加耐药细胞对VCR, MMC, CDDP和ADM的敏感性, 与SGC7901/VCR和VCR -pc细胞相比, P<0.01(表1).
流式细胞仪检测结果显示, 在反义转染细胞中, 与SGC7901/VCR细胞和SGC7901-pcDNA3.1细胞相比, SGC7901-Ro细胞内蓄积的ADM明显减低, 与SGC7901/VCR和SGC7901-pc DNA3.1细胞相比, P<0.01(表1).
MDR是指肿瘤细胞对一种化疗药物产生耐药的同时, 对其他结构和作用机制不同的化疗药物也产生交叉耐药的现象, 是导致化疗失败的主要原因. 因此, 如何逆转MDR已是肿瘤研究的热点. 近年来, 反义RNA技术逆转 MDR已有较广泛和深入的实验研究[9-11]. 其基本原理是, 根据碱基互补配对规律设计出能与靶基因特定区域结合的RNA或DNA片段, 从而阻抑从DNA到mRNA的转录或从mRNA 到蛋白质的翻译过程[12-13]. 以前的研究发现, 在胃癌细胞的MDR中, 除了有P-gp, MRP, GST等经典的耐药分子参与外[14-18], 凋亡基因的改变、蛋白激酶C以及某些离子通道也参与了胃癌细胞MDR性的形成[19-25]. 为了深入研究胃癌细胞MDR的发生机制, 我们应用改良差示PCR技术比较了胃癌长春新碱耐药细胞SGC7901/VCR与药敏细胞SGC7901基因表达的差异, 结果表明, 与药敏细胞SGC7901相比, Ro 60在耐药细胞SGC7901/VCR中的表达明显上调. 人Ro 60基因定位于1号染色体1q31, cDNA全长为1890 bp, 编码525个氨基酸残基, 分子量为60 kDa[26-27]. Ro 60是多种自身免疫性疾病[28], 如系统性红斑狼疮(SLE)、干燥综合症等疾病的自身抗原. Ro 60是一种RNA结合蛋白, 目前Ro 60的功能一直不是很清楚[29-30], 初步研究表明, Ro 60对胃癌的MDR起到促进的作用. 因此, 我们以SGC7901/VCR耐药细胞株为靶细胞模型, 设计针对Ro 60 mRNA 的反义核酸, 进行MDR逆转实验, 探讨在基因水平逆转 MDR 的方法.
通过基因克隆、基因重组和转染, 我们获得了Ro 60反义基因转染的细胞, 应用半定量RT-PCR技术, 检测了Ro 60在反义基因转染细胞及对照细胞中的表达, 结果表明, SGC7901/VCR细胞转染Ro 60反义表达载体后其Ro 60表达下降, 表明我们成功构建了Ro 60表达下调的SGC7901/VCR细胞. 体外药敏实验结果表明, 下调Ro 60在耐药细胞SGC7901/VCR的表达后, 细胞对VCR, MMC, CDDP及ADM的敏感性明显增加, 表明Ro 60在SGC7901/VCR细胞表达下调后SGC7901/VCR对多种化疗药物的耐药性减低. 流式细胞仪检测结果表明, Ro 60反义基因转染的细胞后, 其细胞内蓄积的ADM明显增加, 这提示Ro 60反义核酸可以提高细胞内的药物蓄积, 使ADM累积增加, 细胞对ADM敏感性升高, 可能通过恢复MDR细胞的药物蓄积能力而恢复化疗药物对肿瘤的杀伤能力, 不同程度地使已产生耐药肿瘤细胞的MDR 表型发生逆转.
本研究的结果进一步支持了Ro 60基因促进胃癌细胞的MDR表型这一观点, 同时也表明了反义核酸是一种对逆转肿瘤细胞MDR有效的特异性方法, Ro 60可以作为逆转胃癌细胞耐药的候选分子, 具有一定的临床应用前景.
肿瘤细胞的多药耐药(MDR)严重影响了肿瘤化疗的效果, 是导致化疗失败的主要原因. 因此, 如何逆转MDR已是肿瘤研究的热点. 应用反义RNA, RNAi等技术在基因水平阻断MDR相关分子的表达, 从而逆转肿瘤细胞的MDR, 是当前逆转肿瘤的MDR是一个方向.
本研究的结果表明, Ro 60可以作为逆转胃癌细胞耐药的候选分子,具有一定的临床应用前景.
反义RNA技术:根据碱基互补配对规律设计出能与靶基因特定区域结合的RNA或DNA片段, 从而阻抑从D N A 到mRNA的转录或从mRNA 到蛋白质的翻译过程.
该研究通过克隆编码基因、构建其反义真核表达载体、半定量RTPCR及基因转染细胞等多项先进的分子生物学技术, 探讨了Ro 60在基因水平逆转肿瘤细胞多药耐药的可行性, 对于揭示Ro 60基因逆转肿瘤细胞耐药性的机制具有重要的理论价值, 同时对提高肿瘤化疗疗效也有一定的临床指导意义.课题设计新颖, 科学性强, 研究方法先进, 结论客观可信, 具有较高的学术价值.
电编: 李琪 编辑:张焕兰
| 1. | Roepe PD. The role of the MDR protein in altered drug translocation across tumor cell membranes. Biochim Biophys Acta. 1995;1241:385-405. [PubMed] [DOI] |
| 2. | Deng L, Tatebe S, Lin-Lee YC, Ishikawa T, Kuo MT. MDR and MRP gene families as cellular determinant factors for resistance to clinical anticancer agents. Cancer Treat Res. 2002;112:49-66. [PubMed] [DOI] |
| 3. | Luqmani YA. Mechanisms of drug resistance in cancer chemotherapy. Med Princ Pract. 2005;14 Suppl 1:35-48. [PubMed] [DOI] |
| 4. | Sawicka M, Kalinowska M, Skierski J, Lewandowski W. A review of selected anti-tumour therapeutic agents and reasons for multidrug resistance occurrence. J Pharm Pharmacol. 2004;56:1067-1081. [PubMed] [DOI] |
| 5. | Wang X, Lan M, Shi YQ, Lu J, Zhong YX, Wu HP, Zai HH, Ding J, Wu KC, Pan BR. Differential display of vincristine-resistance-related genes in gastric cancer SGC7901 cell. World J Gastroenterol. 2002;8:54-59. [PubMed] [DOI] |
| 6. | 韩 全利, 丁 杰, 郭 长存, 王 新, 乔 泰东, 张 学庸, 樊 代明. Ss-A/Ro核蛋白60 ku亚单位及其变异体在耐药胃癌细胞中的表达. 世界华人消化杂志. 2005;13:2278-2790. [DOI] |
| 7. | 韩 全利, 丁 杰, 张 龙方, 郭 长存, 王 新, 乔 泰东, 张 学庸, 樊 代明. Ss-A/Ro 核蛋白 60 ku亚单位在胃癌MDR中的作用. 世界华人消化杂志. 2006;14:256-260. [DOI] |
| 9. | Chan JY, Chu AC, Fung KP. Inhibition of P-glycoprotein expression and reversal of drug resistance of human hepatoma HepG2 cells by multidrug resistance gene (mdr1) antisense RNA. Life Sci. 2000;67:2117-2124. [PubMed] [DOI] |
| 10. | Haga S, Hinoshita E, Ikezaki K, Fukui M, Scheffer GL, Uchiumi T, Kuwano M. Involvement of the multidrug resistance protein 3 in drug sensitivity and its expression in human glioma. Jpn J Cancer Res. 2001;92:211-219. [PubMed] [DOI] |
| 11. | Kornmann M, Danenberg KD, Arber N, Beger HG, Danenberg PV, Korc M. Inhibition of cyclin D1 expression in human pancreatic cancer cells is associated with increased chemosensitivity and decreased expression of multiple chemoresistance genes. Cancer Res. 1999;59:3505-3511. [PubMed] |
| 12. | Agrawal S, Zhao Q. Antisense therapeutics. Curr Opin Chem Biol. 1998;2:519-528. [PubMed] |
| 13. | Pierce EA, Liu Q, Igoucheva O, Omarrudin R, Ma H, Diamond SL, Yoon K. Oligonucleotide-directed single-base DNA alterations in mouse embryonic stem cells. Gene Ther. 2003;10:24-33. [PubMed] |
| 14. | Ferte J. Analysis of the tangled relationships between P-glycoprotein-mediated multidrug resistance and the lipid phase of the cell membrane. Eur J Biochem. 2000;267:277-294. [PubMed] [DOI] |
| 15. | Boumendjel A, Baubichon-Cortay H, Trompier D, Perrotton T, Di Pietro A. Anticancer multidrug resistance mediated by MRP1: recent advances in the discovery of reversal agents. Med Res Rev. 2005;25:453-472. [PubMed] [DOI] |
| 16. | Mealey KL. Therapeutic implications of the MDR-1 gene. J Vet Pharmacol Ther. 2004;27:257-264. [PubMed] [DOI] |
| 17. | Mizutani T, Hattori A. New horizon of MDR1 (P-glycoprotein) study. Drug Metab Rev. 2005;37:489-510. [PubMed] [DOI] |
| 18. | Asakura T, Ohkawa K. Chemotherapeutic agents that induce mitochondrial apoptosis. Curr Cancer Drug Targets. 2004;4:577-590. [PubMed] [DOI] |
| 19. | Zhao Y, You H, Liu F, An H, Shi Y, Yu Q, Fan D. Differentially expressed gene profiles between multidrug resistant gastric adenocarcinoma cells and their parental cells. Cancer Lett. 2002;185:211-218. [PubMed] [DOI] |
| 20. | Zhao Y, Xiao B, Chen B, Qiao T, Fan D. Upregulation of drug sensitivity of multidrug-resistant SGC7901/VCR human gastric cancer cells by bax gene transduction. Chin Med J (Engl). 2000;113:977-980. [PubMed] |
| 22. | Xiao B, Shi YQ, Zhao YQ, You H, Wang ZY, Liu XL, Yin F, Qiao TD, Fan DM. Transduction of Fas gene or Bcl-2 antisense RNA sensitizes cultured drug resistant gastric cancer cells to chemotherapeutic drugs. World J Gastroenterol. 1998;4:421-425. [PubMed] [DOI] |
| 25. | 韩 英, 时 永全, 张 宏博, 张 淼利, 王 春梅, 樊 代明. 肿胀激活状态下蛋白激酶C同工酶亚型在胃癌耐药细胞系的亚细胞分布变化及其意义. 中华医学杂志. 2001;81:328-331. |
| 26. | Ben-Chetrit E, Gandy BJ, Tan EM, Sullivan KF. Isolation and characterization of a cDNA clone encoding the 60-kD component of the human SS-A/Ro ribonucleoprotein autoantigen. J Clin Invest. 1989;83:1284-1292. [PubMed] [DOI] |
| 27. | Chan EK, Tan EM, Ward DC, Matera AG. Human 60-kDa SS-A/Ro ribonucleoprotein autoantigen gene (SSA2) localized to 1q31 by fluorescence in situ hybridization. Genomics. 1994;23:298-300. [PubMed] [DOI] |
| 28. | von Muhlen CA, Tan EM. Autoantibodies in the diagnosis of systemic rheumatic diseases. Semin Arthritis Rheum. 1995;24:323-358. [PubMed] [DOI] |