修回日期: 2006-06-26
接受日期: 2006-06-30
在线出版日期: 2006-09-08
目的: 观察肝纤维化不同阶段转化生长因子β1(TGF-β1)和结缔组织生长因子(CTGF)在肝组织内表达的相关性.
方法: 41例行肝组织活检慢性病毒性肝炎患者, 免疫组织化学检测TGF-β1和CTGF, 并用多媒体彩色图像分析仪对上述二指标进行图像分析定量.
结果: 按肝纤维化分组, 除S1, S2期无统计学差别意义外, TGF-β1和CTGF均随纤维化分期加重而表达增加(F = 49.56, 23.01, P<0.05). 按炎症活动度分组G1, G2, G3, G4组间TGF-β1两两比较无显著性差异. G1, G2, G3组CTGF两两比较无显著性差异, 而G4组则有统计学意义. 肝组织中TGF-β1与CTGF呈正相关(r = 0.855, P<0.05). TGF-β1和CTGF与血清PCⅢ, LN, HA, ⅣC均呈正相关(TGF-β1: r = 0.744 ,0.815, 0.756, 0.741, P<0.05; r = 0.663, 0.690, 0.686, 0.640, P<0.05).
结论: 肝脏TGF-β1和CTGF表达水平与肝组织纤维化程度密切相关, 在早期肝硬化阶段CTGF表达更可靠.
引文著录: 丁宁, 李岩. 转化生长因子β1和结缔组织生长因子在肝纤维化中的表达. 世界华人消化杂志 2006; 14(25): 2521-2526
Revised: June 26, 2006
Accepted: June 30, 2006
Published online: September 8, 2006
AIM: To detect the expression of transforming growth factor-β1 (TGF-β1) and connective tissue growth factor (CTGF) as well as their correlations in the different stages of hepatic fibrosis.
METHODS: Liver puncture was performed on 41 patients with chronic viral hepatitis. The expression of TGF-β1 and CTGF were detected by immunohistochemistry and other serum fibrosis markers were examined by enzyme-linked immunosorbent assay (ELISA). Subsequently, the images of TGF-β1 and CTGF were analyzed for semi-quantification by multimedia color image analyzer.
RESULTS: The expression of TGF-β1 and CTGF were increased with the elevation of fibrosis stage (F = 49.56, 23.01, both P < 0.05) except S1 and S2 stage. TGF-β1 expression was not significantly different among patients of G1, G2, G3 and G4 stage. CTGF expression of G4 stage was distinctly different from that of G1, G2 and G3 stage, while no difference was observed among patients of G1, G2 and G3 stage. There was closely positive correlation between the levels of TGF-β1 and CTGF in hepatic tissue (r = 0.855, P < 0.05). The tissue levels of TGF-β1 and CTGF were positively correlated with serum levels of PCIII, LN, HA, and IVC (TGF-β1: r = 0.744, 0.815, 0.756 and 0.741, P < 0.05; CTGF: r = 0.663, 0.690, 0.686 and 0.640, P < 0.05).
CONCLUSION: The expression of TGF-β1 and CTGF are closely correlated with the degree of hepatic fibrosis, and the expression of CTGF is more reliable, especially in the early stage.
- Citation: Ding N, Li Y. Expression of transforming growth factor-β1 and connective tissue growth factor in hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2521-2526
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2521
肝纤维化是继发于肝脏炎症或损伤后组织修复的代偿反应, 是许多慢性肝病发展的普遍结果, 进一步发展则形成肝硬化, 是一种严重威胁人类健康的疾病. 研究肝纤维化发展过程及发病机制以及客观评价肝纤维化程度有重要的意义. 我们以慢性病毒性肝炎患者为研究对象, 观察肝纤维化不同阶段转化生长因子β1 (transforming growth factor-β1, TGF-β1)和结缔组织生长因子(connective tissue growth factor, CTGF)在肝组织内表达情况, 探讨TGF-β1和CTGF与肝纤维化发生、发展及炎症损伤的关系. 同时评价TGF-β1和CTGF及其他常用血清纤维化标志物与肝纤维化的相关性, 从而为临床提供更为可靠的反应肝纤维化的指标.
2005-03/10住院41例慢性病毒性肝炎患者, 男28例, 女13例; 年龄15-60岁(平均36岁). 符合2000年《病毒性肝炎防治方案》的诊疗标准, 其中: 轻度29例, 中度6例, 重度6例. 病原学诊断: 乙型肝炎38例, 丙型肝炎3例. 上述病例经血清学检查均排除甲、丁、戊型肝炎病毒感染及其他系统疾病, 无肝穿刺活检禁忌症. 各组间性别和年龄分布差异无显著性(P>0.05). 所有病例均在B超引导下进行肝穿刺活检, 穿刺针采用德国进口16#针, 经皮负压抽吸肝穿法. 肝穿刺标本长度应超过1 cm(即镜下超过6个肝小叶范围). 活检组织用40 g/L中性甲醛溶液固定24 h, 石蜡包埋保存. 肝穿刺前抽取空腹不抗凝静脉血3 mL, 待血块收缩后以3000 r/min速度离心10 min, 取血清置于-20 ℃冰箱保存待检. 一抗、二抗、DAB显色剂等均购自武汉博士德生物技术有限公司.
血清肝纤维化指标透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、层黏连蛋白(LN)、Ⅳ型胶原(ⅣC)检测均采用酶联免疫法. 血清乙型肝炎表面抗原(HBsAg)、抗HBs、乙型肝炎e抗原(HBeAg)、抗HBe、抗HBc、抗HBcIgM、抗HCV采用酶联免疫法; HBV DNA, HCV RNA采用PCR法; 抗HDV, 抗HEV, 抗HEVIgM采用酶联免疫法. 活检组织用40 g/L中性甲醛溶液固定, 石蜡包埋, 连续切片, 进行HE, Mallory染色, 常规显微镜观察. 按照2000年全国诊断标准由病理专科医师对肝脏炎症活动度和纤维化程度分别进行分级、分期做出组织学诊断. TGF-β1检测: 利用石蜡切片按常规ABC法进行. 40 g/L中性甲醛固定肝组织24 h, 石蜡包埋, 制成4 mm厚的连续切片, 常规脱蜡至水; 30 g/L过氧化氢37 ℃孵育10 min; 枸橼酸盐缓冲液微波修复抗原10 min. 其后每片滴加50 mL BSA封闭液温箱孵育20 min后, 滴加稀释一抗(兔IgG)37 ℃温箱孵育1 h后, 滴加二抗(生物素羊抗兔)温箱孵育20 min, SABC温箱孵育20 min后DAB显色, 苏木精衬染, 1 mL/L盐酸酒精分化, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片. 阳性组织呈棕色, 阴性组织呈蓝色. CTGF指标检测: 将石蜡切片常规脱蜡至水后, 每片滴加胃蛋白酶50 mL孵育20 min后, 滴加50 g/L BSA 50 mL封闭液温箱孵育20 min后, 滴加稀释一抗(兔IgG)37 ℃温箱孵育1 h后, 滴加二抗(生物素羊抗兔)温箱孵育20 min, SABC温箱孵育20 min后DAB显色, 苏木精衬染, 1 mL/L盐酸酒精分化, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片. 阳性组织呈棕色, 阴性组织呈蓝色. PBS缓冲液代替一抗做阴性对照. 肝组织TGF-β1和CTGF免疫组织化学染色. 肝组织TGF-β1和CTGF表达图像分析定量方法: 于40倍物镜下用Olympus C3040-ADU彩色图像摄录输入仪将图像输入Meta Morph/DP10/BX41彩色图像分析仪, 每张切片选取四周及中央5个区域, 均取该区域阳性反应最多的视野, 测阳性反应面积比(阳性面积/肝组织面积×100%), 即吸光度值, 再取平均值.
统计学处理 计量资料用均数±标准差表示, 统计学处理全过程采用SPSS 11.5版本统计软件, 采用方差分析. 分析前行方差齐性检验, 方差齐时用SNK法(q检验), 若方差不齐时用Tamhane's法(q'检验), 各指标间相关分析采用直线相关分析, P<0.05时认为有统计学意义.
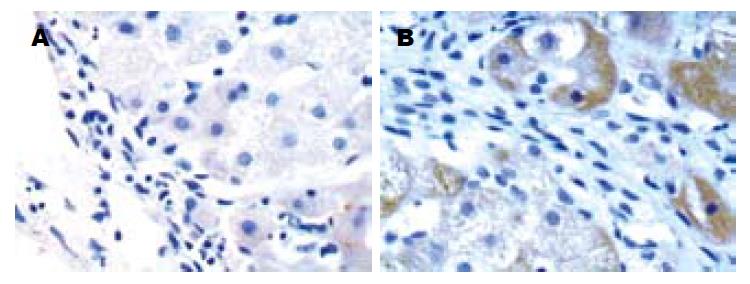
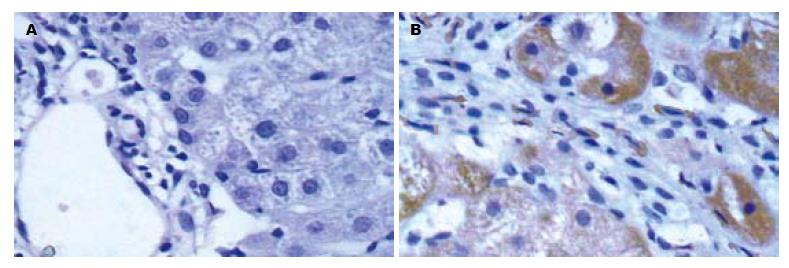
TGF-β1染色阳性物质呈棕黄色. S0期未见明显阳性物质; S1, S2期主要分布于汇管区、窦壁及窦内皮细胞; S3期主要表达纤维间隔、炎症坏死灶与纤维化发生活跃部位的肝细胞也有表达; S4期肝细胞内可见大量染色阳性物质(图1). CTGF染色阳性物质呈棕黄色. S0期未见明显阳性物质, 偶在Disse间隙、汇管区基质及间质细胞内可见少量表达; S1, S2期主要分布于窦内皮细胞、成纤维细胞、星状细胞及汇管区, 胆管上皮细胞有时也呈阳性反应; S3, S4期在炎症反应较明显区域的肝细胞及近汇管区的肝细胞偶见阳性着色(图2).
| 纤维化 | n | TGF-β1 (A) | CTGF (A) | PCⅢ(μg/L) | LN (ng/L) | HA (μg/L) | IVC (μg/L) |
| S0 | 9 | 0.07±0.01a | 0.11±0.15a | 80.89±15.99a | 111.38±11.30 | 57.63±14.01 | 43.73±9.36 |
| S1 | 9 | 0.15±0.01 | 0.12±0.01 | 101.12±29.46a | 117.77±17.70 | 79.39±13.00 | 46.29±10.30 |
| S2 | 11 | 0.25±0.05 | 0.21±0.04 | 100.93±13.89 | 160.83±21.35 | 95.32±25.55a | 52.76±11.61 |
| S3 | 7 | 0.44±0.35a | 0.36±0.03a | 149.57±48.58a | 172.03±24.40 | 116.69±16.59a | 62.42±8.17a |
| S4 | 5 | 0.48±0.01a | 0.41±0.02a | 257.84±26.37a | 202.37±4.17a | 292.62±4.84a | 111.74±4.87a |
| F值 | 49.56 | 23.01 | 39.22 | 31.29 | 38.76 | 47.58 |
按炎症活动度分组G1, G2, G3, G4组间TGF-β1两两比较无显著性差异. G1, G2, G3组CTGF两两比较无显著性差异, 而G4组则有统计学意义.
肝纤维化是许多慢性肝病发展的普遍后果, 近年来研究发现, TGF-β1, CTGF与肝纤维化关系密切. 国内外关于TGF-β1和CTGF的基础研究大多为细胞培养和动物实验, 临床研究有关人体肝组织内TGF-β1和CTGF的分布及其临床意义的研究较少. 我们探讨慢性肝炎患者肝脏病理组织中TGF-β1, CTGF的分布与肝纤维化的关系, 并应用数字彩色图像分析技术加以定量分析, 更好地评估肝脏纤维化程度, 对指导临床工作有极其重要的意义. 肝纤维化是以胶原为主的细胞外基质(ECM)合成增多, 而降解相对减少, 两者失去动态平衡, 故过多ECM沉积于肝内而引起肝纤维化, 是各种慢性肝病向肝硬化发展所共有的病理改变和必经途径. 而TGF-β1是调控肝纤维化发生、发展的核心物质[1]. TGF-β1是一组具有多种生物学功能的蛋白多肽, 对细胞的生长、分化和多种生理、病理过程起重要的调节作用. 他参与细胞周期的调控, 血管及胚胎的形成, 诱导细胞凋亡以及免疫调节等过程. 肝脏中多种细胞均可产生TGF-β[2], 如肝星状细胞、枯否细胞、内皮细胞、来自血液的T淋巴细胞以及血小板等, 至少有6种亚型[3], 在哺乳动物中只发现了3种亚型, 即TGF-β1-3. 其中在肝脏中含量最高、功能最重要的是TGF-β1. 在正常肝脏, TGF-β1绝大部分分布于枯否细胞, 其次为肝星状细胞, 而肝窦内皮细胞和肝细胞则无表达. 研究表明TGF-β1活化后生物学作用是由细胞膜上的特异受体与TGF-β特异结合, 亲和力很高, 分别是Ⅰ, Ⅱ, Ⅲ型受体, 3型受体在大多数情况下共存于细胞膜上. TGF-β1活化后与细胞膜表面受体结合, 激活Smads蛋白并形成复合物, 由此转入核内与各种转录因子相结合, 从而调控基因转录[4-5]. TGF-β1在所有类型的细胞中均以无活性形式合成和分泌, 在体内通过二硫键结合而活化, 活化后可与受体结合并表现出生物活性[6].
肝纤维化的形成机制为细胞外基质(ECM)的合成和降解失调. 病理特征为胶原纤维生成及大量细胞外基质在Disse间隙沉积. 而ECM的合成和降解过程很大程度由TGF-β1控制[7]. 他既能促进基质合成, 又可抑制其降解, 同时又抑制肝细胞再生、促其凋亡, 从而使肝脏内肝实质细胞与间质成分比例失调, 使肝脏外基质代谢紊乱, 在Disse间隙过度沉积, 继之肝窦毛细血管化. 国内外的研究证实, TGF-β1与纤维化关系极为密切, 但在肝纤维化的不同阶段其来源和分布尚有不同看法. 多数学者认为, 肝纤维化时肝内TGF-β1主要由肝间质细胞合成, 而肝细胞是否为TGF-β1的来源一直存在争议. 本实验发现在不同纤维化肝组织中, TGF-β1染色阳性物质其分布及表达浓度有一定差异. S0期未见明显阳性物质; S1, S2期主要分布于汇管区、窦壁及窦内皮细胞, 肝实质细胞内未出现; S3期主要分布于纤维间隔、炎症坏死灶与纤维化发生活跃部位的肝细胞也有表达; S4期在肝细胞内可见大量染色阳性物质, 这与张敏 et al[8]研究一致, 实验提示肝纤维化早期TGF-β1表达增加主要来源于肝间质细胞, 发展至后期肝细胞亦成为重要来源. 有报道大鼠退变肝细胞中原位杂交TGF-β1 mRNA阳性[9], 也有用RT-PCR法检测培养人肝细胞TGF-β1 mRNA表达[10]. 通过肝组织病理切片TGF-β1免疫组化定量分析可以得出, 在肝纤维化早期TGF-β1的表达就有升高. 除S1, S2期无统计学差别意义外, 其余各组间有明显差异(P<0.05). 而对于其他血清肝纤维化指标, 除PCⅢ之外, 其余各项在纤维化S1期与S0期比较均无明显差异, 显示TGF-β1与PCⅢ在反映轻度纤维化或早期纤维化方面比其他各项指标更敏感. 这与Czaja et al[11]通过肝纤维动物模型得出结果相符. 实验发现肝纤维化分级与TGF-β1之间呈正相关, 因此临床可以通过定量检测TGF-β1观察病理变化及判断抗纤维化药物治疗作用.
CTGF属即刻早期基因, 最初是从人脐静脉血管内皮细胞培养上清液中分离得到, 分子量38 kDa, 富含半胱氨酸的肝磷脂多肽, 是一种新近发现的致纤维化生长因子, 实验研究认为, 星状细胞(HSC)是其主要来源, 而CTGF表达上调, 也是星状细胞活化的中心通道. CTGF在TGF-β1下游起作用, 介导TGF-β1促ECM聚集和组织器官纤维化的效应, 而TGF-β1对CTGF基因转录有明显调控作用. 人和动物的研究资料表明, 在器官纤维化时CTGF表达增加是一共同现象. CTGF长期过度表达能明显促进纤维化的发生、发展. 如果与TGF-β1共同注入小鼠皮下, 前者诱导纤维化形成, 而CTGF则促进皮下纤维化的持久延续. CTGF能被数种因子转录激活, 其中以TGF-β最引人注目, 另外, PDGF, EGF, FGF也被证实可以引起CTGF的表达, 但是其作用微弱和短暂. CTGF的主要作用是: (1)促进细胞有丝分裂和成纤维细胞增殖, 合成胶原; (2)介导细胞黏附和趋化作用; (3)诱导细胞凋亡; (4)促进血管形成. 在肝、肾、肺、胰腺、血管及皮肤等许多器官组织纤维化病变中, CTGF与TGF-β大多协同表达增加, 以提升促纤维化效应[12-14]. 临床及实验研究均发现CTGF表达增高, 与器官纤维化程度积分呈显著正相关, 而应用药物或反义核苷酸阻断CTGF表达, 可显著减少Ⅰ, Ⅲ, Ⅳ型胶原及纤维连接蛋白间表达, 显著减轻器官纤维化病理改变. Tamatani et al[15]用ELISA在胆道闭锁患者血清中检测出的CTGF的含量明显高于正常人. 此外组织学研究也显示在纤维化模型大鼠和人纤维化的肝组织中CTGF mRNA的水平均明显高于正常对照组, 且CTGF水平的增高与肝纤维化进展程度相平行, 证实了CTGF自始至终参与了纤维化的过程, 与肝纤维化的发生、发展密切相关[16-17]. Hayashi et al[18]对正常人、肝硬化及肝癌患者活检标本进行了研究, 发现在肝硬化结节纤维化区域, CTGF大量表达, 而肝细胞甚至肝癌细胞无CTGF表达, 正常肝组织无或极少表达CTGF. 提示CTGF基因表达与肝纤维化病变具有直接相关性.
我们经免疫组化检测发现, CTGF在S0期仅见于汇管区少量梭状间质细胞内, 表达水平很低, 随肝纤维化程度的增加表达呈增加趋势. 可见于小叶周围扩大的纤维组织内的成纤维细胞、窦内皮细胞、胆管上皮细胞也可表达CTGF, 但不起主导作用. 提示肝脏损伤后, 以TGF-β等多种细胞因子分泌增多, 特异性的诱导CTGF表达增加, 促进ECM合成与积聚. 结果与宋仕玲 et al[19]应用肝纤维化大鼠实验结果相似. 研究表明, CTGF与TGF-β1有良好的相关性, 相关系数为0.855 (P<0.05), 但比较起来与血清肝纤维化指标相关程度来看TGF-β1似乎更密切一些. 虽然TGF-β1是诱导胶原沉积致纤维化最重要的因子, 阻断潜在TGF-β1的活化, 抑制配体和受体间的相互作用以及抑制信号向下传导, 是有效的治疗手段; 但由于他还有抗增殖和抗炎症作用, 长期直接干预TGF-β1及其下游分子可出现严重副作用. 例如去除TGF-β1基因的小鼠因失去对炎症过程的抑制, 而在出生后很快死于全身性炎症[20]. 而CTGF对结缔组织细胞起作用, 能维持成纤维细胞表型, 在正常状态下CTGF表达水平很低, 而且主要在间质细胞中表达, 其作用亦限于结缔组织, 是一个更具特异性的靶位, 故阻断他可能逆转纤维化, 开创治疗纤维化疾病的新纪元.
从肝组织炎症活动度分级来看, G1, G2, G3, G4的肝组织内TGF-β1和CTGF表达水平均比G0显著增高, 但炎症分级处于G1, G2, G3, G4的肝组织之间相互比较TGF-β1水平却无显著性差异, 提示肝组织炎症的存在是促使TGF-β1表达的必要条件, 而与肝组织炎症活动度之间无必然联系. 而G1, G2, G3期CTGF的表达无显著性差异, G4期则有统计学意义, 这说明CTGF的表达与肝细胞炎性活动在一定程度上存在相关性, 肝纤维化程度越高, CTGF表达越强烈. 而在早期肝硬化阶段检测CTGF则有明确诊疗意义, 因而推测他可作为一个更为可靠的反映肝纤维化的检测指标.
肝纤维化是继发于肝脏炎症或损伤后组织修复的代偿反应, 是许多慢性肝病发展的普遍结果, 进一步发展则形成肝硬化, 是一种严重威胁人类健康的疾病 .
在正常状态下, CTGF表达水平很低, 而且主要在间质细胞中表达, 其作用也局限于结缔组织, 因此阻断CTGF的表达或抑制其生物活性有可能成为特异、有效的治疗纤维化的手段.
TGF-β1, CTGF与肝纤维化发生之间的关系国内外已有不少研究, 本文用免疫组织化学方法研究了人病毒性慢性肝炎组织中TGF-β1, CTGF的表达与肝纤维化程度之间的关系, 类似报道较少, 研究有一定意义.
电编: 张敏 编辑:潘伯荣
| 1. | Roberts AB, Piek E, Bottinger EP, Ashcroft G, Mitchell JB, Flanders KC. Is Smad3 a major player in signal transduction pathways leading to fibrogenesis? Chest. 2001;120:43S-47S. [PubMed] [DOI] |
| 2. | Derynck R, Jarrett JA, Chen EY, Eaton DH, Bell JR, Assoian RK, Roberts AB, Sporn MB, Goeddel DV. Human transforming growth factor-beta comple-mentary DNA sequence and expression in normal and transformed cells. Nature. 1985;316:701-705. [PubMed] [DOI] |
| 3. | Boesen CC, Radaev S, Motyka SA, Patamawenu A, Sun PD. The 1.1 A crystal structure of human TGF-beta type II receptor ligand binding domain. Structure. 2002;10:913-919. [PubMed] [DOI] |
| 6. | Massague J. TGF-beta signal transduction. Annu Rev Biochem. 1998;67:753-791. [PubMed] [DOI] |
| 7. | Akiyoshi S, Ishii M, Nemoto N, Kawabata M, Aburatani H, Miyazono K. Targets of transcriptional regulation by transforming growth factor-beta: expression profile analysis using oligonucleotide arrays. Jpn J Cancer Res. 2001;92:257-268. [PubMed] [DOI] |
| 9. | Oberhammer F, Nagy P, Tiefenbacher R, Froschl G, Bouzahzah B, Thorgeirsson SS, Carr B. The antiandrogen cyproterone acetate induces synthesis of transforming growth factor beta 1 in the parenchy-mal cells of the liver accompanied by an enhanced sensitivity to undergo apoptosis and necrosis without inflammation. Hepatology. 1996;23:329-337. [PubMed] |
| 10. | Gao C, Gressner G, Zoremba M, Gressner AM. Transforming growth factor beta (TGF-beta) expression in isolated and cultured rat hepatocytes. J Cell Physiol. 1996;167:394-405. [PubMed] [DOI] |
| 11. | Czaja MJ, Weiner FR, Flanders KC, Giambrone MA, Wind R, Biempica L, Zern MA. In vitro and in vivo association of transforming growth factor-beta 1 with hepatic fibrosis. J Cell Biol. 1989;108:2477-2482. [PubMed] [DOI] |
| 12. | Rachfal AW, Brigstock DR. Connective tissue growth factor (CTGF/CCN2) in hepatic fibrosis. Hepatol Res. 2003;26:1-9. [PubMed] [DOI] |
| 13. | Paradis V, Dargere D, Bonvoust F, Vidaud M, Segarini P, Bedossa P. Effects and regulation of connective tissue growth factor on hepatic stellate cells. Lab Invest. 2002;82:767-774. [PubMed] [DOI] |
| 14. | Tsuneyama K, Kouda W, Nakanuma Y. Portal and parenchymal alterations of the liver in idiopathic portal hypertension: a histological and immunochemical study. Pathol Res Pract. 2002;198:597-603. [PubMed] [DOI] |
| 15. | Tamatani T, Kobayashi H, Tezuka K, Sakamoto S, Suzuki K, Nakanishi T, Takigawa M, Miyano T. Establishment of the enzyme-linked immunosorbent assay for connective tissue growth factor (CTGF) and its detection in the sera of biliary atresia. Biochem Biophys Res Commun. 1998;251:748-752. [PubMed] [DOI] |
| 16. | Paradis V, Dargere D, Vidaud M, De Gouville AC, Huet S, Martinez V, Gauthier JM, Ba N, Sobesky R, Ratziu V. Expression of connective tissue growth factor in experimental rat and human liver fibrosis. Hepatology. 1999;30:968-976. [PubMed] [DOI] |
| 17. | Sedlaczek N, Jia JD, Bauer M, Herbst H, Ruehl M, Hahn EG, Schuppan D. Proliferating bile duct epithelial cells are a major source of connective tissue growth factor in rat biliary fibrosis. Am J Pathol. 2001;158:1239-1244. [PubMed] [DOI] |
| 18. | Hayashi N, Kakimuma T, Soma Y, Grotendorst GR, Tamaki K, Harada M, Igarashi A. Connective tissue growth factor is directly related to liver fibrosis. Hepatogastroenterology. 2002;49:133-135. [PubMed] |
| 20. | Letterio JJ, Bottinger EP. TGF-beta knockout and dominant-negative receptor transgenic mice. Miner Electrolyte Metab. 1998;24:161-167. [PubMed] [DOI] |