修回日期: 2006-06-26
接受日期: 2006-07-31
在线出版日期: 2006-09-08
目的: 观察肝细胞核因子4α (Hepatocyte Nuclear Factor 4α, HNF-4α)和HNF-3b在人主要组织器官中的表达情况, 为进一步探索这两个因子与慢性乙型肝炎患者HBV复制之间的可能关系提供理论基础.
方法: 采用免疫组织化学染色方法检测HNF-4α和HNF-3b在14例尸解标本的主要器官(肝、脑、肺、肾、心、脾、肠、胰腺、胃和甲状腺)中的表达情况.
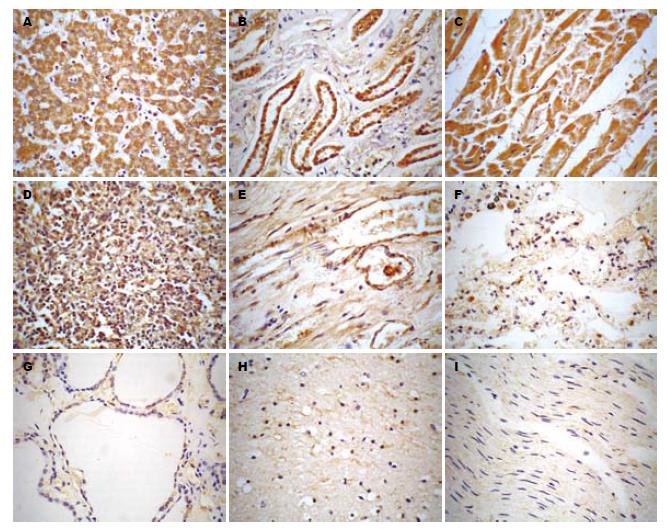
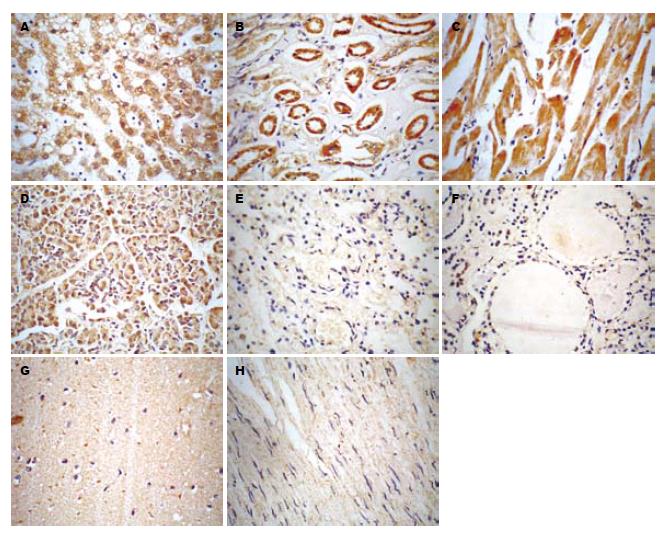
结果: HNF-4α和HNF-3β在10个器官的表达情况不同(HNF-4α: F = 22.479, P<0.01; HNF-3β: F = 13.021, P<0.01). HNF-4α在肝、肾、心、脾和肠中呈高水平表达, 在肺和甲状腺呈低水平表达; HNF-3β在肝、肾、心和胰腺中呈高水平表达, 在脾、肺、肠和甲状腺中呈低水平表达; HNF-4α和HNF-3β在脑、胃、阑尾、胸腺、肾上腺和扁桃体中均不表达; 上述HNF-4α和HNF-3β高表达组和低表达组的表达水平差异有统计学意义(P<0.05), 而高表达组各器官之间的表达水平差异无统计学意义(P>0.05).
结论: 人体各组织中HNF-4α与HNF-3b的表达水平不同, 在肝脏的表达水平较高, 这提示二者有可能参与了HBV的组织特异性复制.
引文著录: 龙云, 唐红, 刘聪, 何芳, 刘丽, 赵连三, 黄飞骏. 肝细胞核因子4α和3β在人主要器官中的表达. 世界华人消化杂志 2006; 14(25): 2504-2509
Revised: June 26, 2006
Accepted: July 31, 2006
Published online: September 8, 2006
AIM: To investigate the expression patterns of hepatocyte nuclear factor 4α (HNF-4α) and HNF-3b in normal human tissues, so as to provide the bases for further exploration of their relationships with hepatitis B virus (HBV) replication in hepatitis B patients.
METHODS: Immunohistochemistry was used to detect the expression of HNF-4α and HNF-3b in human tissues of liver, brain, lung, kidney, heart, spleen, intestine, pancreas, stomach and thyroid from 14 corpses. The differences of their expression in different tissues were analyzed.
RESULTS: The expression patterns of HNF-4α and HNF-3b was different among the 10 kinds of human tissues (HNF-4α: F = 22.479, P < 0.01; HNF-3b: F = 13.021, P < 0.01). Both HNF-4α and HNF-3b expression were not detected in brain, lung, stomach, appendix, thymus, adrenal gland and tonsil. Besides the tissues mentioned above, the expression of HNF-4α was significantly higher in liver, kidney, heart, spleen and intestines than that in the other tissues; the expression of HNF-3b was markedly higher in liver, kidney, heart and pancreas than that in the other tissues. The difference between high-level expression and low-level expression group has statistical significance (P < 0.05); however, the difference among those tissues with high-level expression had no statistical significance (P > 0.05).
CONCLUSION: The expression of HNF-4a and HNF-3b are different among human tissues, and they are highly expressed in some tissues such as liver. This result indicates that HNF-4a and HNF-3b might participate in the tissue-specific replication of HBV.
- Citation: Long Y, Tang H, Liu C, He F, Liu L, Zhao LS, Huang FJ. Expression of hepatocyte nuclear factor 4α and 3β in human tissues. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2504-2509
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2504.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2504
肝富集转录因子(liver-enriched transcription factors, LETFs)是一类主要存在于肝脏并且可以调控肝特异基因表达的转录因子, 他可以分为6大类[1]: (1)含亮氨酸拉链结构域的CCAAT/增强子结合蛋白(CCAAT/enhancer binding protein, C/EBP); (2)肝细胞核因子1家族(hepatocyte nuclear factor 1, HNF1), 含一个可变的同源结构域; (3)HNF-3家族; (4)HNF-4家族; (5)具有一个锌指DNA结合结构域的固醇类受体相关转录因子、甲胎蛋白转录因子(fetoprotein transcription factor, FTF)、人B1结合因子(human B1-binding factor, hB1F); (6)HNF6. 这些转录因子及其相互作用构成的复杂调控网络精确地控制着肝脏的早期发育及各项功能的发挥. 乙型肝炎病毒(hepatitis B virus, HBV)属嗜肝DNA病毒. 研究显示, LETFs在HBV肝特异性转录复制中具有重要的调控作用[2]. 体外细胞培养和动物实验研究表明, HNF-4α可以支持HBV在非肝源细胞中的复制[3], 而HNF-3b对HBV复制具抑制作用[4]. 但目前对HNF-4α和HNF-3b在人体组织器官中的表达情况及其与HBV复制间的相互关系尚不十分清楚. 我们利用免疫组织化学方法, 观察HNF-4α和HNF-3b在人体全身主要器官中的表达, 旨在为今后进一步探讨二者对HBV复制的可能调控机制提供理论依据.
尸解14例全身主要组织器官, 由四川大学华西基础医学与法医学院提供. 男13例, 女1例, 年龄17-78岁; 均为意外猝死, 无肝病史, 每例尸解者取8-15个组织器官不等. 全身组织器官包括肝(13例)、脑(13例)、肺(14例)、心(14例)、肠(6例)、脾(14例)、胰腺(11例)、肾(13例)、胃(3例)、甲状腺(5例)以及个别其他器官. 上述器官均由40 g/L甲醛固定.
石蜡切片厚度为3 µm. 组织芯片用二甲苯脱蜡3次, 用乙醇梯度水化, 然后用30 mL/L H2O2 37 ℃孵育20 min, 以去除内源性过氧化物酶; 微波加热3次, 进行抗原修复; 30 g/L小牛血清白蛋白封闭20 min; 吸去封闭液后加一抗, 一抗为羊抗HNF-3β和羊抗HNF-4a(美国Santa Cruz生物技术公司), 分别按1:30和1:50比例稀释, 37 ℃孵育1 h后, 4 ℃过夜; 经PBS洗涤3次后加二抗, 二抗为生物素化的兔抗山羊抗体(北京中杉金桥生物技术有限公司), 37 ℃孵育1 h; 用PBS洗涤3次后加SABC试剂(北京中杉金桥生物技术有限公司), 37 ℃孵育1 h; PBS洗涤3次后用DAB(武汉博士德生物工程有限公司)显色, 苏木素复染2 min, 10 mL/L盐酸酒精分化20 s, 树胶封片. 参照Axiotis标准[5], 由2位病理医生采用盲法独立在高倍镜(×400)下读片, 每张切片随机观察5个不重复的视野, 然后分别从染色强度和阳性细胞数进行评分, 再计算总分 = 染色强度分值+阳性细胞计数分值, 为使结果更加准确可靠, 每个标本均用3张切片进行免疫组化染色, 读片结果取平均值. 结果判读及程度分析标准(DAB显色): 染色强度为不着色或阳性细胞数<10%者评为0分; 染色强度为黄色或阳性细胞数在10%-40%者评为1分; 染色强度为棕黄色或阳性细胞数在41%-70%者评为2分; 染色强度为黄褐色或阳性细胞数>70%者评为3分. 本实验中将总分≤1分判定为不表达(无染色阳性信号), 2-3分为低水平表达(染色强度弱, 阳性细胞数少), 4-6分为高水平表达(染色强度较强, 阳性细胞数较多).
统计学处理 所得数据用F值表示, 采用SPSS 10.0软件包进行方差分析和k一致性检验, P<0.05认为有统计学意义.
免疫组织化学染色结果显示, HNF-4α在肝、肾、心、脾和肠中呈高水平表达, 在肺和甲状腺呈低水平表达; HNF-3b在肝、肾、心和胰腺中呈高水平表达, 在脾、肺、甲状腺和肠中呈低水平表达; 此外, HNF-4α和HNF-3b在喉和肌肉中也检测到少量表达, 而二者在脑、胃、阑尾、胸腺、肾上腺、扁桃体和脂肪中均未检测到表达; 由于阑尾、小脑、喉、胸腺、肾上腺、扁桃体、肌肉、脂肪的标本数相对很少(<3例), 故未纳入统计学分析(图1-2). 双人盲法读片, 结果进行k一致性检验, k值为0.658, 说明一致性较好(k值大于0.75说明一致性好, 小于0.4说明一致性不够理想). 对HNF-4α和HNF-3b在10个主要器官(肝、脑、肺、心、肠、脾、胰腺、肾、胃、甲状腺)的表达结果进行方差分析, 统计结果表明, HNF-4α和HNF-3b在上述10个器官的表达情况不同(HNF-4α: F = 22.479, P<0.01; HNF-3b: F = 13.021, P<0.01), 又对HNF-4α和HNF-3b在肝脏和在其他9个器官的表达情况进行两两比较, 以及比较HNF-4α和HNF-3b在同一器官中的表达情况, 统计结果显示, HNF-4α在肝脏中的表达水平与其在肾、心、脾、肠中的表达水平相近, 差异无统计学意义(P>0.05); HNF-4α在肝脏中的表达水平高于其在胰腺、脑、肺、胃、甲状腺中的表达水平, 差异有统计学意义(P<0.05); HNF-3b在肝脏中的表达水平与其在肾、心、胰腺中的表达水平相近, 差异无统计学意义(P>0.05); HNF-3b在肝脏中的表达水平高于其在肠、脾、脑、肺、胃、甲状腺中的表达水平, 差异有统计学意义(P<0.05). 结果提示, HNF-4α主要在人体的肝、肾、心、肠、脾中表达, 而HNF-3b则主要在肝、肾、心、胰腺中表达(表1). HNF-4α和HNF-3b在肝、肾、心、脑、胃和甲状腺中的表达水平相近, 差别无统计学意义(P>0.05), 而在肠、肺、脾和胰腺中的表达水平不同, 差别有统计学意义(P<0.05), 其中HNF-4a在肠、肺、脾的表达水平较HNF-3b高, HNF-3b则在胰腺中的表达水平较HNF-4a高(表2).
| 比较 | HNF-4α | HNF-3β | ||
| F | P | F | P | |
| 肝与肾 | 0.3846 | >0.05 | 0.2308 | >0.05 |
| 肝与心 | 0.5110 | >0.05 | 0.3516 | >0.05 |
| 肝与肠 | 0.1538 | >0.05 | 2.4231 | <0.05 |
| 肝与脾 | 0.7253 | >0.05 | 1.8516 | <0.05 |
| 肝与胰腺 | 3.0629 | <0.05 | 0.9231 | >0.05 |
| 肝与脑 | 3.7692 | <0.05 | 3.6154 | <0.05 |
| 肝与肺 | 3.4396 | <0.05 | 3.2802 | <0.05 |
| 肝与胃 | 3.4872 | <0.05 | 2.9231 | <0.05 |
| 肝与甲状腺 | 2.1538 | <0.05 | 2.1231 | <0.05 |
| 器官 | F | P | 器官 | F | P |
| 肝 | 0.346 | >0.05 | 甲状腺 | 0.038 | >0.05 |
| 肾 | 0.020 | >0.05 | 肠 | 12.097 | <0.05 |
| 心 | 0.041 | >0.05 | 肺 | 6.036 | <0.05 |
| 脑 | 0.094 | >0.05 | 脾 | 5.948 | <0.05 |
| 胃 | 0.143 | >0.05 | 胰腺 | 9.828 | <0.05 |
HNF-4α和HNF-3b均为LETFs家族的成员, LETFs是调节肝特异基因转录的关键作用因子, 在肝脏的发育过程中发挥着重要的作用[6]. HNF-4是孤类固醇激素核受体超家族成员之一, 其特征是含有2个高度保守的区域, 即位于氨基端的含2个"锌指基序"的DNA结合区和位于羧基端的配体结合区. HNF-3家族包括3个成员: HNF-3α, HNF-3b和HNF-3g, 他们都含有1个具有翼状螺旋结构的DNA结合区[7]. 在小鼠胚胎发育4.5 d, HNF-4主要在原内胚层表达, 从发育5.5 d之后, HNF-4主要表达在内脏内胚层, 而HNF-3b, HNF-3α和HNF-3g在发育过程中是依次出现的. HNF-3b mRNA最先表达在原基和节点, 紧接着是HNF-3α表达在内胚层, 顺序形成肝、肺、胰腺和消化管的组分, 而HNF-3g主要表达在消化道形成之后的内胚层[8]. 在肝脏发育早期, HNF-4即可以激活一些肝脏基因表达, 如甲状腺激素结合蛋白和α1抗胰蛋白酶以及内源性的HNF-1α[9], 另外, 他还可能是一种肿瘤抑制因子, 在肝细胞的分化和抗增殖方面起到重要作用[10-11], 尽管其转录活性可被HNF-1α所阻断, 然而其上游调控作用目前仍不清楚, 可能受一潜在的配体影响. 在小鼠胚胎发育中, HNF-3对于节点和脊索轴的形成以及内胚层的分化是必需的[12]. 另外, HNF-3还与其他LETFs作用, 共同激活肝脏特异基因, 如α1抗胰蛋白酶和HNF-1α等的表达[13-14], 且其产物还可以通过自我激活来维持其自身的合成[15]. 此外, HNF-3在调节代谢器官的分化方面也起到了关键作用. 由于HNF-3家族在胚胎发育早期表达, 具有较强的转活能力, 因此, 他可能是参与肝脏发育过程的LETFs级联调控网络中最重要的作用因子. HNF-4和HNF-3除了参与肝脏的发育过程外, 对HBV的复制也可能具有调控作用. 体外实验结果显示HNF-4α可以通过刺激前基因组RNA的合成, 从而支持HBV复制, 相反, HNF-3可以拮抗核激素受体介导的病毒复制, 这表明这些LETFs可能操纵了某些分子开关, 而这些开关限制了病毒的嗜肝性[16]. 我们的实验检测了HNF-4α和HNF-3b在人全身主要器官的分布情况, 意在为进一步探索二者与HBV的组织特异性复制之间的可能关系提供理论依据.
我们的结果显示, HNF-4α主要在肝、肾、心、脾、肠表达, 而HNF-3b主要在肝、肾、胰腺、心表达. 已有文献报道, HNF-4主要表达在成人的肝、肾、肠[17], 此外, 在结肠、胰腺和睾丸中也有少量表达. 我们的实验全面系统地检测了HNF-4α和HNF-3b在人全身主要器官中的表达情况, 且进行了表达水平的比较, 同时对HNF-4α与HNF-3b在同一器官中的相对表达水平也进行了比较, 结果可能更具参考价值. 对于HNF-3b的器官分布情况, 目前尚无详细的报道, 由于其在调节代谢器官的分化方面具有重要作用, 因此也不难解释HNF-3b在肝、肾、胰腺等代谢器官的高表达状态. 此外, 实验结果还显示, HNF-4a在脾、肠的表达水平较HNF-3b高, 而HNF-3b在胰腺的表达水平较HNF-4a高, 其可能的机制及意义还需进行深入的研究. 由于本实验中每个组织芯片只作3次免疫组化染色, 故尚不能说明同一种因子在不同个体的同一器官之间的表达一致性如何, 对于此问题的探索, 还需进一步的实验研究. 由于我们的实验仅对正常肝脏进行了检测, 结果提示, HNF-4a和HNF-3b在正常肝脏中的表达水平均较高, 而已有研究表明二者对HBV复制的调控作用却是相反的, 是否二者的表达水平在生理状态下处于一种动态平衡, 而在病理状态下水平发生了改变, 即HNF-3b水平下降而HNF-4a水平升高, 从而支持HBV在肝脏的复制, 这个可能理论尚需进一步的研究来验证. 由于HNF-3b可以激活HNF-1a, 而HNF-1a对HNF-4又具有负性调控作用, 因此, HNF-3b可以间接地抑制HNF-4a的转活作用, 即HNF-3b的存在可以部分的中和HNF-4a对HBV复制的支持作用, 这也对如胰腺这样的器官(HNF-3b的表达较HNF-4a高)为何不会出现HBV的复制作出了可能的解释. 然而, 本实验只对HNF-4a和HNF-3b进行了研究, 并未检测HNF-4和HNF-3的其他2个亚型HNF-4b, 4g以及HNF-3a, 3g的表达情况, 对于这些亚型的组织分布及可能的功能以及HNF-4a和HNF-3b及其亚型之间的相互关系, 仍需大量的实验来加以阐明. 至于为何HNF-4a和HNF-3b在某些器官表达有差异, 为何某些HNF-4a高表达器官(如脾、肠、肺等)却无HBV的复制, 是否其中有复杂的调控因子网络在起作用, 抑或在肝脏之外的某些器官二者亦存在拮抗作用, 其中的复杂机制, 还需要进行深入的探索和研究.
动物实验及体外细胞培养实验结果均已表明, LETFs中的HNF-4a和HNF-3b都参与调节HBV的复制, 且分别具有正性和负性调控作用. 但是这一结论目前尚未在人的实验中得以证实. 本实验结果显示, 人体各组织中HNF-3b与HNF-4a的表达水平不同, 在肝、肾等器官表达水平较高, 提示二者可能与HBV的组织特异性复制有关, 且可能参与了对病毒复制和转录的调控, 这为深入研究人体中HBV的复制机制奠定实验基础.
肝富集转录因子(LETFs)是一类具基因转录调控作用的蛋白质分子, 主要存在于肝脏, 他能与HBV 的4个启动子结合, 对HBV基因转录起重要调控作用. 肝细胞核因子4α(HNF-4α)和3b(HNF-3b)均为LETFs的成员, 对于其在人体各器官的分布情况, 虽曾有少数研究报道, 但仍缺乏系统性及全面性, 因此, 观察人体主要器官中二者的表达情况, 对今后进一步研究LETFs与HBV嗜肝性的可能关系, 奠定一定研究基础.
本文对HNF-4α和HNF-3b在人体各器官的分布情况进行了观察, 并且初步探讨了二者在不同器官分布不同的可能原因, 为进一步研究HNF-4α和HNF-3b这2种LETFs与HBV嗜肝性的可能关系提供理论基础.
本文观察了肝细胞核因子4α和肝细胞核因子3b在人主要组织器官中的表达情况, 探讨了这2个因子与慢性乙型肝炎患者HBV复制之间的可能关系, 具有一定学术价值.
电编: 张敏 编辑:潘伯荣
| 1. | Lannoy VJ, Rodolosse A, Pierreux CE, Rousseau GG, Lemaigre FP. Transcriptional stimulation by hepatocyte nuclear factor-6. Target-specific recruitment of either CREB-binding protein (CBP) or p300/CBP-associated factor (p/CAF). J Biol Chem. 2000;275:22098-22103. [PubMed] [DOI] |
| 2. | Tang H, Banks KE, Anderson AL, McLachlan A. Hepatitis B virus transcription and replication. Drug News Perspect. 2001;14:325-334. [PubMed] |
| 3. | Tang H, McLachlan A. Mechanisms of inhibition of nuclear hormone receptor-dependent hepatitis B virus replication by hepatocyte nuclear factor 3beta. J Virol. 2002;76:8572-8581. [PubMed] [DOI] |
| 4. | Banks KE, Anderson AL, Tang H, Hughes DE, Costa RH, McLachlan A. Hepatocyte nuclear factor 3beta inhibits hepatitis B virus replication in vivo. J Virol. 2002;76:12974-12980. [PubMed] [DOI] |
| 5. | Axiotis CA, Monteagudo C, Merino MJ, LaPorte N, Neumann RD. Immunohistochemical detection of P-glycoprotein in endometrial adenocarcinoma. Am J Pathol. 1991;138:799-806. [PubMed] |
| 6. | Hayashi Y, Wang W, Ninomiya T, Nagano H, Ohta K, Itoh H. Liver enriched transcription factors and differentiation of hepatocellular carcinoma. Mol Pathol. 1999;52:19-24. [PubMed] [DOI] |
| 7. | Lai E, Prezioso VR, Smith E, Litvin O, Costa RH, Darnell JE Jr. HNF-3A, a hepatocyte-enriched transcription factor of novel structure is regulated transcriptionally. Genes Dev. 1990;4:1427-1436. [PubMed] [DOI] |
| 8. | Monaghan AP, Kaestner KH, Grau E, Schutz G. Postimplantation expression patterns indicate a role for the mouse forkhead/HNF-3 alpha, beta and gamma genes in determination of the definitive endoderm, chordamesoderm and neuroectoderm. Development. 1993;119:567-578. [PubMed] |
| 9. | Costa RH, Grayson DR, Darnell JE Jr. Multiple hepatocyte-enriched nuclear factors function in the regulation of transthyretin and alpha 1-antitrypsin genes. Mol Cell Biol. 1989;9:1415-1425. [PubMed] [DOI] |
| 10. | Spath GF, Weiss MC. Hepatocyte nuclear factor 4 expression overcomes repression of the hepatic phenotype in dedifferentiated hepatoma cells. Mol Cell Biol. 1997;17:1913-1922. [PubMed] [DOI] |
| 11. | Spath GF, Weiss MC. Hepatocyte nuclear factor 4 provokes expression of epithelial marker genes, acting as a morphogen in dedifferentiated hepatoma cells. J Cell Biol. 1998;140:935-946. [PubMed] [DOI] |
| 12. | Weinstein DC, Ruiz i Altaba A, Chen WS, Hoodless P, Prezioso VR, Jessell TM, Darnell JE Jr. The winged-helix transcription factor HNF-3 beta is required for notochord development in the mouse embryo. Cell. 1994;78:575-588. [PubMed] [DOI] |
| 13. | Jackson DA, Rowader KE, Stevens K, Jiang C, Milos P, Zaret KS. Modulation of liver-specific transcription by interactions between hepatocyte nuclear factor 3 and nuclear factor 1 binding DNA in close apposition. Mol Cell Biol. 1993;13:2401-2410. [PubMed] [DOI] |
| 14. | Kuo CJ, Conley PB, Chen L, Sladek FM, Darnell JE Jr, Crabtree GR. A transcriptional hierarchy involved in mammalian cell-type specification. Nature. 1992;355:457-461. [PubMed] [DOI] |
| 15. | Peterson RS, Clevidence DE, Ye H, Costa RH. Hepa-tocyte nuclear factor-3 alpha promoter regulation involves recognition by cell-specific factors, thyroid transcription factor-1, and autoactivation. Cell Growth Differ. 1997;8:69-82. [PubMed] |
| 16. | Tang H, McLachlan A. Transcriptional regulation of hepatitis B virus by nuclear hormone receptors is a critical determinant of viral tropism. Proc Natl Acad Sci USA. 2001;98:1841-1846. [PubMed] [DOI] |