修回日期: 2006-05-16
接受日期: 2006-05-26
在线出版日期: 2006-09-08
目的: 研究反义肝素酶基因对人胰腺癌SW1990细胞体外增殖和侵袭能力的抑制作用.
方法: 反义肝素酶基因转染胰腺癌SW1990细胞, 并设空载体对照组和空白对照组, 以流式细胞仪检测细胞周期; 免疫组化、Western blot及RT-PCR检测肝素酶蛋白和mRNA表达; 平板克隆形成实验检测细胞增殖活性, Transwell侵袭小室模型检测细胞体外侵袭能力.
结果: 与空白组和空载组比较, 反义组细胞周期中S期比例明显减少(18.8%±2.5% vs 36.3%±2.2%, 33.2%±2.1%, P<0.01), G1期细胞比例明显升高(66.0%±2.7% vs 30.7%±3.2%, 39.8%±4.9%, P<0.01); 肝素酶蛋白及mRNA表达分别降低34.3%和37.8%; 细胞克隆形成数目减少(12.2±2.8 vs 30.8±4.4, 28.3±2.7, P<0.01); Transwell侵袭小室中24 h穿膜细胞数减少(13.0±3.5 vs 34.8±5.8, 29.4±5.6, P<0.01).
结论: 反义肝素酶基因抑制人胰腺癌SW1990细胞体外增殖及侵袭能力.
引文著录: 杨彦, 崔明, 陈陵, 段体德. 反义肝素酶基因对胰腺癌细胞体外增殖和侵袭的抑制作用. 世界华人消化杂志 2006; 14(25): 2493-2498
Revised: May 16, 2006
Accepted: May 26, 2006
Published online: September 8, 2006
AIM: To investigate the inhibitory effects of antisense heparanase gene on the proliferation and invasion of human pancreatic cancer cell line SW1990 in vitro.
METHODS: Human pancreatic cancer cell line SW1990 was transfected with the plasmid expressing antisense heparanase gene. Meanwhile, the empty vector and non-transfection group were designed. The cell cycle distribution was analyzed by flow cytometry; the protein expression of heparanase gene was detected by Western blot and immunohistochemistry, and the mRNA transcription level was assayed by reverse transcription-polymerase chain reaction (RT-PCR). The colony-forming unit assay was used to measure the ability of cell growth, and Transwell chamber model was employed to test the ability of cell invasion in vitro.
RESULTS: In comparison with the cells transfected with empty vector or without transfection, SW1990 cells transfected with antisense heparanase gene had a significant decrease in S-phase cell population (18.8% ± 2.5% vs 36.3% ± 2.2%, 33.2% ± 2.1%, both P < 0.01) and a marked increase in G1-phase cell population (66.0% ± 2.7% vs 30.7 ± 3.2%, 39.8% ± 4.9%, P < 0.01). The protein expression and mRNA transcription were decreased by 34.3% and 37.8% individually. The colony formation was largely decreased (12.2 ± 2.8 vs 30.8 ± 4.4, 28.3 ± 2.7, P < 0.01); and finally, the cells moved from the upper chamber into the lower one in Transwell chamber assay were less than those in the control groups (13.0 ± 3.5 vs 34.8 ± 5.8, 29.4 ± 5.6, P < 0.01).
CONCLUSION: Transfection of antisense heparanase gene can inhibit the ability of cell proliferation and invasion in human pancreatic cancer cell lines SW1990 in vitro.
- Citation: Yang Y, Cui M, Chen L, Duan TD. Inhibitory effects of antisence haparanase gene on proliferation and invasion of human pancreatic cancer cell line SW1990 in vitro. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2493-2498
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2493.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2493
乙酰肝素酶(heparanase, Hpa)是新近克隆成功的一种葡萄糖苷内切酶, 能特异性识别、裂解细胞外基质和基底膜的主要成分硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycans, HSPG)的硫酸肝素(heparan sulfate, HS)侧链, 同多种恶性肿瘤的转移、侵袭和预后相关[1-5]. 研究表明, 胰腺癌中Hpa高表达, 并同胰腺癌的预后呈负相关[6-7]. 针对肿瘤的肝素酶基因的反义寡核苷酸治疗已有报道, 但未见反义肝素酶基因在胰腺癌方面的研究报道. 我们采用前期实验构建成功人肝素酶反义荧光真核表达载体(pIRES2-EGFP-aHpa)稳定转染的人胰腺癌细胞株SW1990[8], 并利用流式细胞术、免疫组化、分子杂交和体外侵袭模型等方法研究反义肝素酶基因对胰腺癌细胞SW1990体外增殖活性和侵袭能力的影响, 为进一步探讨反义肝素酶基因抗胰腺癌侵袭的分子机制提供有价值的实验依据.
人胰腺癌高转移细胞株SW1990由第二军医大学王力博士惠赠. 含人肝素酶cDNA全长基因表达质粒pcDNA3-Hpa、荧光真核表达载体pIRES2-EGFP由第三军医大学杨仕明博士惠赠. DOTAP脂质体转染试剂(德国Roche), 兔抗人Hpa多克隆抗体(美国Santa Cruz); 逆转录试剂盒(美国Promega), Trizol试剂(美国Gibco), Transwell侵袭小室(美国Costar), Matrigel人工基质胶(美国BD), PCR仪(美国AmplitronⅡ), 紫外分光光度仪(美国Beckman), 电泳仪(美国Bio-Rad, PAC3000), 图像分析仪(美国Tebuas 6803), 流式细胞仪(美国BD, FACSCalibur).
采用前期实验成功转染反义肝素酶基因表达质粒(pIRES2-EGFP-aHpa)、绿色荧光表达质粒pIRES2-EGFP的胰腺癌SW1990细胞和未转染基因的SW1990细胞[8], 分别称为反义组(胰腺癌SW1990细胞转染反义肝素酶基因)、空载组(细胞仅转染pIRES2-EGFP空载体)和空白组(细胞未转染基因及空载体). 细胞培养于含100 mL/L胎牛血清DMEM培养液中, 37 ℃, 50 mL/L CO2环境下, 采用台盼蓝计数, 保持细胞活力>90%.
1.2.1 免疫组化检测转染细胞Hpa表达: 采用链霉素-生物素免疫组织化学染色(SP)法, 主要操作步骤如下: 将盖玻片置培养皿中, 细胞按2×107/L密度接种于培养皿中制备细胞爬片. 细胞爬片以40 g/L多聚甲醛室温下固定10 min, PBS冲洗, 5 g/L Triton X-100孵育20 min, PBS清洗, 30 mL/L H2O2孵育, 10 mL/L正常山羊血清封闭非特异性抗原, 加1:100兔抗人肝素酶一抗工作液, 4 ℃孵育过夜后加入生物素化羊抗兔二抗工作液, 37 ℃孵育, PBS冲洗, DAB显色, 苏木素复染, 封片. PBS代替一抗为阴性对照. 显微镜观察阳性细胞数及染色强度.
1.2.2 RT-PCR法检测转染细胞Hpa mRNA表达: 取转染后继续培养48 h的SW1990细胞, 以TRIzol法提取总RNA, 以紫外分光光度计检验纯度并定量. 按逆转录试剂盒说明书步骤进行实验. 应用军事医学科学院的Gold Key软件设计PCR引物, 上游引物: 5'-GTGATGAGGCAAGTATTCTTT GGAGCA-3'; 下游引物: 5'-TTCTAAGACCTTTGGGACCTCATGGAT-3', 理论扩增片段长度327 bp, 由中国科学院微生物研究所基因工程中心Backman实验室合成. 逆转录体系于97 ℃变性10 min后冰浴5 min, 加Taq酶1 μL, 放入PCR仪进行核酸扩增. 循环参数: 94 ℃ 90 s, 56 ℃ 120 s, 72 ℃ 60 s, 共35个循环, 结束前72 ℃延伸10 min. 反应产物经1 g/L琼脂糖凝胶电泳后在图像分析仪下分析扩增条带灰度, 以IDV (integrated density value)值进行半定量分析.
1.2.3 Western blot法检测转染细胞Hpa蛋白表达: 取转染后继续培养的3组SW1990细胞, 加冰预冷的裂解缓冲液裂解细胞, 离心取上清液50 μL(约含蛋白质50 μg)于试管中, 行100 g/L聚丙烯酰胺凝胶电泳, 电转至硝酸纤维素膜. 5 g/L脱脂奶粉封闭非特异性抗原, 加入1:500兔抗人Hpa多克隆抗体, 室温孵育1 h, 洗膜后加入辣根过氧化物酶标记的山羊抗小鼠二抗, 室温1 h, DAB显色, 以蛋白条带的IDV值进行半定量分析.
1.2.4 流式细胞仪检测细胞周期: 3组细胞胰蛋白酶消化成单细胞悬液, 离心重悬后冷70 g/L乙醇固定, 4 ℃保存. PBS液清洗后加入碘化丙啶(PI)染液, 混匀, 4 ℃放置30 min, 300目尼龙膜过滤, 调整细胞浓度1×109/L, 流式细胞仪检测并软件分析结果, 每组重复3次.
1.2.5 平板克隆形成实验检测细胞克隆形成能力: 3组细胞消化成细胞悬液, 并作梯度倍比稀释, 按每孔50个细胞接种于24孔板, 每组细胞各接种6孔. 静止培养2-3 wk, 当培养板中出现肉眼可见的克隆时, 终止培养. PBS清洗后加纯甲醇1 mL固定15 min, 吉姆萨液染色. 将培养板置于显微镜低倍下计数大于50个细胞的克隆数, 按公式计算克隆形成率. 克隆形成率(%) = 克隆数 /接种细胞数×100%
1.2.6 Transwell侵袭小室模型测定细胞体外侵袭能力: 将浓度为0.5 g/L Matrigel人工基质胶20 μL铺于Transwell侵袭小室聚碳酯微孔膜(孔径8 μm)的上表面, 置37 ℃ 30 min使其聚成凝胶. Transwell上室中分别加入已消化重悬的各组细胞100 μL (1×108/L), 下室中加入600 μL含趋化因子无血清DMEM培养基, 培养24 h后取出, PBS清洗, 棉签去除滤膜上层细胞, 将已经侵入并贴附于微孔膜下层的细胞固定并吉姆萨液染色, 显微镜下直接观察穿过膜的细胞数. 随机计数5个视野, 计数每个视野内穿过8 μm微孔的细胞数. 以侵袭细胞的相对数目来表示肿瘤细胞的侵袭能力.
统计学处理 所有计量资料以mean±SD表示, 采用t检验, P<0.05为统计学差异显著, 以SPSS 10.0软件进行统计分析.
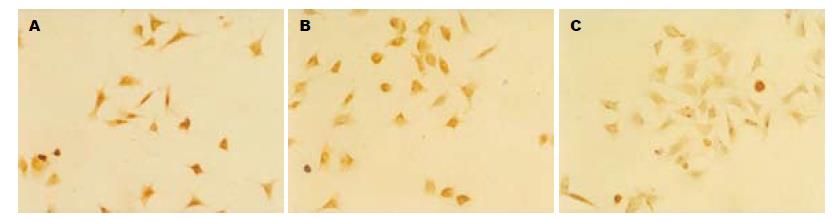
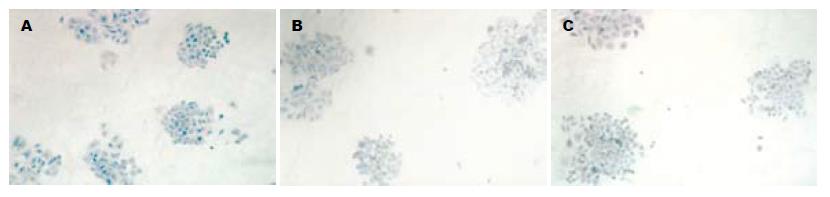
3组细胞中均出现棕褐色颗粒状染色, 提示各组细胞均有肝素酶表达, 但反义组细胞表达强度明显较空白组和空载组减弱, 对照组和空载组之间无明显差别(图1), 表明反义Hpa基因转染抑制SW1990细胞肝素酶表达.
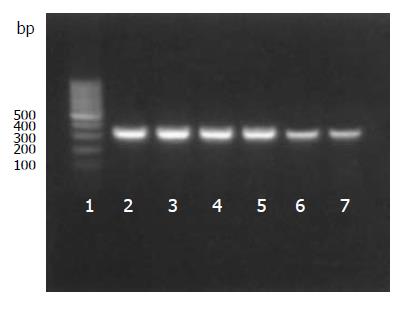
3组细胞Hpa mRNA的特异扩增片段长度为327 bp, 与理论设计扩增长度一致(图2), 图像分析仪分析空白组、空载组、反义组扩增条带灰度(IDV值), 反义组同对照组比较明显降低, 差异有显著意义(t = 2.99, P = 0.04<0.05), 空白组与空载组比较无差异, 反义组Hpa mRNA表达较空白组降低34.3%(表1). 表明反义Hpa基因转染抑制细胞Hpa mRNA表达.
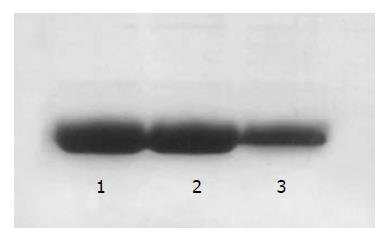
3组细胞均有Hpa蛋白表达(图3), 灰度检测提示反义组Hpa蛋白表达明显降低(t = 5.44, P = 0.00<0.01), 较空白组降低37.8%, 空白组与空载组比较无差异(表1), 表明反义Hpa基因转染抑制细胞Hpa蛋白表达.
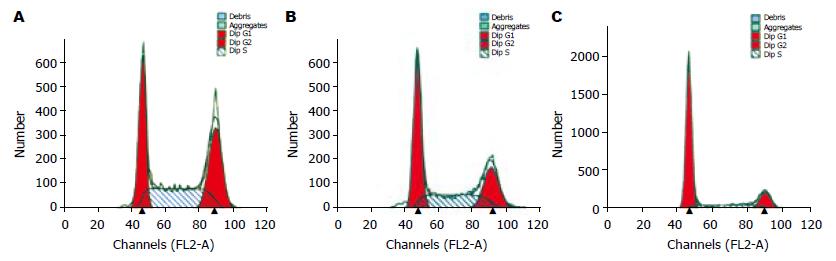
空白组、空载组、反义组S期细胞所占比例分别为36.3%±2.2%, 33.2%±2.1%和18.8%±2.5%, G1期分别为30.7%±3.2%, 39.8%±4.9%和66.0%±2.7%, 反义组与对照组比较, S期细胞比例明显降低(t = 9.10, P = 0.00<0.01), 而G1期细胞比例明显升高, 比较均有显著差异(t = 14.60, P = 0.00<0.01), 表明反义肝素酶基因转染后, SW1990细胞DNA合成期所占的细胞比例明显减少, 而停滞于G1期的细胞明显增多, 提示反义Hpa基因转染抑制细胞DNA合成能力(图4).
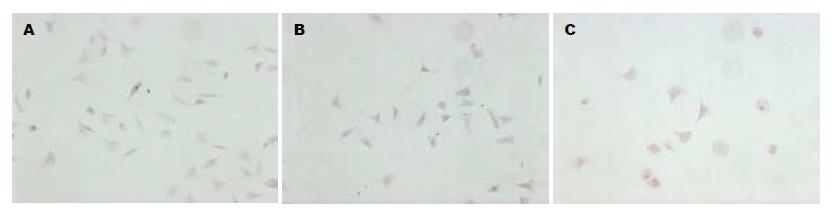
3组细胞培养2 wk后均有克隆形成(图5), 反义组克隆形成数、克隆形成率较对照组明显减少, 差异有显著意义(t = 8.74, P = 0.00<0.01), 空白组与空载组比较无差异(表2). 表明反义Hpa基因转染降低SW1990细胞克隆形成能力, 细胞增殖活性受抑.
胰腺癌由于解剖位置特殊和生物学侵袭性高, 症状缺乏特异性, 易发生早期转移, 因而确诊时多属晚期, 手术切除率仅为20%左右, 术后5年生存率不到5%, 是预后最差的消化道恶性肿瘤之一[9-10]. 肿瘤局部浸润和远处转移是影响手术效果和生存期的主要原因. 尽管胰腺癌的综合治疗得到不断发展完善, 但当前的治疗效果仍不满意. 针对胰腺癌发生、发展的分子机制, 确立新的防治靶点是提高疗效的关键, 具有重要性意义. 过去的研究揭示了肿瘤浸润和转移是一个复杂的多步骤的连续过程, 包括癌细胞在原发部位的生长以及向周围组织的侵袭和远处转移等一系列过程, 其中肿瘤细胞的恶性增殖和细胞外基质降解是其中的重要步骤, 但有关调控肿瘤细胞浸润和转移的分子机制尚不清楚.
Hpa是一种β-D-葡萄糖苷酸内切酶, 他能够裂解HS侧链, 进而破坏由细胞外基质和基底膜组成的屏障结构, 在肿瘤细胞浸润、转移和肿瘤血管形成过程中起着重要作用[11-14]. Hpa基因位于人染色体4q21.3, 由Vlodavsky, Hulett et al于1999年分离并克隆. 现已明确Hpa促进肿瘤侵袭和转移的机制有[15-18]: (1)降解HSPG, 破坏细胞侵袭的屏障; (2)促肿瘤血管生成, 直接作用于内皮细胞以生芽方式促进血管生成和间接地释放和活化了HS结合的多种生长因子(如碱性成纤维细胞生长因子、血管内皮生长因子等), 促进肿瘤血管形成; (3)介导细胞对ECM及BM的黏附, 引起细胞在基质中的扩散以及促进BM的重塑, 帮助肿瘤细胞侵入血管; (4)HSPG降解后产生的HS片段可激活HS的受体CD44v3, 发出细胞内迁移信号, 从而促进肿瘤细胞的扩散与转移; (5)HSPG降解后的产物可以抑制活化的T淋巴细胞, 从而引起免疫抑制, 促进肿瘤转移. 研究表明, 肝素酶同多种肿瘤的侵袭、转移及预后相关, 肿瘤细胞恶性程度越高、转移潜能越大、生长速度越快, 其表达水平越高, 而良性肿瘤则低水平表达. 因此, 人们推测Hpa可能是肿瘤细胞侵袭转移所必备的前提条件之一, Hpa可望成为肿瘤转移生物治疗的一个新的基因靶点.
利用反义核酸对肿瘤进行反义基因治疗是近十几年兴起的一项治疗肿瘤的新技术, 其原理是利用反义核酸与其靶基因或基因产物互补形成一种特殊的基因封条结构, 在转录或翻译水平阻断靶基因的异常表达, 阻断细胞内异常信号的传导, 促进细胞正常分化或诱导细胞凋亡, 以达到治疗肿瘤的目的. 反义核酸所针对的靶点应该是在肿瘤发生、发展中起关键作用的一种或几种癌基因、抗癌基因、自分泌生长因子及其受体基因等[19]. 近年来, 针对Hpa基因的反义核酸治疗显示对肿瘤的生长和转移有良好的抑制作用, 尽管还在实验室阶段, 但已显示出诱人前景. Uno et al[20]构建了含有全长人Hpa cDNA序列的反义腺病毒载体, 将此反义腺病毒转染高表达Hpa的肿瘤细胞株后, 发现Hpa基因的表达受到抑制, 而且Hpa反义腺病毒不仅在体外抑制肿瘤细胞的浸润能力, 在体内也可抑制肿瘤细胞的胸膜播散. Edovitsky et al[21]将直接作用于Hpa mRNA的锤头状的抗Hpa核酶或siRNA重组到质粒载体中, 再转染到人乳腺癌、鼠淋巴瘤和黑色素瘤细胞株中, 体外实验发现被转染的细胞株Hpa表达水平下降, 侵袭力和黏附力显著降低, 动物在体内实验表现为血管分布减少, 转移能力的下降.
研究培养肿瘤细胞增殖和侵袭能力的方法有细胞生长曲线、细胞周期分析、细胞克隆形成实验、体外侵袭实验等, 通过这些实验可以对肿瘤细胞的增殖和侵袭能力进行综合判断. 增殖和侵袭能力高者细胞体外生存能力强, 恶性程度高, 体内易发生转移[22]. 我们利用前期实验转染反义人肝素酶基因的人胰腺癌高转移细胞株SW1990, 通过细胞周期分析、细胞克隆形成实验、体外侵袭实验等研究反义肝素酶基因对胰腺癌细胞的体外增殖和侵袭活性的影响, 结果发现, 转染反义Hpa基因的细胞克隆形成数、克隆形成率、Transwell侵袭小室中穿膜细胞数均明显较对照组降低; 细胞周期分析发现其处于DNA合成期的细胞明显减少, 而停滞于G1期的细胞明显增多. 上述结果表明反义Hpa基因转染明显抑制了胰腺癌细胞的增殖与侵袭能力, 显示出反义Hpa基因在胰腺癌治疗中的前景.
我们进一步采用免疫组化和Western blot免疫印迹方法在蛋白水平上、用RT-PCR方法在mRNA水平上检测了胰腺癌细胞Hpa的表达, 结果发现转染了反义基因的胰腺癌SW1990细胞Hpa表达明显较对照组降低, 显示反义Hpa基因对SW1990细胞表达Hpa有较强的抑制作用, 提示反义Hpa基因抗胰腺癌增殖和侵袭的分子机制可能是其在基因转录水平上其下调了肝素酶的表达, 从而改变胰腺癌细胞的生长周期, 抑制癌细胞增殖及侵袭, 但是这种调控机制尚需进一步深入研究.
第三军医大学西南医院消化专科中心杨仕明博士提供质粒载体、肝素酶抗体及部分实验经费.
胰腺癌生物学侵袭性高, 易发生早期转移, 确诊时多属晚期, 手术切除率仅为20%左右, 术后5年生存率不到5%, 是预后最差的消化道恶性肿瘤之一, 针对胰腺癌转移发生、发展的分子机制, 确立新的转移防治靶点是提高疗效的关键.
肝素酶是惟一能特异性识别、裂解硫酸乙酰肝素蛋白多糖的硫酸肝素侧链的一种葡萄糖苷内切酶, 可通过降解ECM和BM中的HSPG, 破坏限制肿瘤转移的屏障, 同时促进肿瘤血管形成, 从而促进肿瘤生长和转移. 肝素酶同多种恶性肿瘤的转移、侵袭和预后相关, 由此推测肝素酶可能是肿瘤细胞侵袭转移所必备的前提条件之一, 可望成为肿瘤转移治疗的一个新的基因靶点.
Uno et al构建含有全长人Hpa cDNA序列的反义腺病毒载体, 并转染高表达Hpa的肿瘤细胞株后, 发现Hpa基因的表达受到抑制, 而且在体外和体内均能抑制肿瘤细胞的浸润能力. Edovitsky et al将直接作用于Hpa mRNA的锤头状的抗Hpa核酶或siRNA重组到质粒载体中, 再转染肿瘤细胞株中, 发现被转染的细胞株Hpa表达水平下降, 侵袭力和黏附力显著降低, 动物在体内实验表现为血管分布减少, 转移能力的下降.
针对肿瘤的肝素酶基因的反义寡核苷酸治疗已有报道, 但未见反义肝素酶基因对胰腺癌细胞抑制作用的研究报道.
本研究通过体外实验研究反义肝素酶基因对胰腺癌的抑制作用, 试图找到一种抑制胰腺癌生长和转移的新途径, 为反义肝素酶基因在临床治疗胰腺癌提供实验依据.
硫酸乙酰肝素蛋白多糖(heparan sulfate proteogly-cans, HSPG): 是一种蛋白聚糖类碳水化合物, 是脊椎动物和无脊椎动物组织细胞外基质(extracellular matrix, ECM)和基底膜(basement membrane, BM)的主要成分之一, 能与细胞表面及ECM中的活性分子结合, 黏附于细胞表面, 是ECM聚集和稳定的基础, 在组织构成、血管形成和细胞黏附等诸多方面发挥重要的生理作用.
本文将反义肝素酶基因转染胰腺癌细胞后通过RT-PCR, Western blot和免疫组化分别在mRNA、蛋白及细胞水平检测肝素酶表达的改变, 并进一步通过平板克隆及Transwell模型检测胰腺癌细胞增殖及浸润能力的改变, 同时通过流式细胞术检测细胞周期的改变, 从而进一步探讨其作用机制, 有较好的学术价值及应用前景. 不足之处在于, 讨论中未能紧密结合实验结果展开讨论其作用机制.
电编: 张敏 编辑:潘伯荣
| 1. | Maxhimer JB, Quiros RM, Stewart R, Dowlatshahi K, Gattuso P, Fan M, Prinz RA, Xu X. Heparanase-1 expression is associated with the metastatic potential of breast cancer. Surgery. 2002;132:326-333. [PubMed] [DOI] |
| 2. | Gohji K, Okamoto M, Kitazawa S, Toyoshima M, Dong J, Katsuoka Y, Nakajima M. Heparanase protein and gene expression in bladder cancer. J Urol. 2001;166:1286-1290. [PubMed] [DOI] |
| 3. | Friedmann Y, Vlodavsky I, Aingorn H, Aviv A, Peretz T, Pecker I, Pappo O. Expression of heparanase in normal, dysplastic, and neoplastic human colonic mucosa and stroma. Evidence for its role in colonic tumorigenesis. Am J Pathol. 2000;157:1167-1175. [PubMed] [DOI] |
| 4. | El-Assal ON, Yamanoi A, Ono T, Kohno H, Nagasue N. The clinicopathological significance of heparanase and basic fibroblast growth factor expressions in hepatocellular carcinoma. Clin Cancer Res. 2001;7:1299-1305. [PubMed] |
| 5. | Tang W, Nakamura Y, Tsujimoto M, Sato M, Wang X, Kurozumi K, Nakahara M, Nakao K, Nakamura M, Mori I. Heparanase: a key enzyme in invasion and metastasis of gastric carcinoma. Mod Pathol. 2002;15:593-598. [PubMed] [DOI] |
| 6. | Koliopanos A, Friess H, Kleeff J, Shi X, Liao Q, Pecker I, Vlodavsky I, Zimmermann A, Buchler MW. Heparanase expression in primary and metastatic pancreatic cancer. Cancer Res. 2001;61:4655-4659. [PubMed] |
| 7. | Rohloff J, Zinke J, Schoppmeyer K, Tannapfel A, Witzigmann H, Mossner J, Wittekind C, Caca K. Heparanase expression is a prognostic indicator for postoperative survival in pancreatic adenocarcinoma. Br J Cancer. 2002;86:1270-1275. [PubMed] [DOI] |
| 10. | Yoshizawa K, Nagai H, Kurihara K, Sata N, Kawai T, Saito K. Long-term survival after surgical resection for pancreatic cancer. Hepatogastroenterology. 2001;48:1153-1156. [PubMed] |
| 11. | Vlodavsky I, Friedmann Y, Elkin M, Aingorn H, Atzmon R, Ishai-Michaeli R, Bitan M, Pappo O, Peretz T, Michal I. Mammalian heparanase: gene cloning, expression and function in tumor progression and metastasis. Nat Med. 1999;5:793-802. [PubMed] [DOI] |
| 12. | Dong J, Kukula AK, Toyoshima M, Nakajima M. Genomic organization and chromosome localization of the newly identified human heparanase gene. Gene. 2000;253:171-178. [PubMed] [DOI] |
| 13. | Vlodavsky I, Friedmann Y. Molecular properties and involvement of heparanase in cancer metastasis and angiogenesis. J Clin Invest. 2001;108:341-347. [PubMed] [DOI] |
| 14. | Goldshmidt O, Zcharia E, Abramovitch R, Metzger S, Aingorn H, Friedmann Y, Schirrmacher V, Mitrani E, Vlodavsky I. Cell surface expression and secretion of heparanase markedly promote tumor angiogenesis and metastasis. Proc Natl Acad Sci USA. 2002;99:10031-10036. [PubMed] [DOI] |
| 15. | Gohji K, Katsuoka Y, Okamoto M, Kamidono S, Kitazawa S, Toyoshima M, Dong J, Nakajima M. Human heparanase: roles in invasion and metastasis of cancer. Hinyokika Kiyo. 2000;46:757-762. [PubMed] |
| 16. | Goldshmidt O, Zcharia E, Cohen M, Aingorn H, Cohen I, Nadav L, Katz BZ, Geiger B, Vlodavsky I. Heparanase mediates cell adhesion independent of its enzymatic activity. FASEB J. 2003;17:1015-1025. [PubMed] [DOI] |
| 17. | Kuniyasu H, Chihara Y, Kubozoe T, Takahashi T. Co-expression of CD44v3 and heparanase is correlated with metastasis of human colon cancer. Int J Mol Med. 2002;10:333-337. [PubMed] [DOI] |
| 18. | Elkin M, Ilan N, Ishai-Michaeli R, Friedmann Y, Papo O, Pecker I, Vlodavsky I. Heparanase as mediator of angiogenesis: mode of action. FASEB J. 2001;15:1661-1663. [PubMed] [DOI] |
| 19. | Crooke ST. Molecular mechanisms of action of antisense drugs. Biochim Biophys Acta. 1999;1489:31-44. [PubMed] [DOI] |
| 20. | Uno F, Fujiwara T, Takata Y, Ohtani S, Katsuda K, Takaoka M, Ohkawa T, Naomoto Y, Nakajima M, Tanaka N. Antisense-mediated suppression of human heparanase gene expression inhibits pleural dissemination of human cancer cells. Cancer Res. 2001;61:7855-7860. [PubMed] |
| 21. | Edovitsky E, Elkin M, Zcharia E, Peretz T, Vlodavsky I. Heparanase gene silencing, tumor invasiveness, angiogenesis, and metastasis. J Natl Cancer Inst. 2004;96:1219-1230. [PubMed] [DOI] |