修回日期: 2006-02-26
接受日期: 2006-03-03
在线出版日期: 2006-09-08
目的: 探讨丹参降门脉压作用是否与抑制ET-1介导的HSCs [Ca2+]i升高有关.
方法: 制备丹参浸膏借助激光共聚焦显微镜(LSCM)观察丹参对ET-1介导HSCs [Ca2+]i升高的影响.
结果: 含钙细胞培养液(A液)中加入浓度梯度的ET-1后, 荧光强度逐渐增加, 作出累积反应曲线后, EC50值约在1.1×10-9 mol/L, 此浓度的ET-1作用于A液和B液, 钙波持续时间相比有显著性差异(165.2±10.1 s vs 91.0±7.2 s, P<0.01), 而钙峰值相比无显著性差异. 丹参预处理A液后加入ET-1, 钙波持续时间同ET-1相比有显著性降低(69.1±12.5 s vs 165.2±10.1 s, P<0.01). 丹参预处理B液后加入ET-1, 同丹参处理A液组相比钙峰值和钙波持续时间均无显著性差异(P>0.05). 丹参预处理后, 加入KCl可降低其诱发的[Ca2+]i的升高, 钙峰值(78.0%±6.1%→26.3%±1.2%, P<0.01)和钙波持续时间(70.8±10.4 s→15.9±5.1 s, P<0.01)均明显下降.
结论: 丹参可抑制ET-1引发的细胞内钙释放, 而与外钙内流关系不大, 同时可抑制KCl诱发的钙内流, 表明丹参具有电压依赖性钙通道阻断作用.
引文著录: 姚冬梅, 房澍名, 杨川杰, 修贺明, 苏素文, 姚希贤. 丹参对内皮素-1介导的肝星状细胞Ca2+的影响机制. 世界华人消化杂志 2006; 14(25): 2488-2492
Revised: February 26, 2006
Accepted: March 3, 2006
Published online: September 8, 2006
AIM: To investigate the effect of radix salviae miltiorrhizae (RSM) on the changes of [Ca2+]i induced by endothelin-1 (ET-1) in hepatic stellate cells (HSCs).
METHODS: After preparation of RSM cream, the effects of RSM on ET-1-induced changes of HSCs [Ca2+]i were observed by laser scanning confocal microscopy.
RESULTS: In normal buffer (including Ca2+, buffer A), the fluorescence intensity was enhanced accordingly with the increase of ET-1 concentration. The cumulative-response curve showed EC50 was 1.1×10-9 mol/L. After incubation of HSCs with ET-1 in buffer A and buffer B (absence of extracellular calcium, EGTA), the duration of calcium peak had significant difference (165.2 ± 10.1 s vs 91.0 ± 7.2 s, P < 0.01), while the value of calcium peak had no significant difference. The ET-1-induced duration of calcium wave decreased markedly in the cells pretreated with RSM in buffer A as compared with that in the ones treated by ET-1 alone (69.1 ± 12.5 s vs 165.2 ± 10.1 s, P < 0.01). The calcium peak value and duration of calcium wave had no significant changes between the cells pre-incubated with RSM in buffer B and A (P > 0.05). In the cells pre-incubated with RSM, KCl-induced elevation of [Ca2+]i was decreased, and the calcium peak value (78.0% ± 6.1% → 26.3% ± 1.2%, P < 0.01) and duration of calcium wave (70.8 ± 10.4 s → 15.9 ± 5.1 s, P < 0.01) were decreased significantly.
CONCLUSION: RSM inhibits ET-1-induced depletion of intracellular calcium, which has no correlations with the influx of extracellular calcium. RSM can also inhibit KCl-induced influx of calcium, indicating its characteristic of blocking voltage-operated Ca2+ channel.
- Citation: Yao DM, Fang SM, Yang CJ, Xiu HM, Su SW, Yao XX. Effects of radix salviae miltiorrhizae on endothelin-1-induced calcium changes in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2488-2492
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2488.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2488
近年来对丹参(radix salviae miltiorrhizae, RSM)、RSM复方制剂及RSM有效成分在慢性肝病治疗中的作用得到广泛共识, 并通过动物实验与临床研究证实了其抗肝纤维化的作用机制[1]. 但目前尚缺乏其在肝硬化门脉高压治疗的研究, Yao et al[2]通过胆总管结扎法, 制备犬肝硬变门脉高压模型, 表明RSM可降低肝硬化犬门静脉压力, 但其机制尚未完全阐明. 肝星状细胞(hepatic stellate cells, HSCs)收缩是介导肝硬化门脉高压的主要因素, 其中内皮素-1 (endothelin-1, ET-1)引起的收缩反应最强. RSM降门脉压作用是否与抑制ET-1引起的HSCs收缩有关, 目前尚乏研究. 因此, 我们制备RSM纯化浸膏借助激光共聚焦显微镜(laser scanning confocal microscopy, LSCM)技术, 进一步从细胞水平探讨RSM降门脉压作用的机制.
肝星状细胞株CFSC由美国Greenwel教授建株并惠赠, 其表型为活化的HSCs. 激光共聚焦显微镜(Leica DM IRBE), ET-1(美国Sigma公司), Fluo-3, AM Ester(美国Biotium公司). RSM(石家庄市乐仁堂)500 g, 加蒸馏水, 文火煮沸20 min, 取药液纱布过滤, 共2次, 将2次药液混合后以4000 r/min离心15 min, 取上清, 加95 mL/L乙醇至60%-80%体积, 0-4 ℃静置过夜. 弃沉淀, 取上清于旋转蒸发仪负压蒸馏, 蒸干乙醇和水份后即得RSM浸膏, 并稀释成生药50 g/L备用. 正常含钙细胞培养液(A液, mmol/L): NaCl 130, KCl 2.7, CaCl2 1.5, MgCl2 2, HEPES 10, glucose 10, pH 7.4 (NaOH); 无钙细胞培养液(B液, mmol/L, 用钙螯合剂EGTA替代CaCl2以去除细胞外液Ca2+): NaCl 130, KCl 2.7, EGTA 1, MgCl2 2, HEPES 10, glucose 10, pH 7.4 (NaOH).
1.2.1 钙荧光探针的负载: 钙荧光探针Fluo-3/AM用纯DMSO配成1 mmol/L的储备液, -20 ℃避光保存备用. 促溶剂F-127溶于DMSO (F-127:DMSO质量比为1:5)室温保存备用. 实验前取1 μL Fluo-3/AM储备液溶于1 mL A液, 再加入1 μL F-127, 混匀后向培养板中加500 μL Fluo-3/AM, 终浓度为1 μmol/L. 37 ℃避光孵育约30 min, 吸去负载液, 再用A液或B液漂洗爬片2-3次, 用滤纸尽量吸干盖玻片的液体后, 将其放置于倒置显微镜上端的浴槽中, 加入500 μL细胞培养液(A或B液), 待上机检测HSCs胞质游离钙([Ca2+]i).
1.2.2 LSCM检测HSCs [Ca2+]i: 将负载好的细胞放在LSCM的载物台上, 调节焦距使图像达到最清晰, 选取活性良好的HSCs进行实验观察. 激发波长488 nm, 发射波长530 nm, 40倍物镜, XYT扫描方式, 在Time Series程序下开始预扫描, 根据细胞对药物反应的预实验结果, 扫描时间间隔5 s, 用药后观察300 s. 计算细胞面积变化时观察时间延长至600 s, 该浓度的Fluo-3/AM对细胞形态无影响, 细胞核位置正常, 细胞内钙荧光强度无明显波动. 据干预因素的不同分为以下5组(每组n = 5): (1)对照组: 按ET-1组加药时间顺次向A液加入与实验组同等体积的生理盐水; (2)ET-1组(10-12, 10-11, 10-10, 10-9, 10-8, 10-7, 10-6 mol/L): 从低浓度开始向A液顺次加入ET-1, 根据预实验结果, 每次加药时间选择在上一浓度ET-1作用达峰值时刻, 作出浓度累积反应曲线, 选择EC50(达到最大效应50%时所对应的浓度)作为以后的实验浓度; (3)EC50 ET-1组: 向A液加入1.1×10-9 mol/L ET-1; (4)EC50 ET-1组: 向B液加入1.1×10-9 mol/L ET-1; (5)RSM+ET-1组: 4.22 g/L RSM预处理10 min后, 加入ET-1; (6)EGTA+RSM+ET-1组: 在B液中加入RSM 4.22 g/L 10 min后加入ET-1; (7)RSM+KCl组: 4.22 g/L RSM预处理10 min后, 加入100 mmol/L KCl. 每个被染色细胞只使用一次, 加上述干预前细胞在培养液中需稳定5-10 min. 利用LSCM所配备的计算与图像软件(Leica confocal software, TCS SP2), 计算并绘制荧光强度相对值在加药前后随时间的动态变化曲线, [Ca2+]i的变化用Fluo-3/AM与Ca2+结合后荧光强度变化百分数表示, 荧光强度越大, [Ca2+]i越高. [Ca2+]i荧光强度变化百分数(%) = (F-F0)/F0×100%, 其中F为LSCM测量时整个细胞的平均荧光强度, F0为用药前的[Ca2+]i荧光强度. 利用LSCM配备的面积分析软件计算面积变化的百分数(%) = (S-S0)/S0×100%, 其中S为给药后细胞面积, S0为用药前的细胞面积.
统计学处理 所有结果以mean±SD表示, 组间比较采用独立样本t检验, 同一标本给药前后用配对t检验. 应用SPSS 10.0统计软件处理, 以P<0.05为有统计学差异.
LSCM下Ca2+成像的HSCs仍可见普通倒置显微镜下的形态特征, 细胞内[Ca2+]i的浓度的高低由细胞被激发出的荧光强弱表示, 荧光强度越强表示[Ca2+]i浓度越高, 反之则越低. 本实验HSCs与Fluo-3/AM孵育后, 所有细胞均被染色, 且各细胞间的荧光强度基本一致. 为证明细胞培养液本身对HSCs [Ca2+]i的影响, 观察了4个HSCs在实验所需的时间内[Ca2+]i的动态变化, 结果表明, HSCs在实验所需的整个时间内[Ca2+]i荧光强度基本保持稳定.
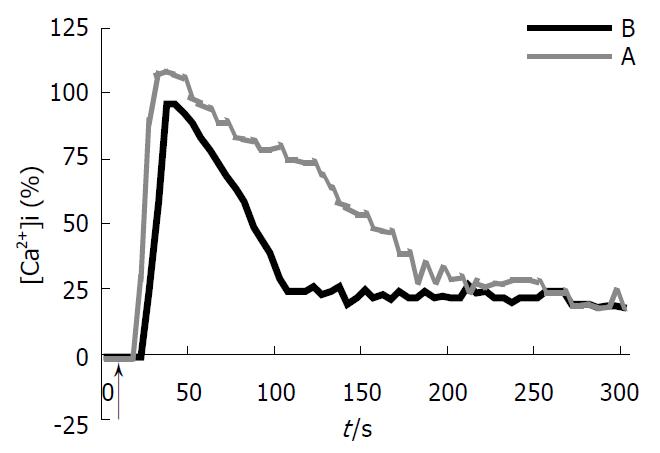
A液中加入浓度梯度的ET-1后, 荧光强度逐渐增加, 作出累积反应曲线后, EC50值约在1.1×10-9 mol/L. ET-1(终浓度1.1×10-9 mol/L)作用于A液, 5 s时[Ca2+]i开始增高, 25 s达到峰值(110.2%±12.0%), 维持至95 s后开始逐渐下降, 170 s后趋于平稳, 但其水平仍稍高于加药前水平, 钙波持续时间为165.2±10.1 s; 而ET-1(终浓度1.1×10-9 mol/L)作用于B液, 15 s时[Ca2+]i开始增高, 25 s时达到峰值(98.3%±13.8%), 然后逐渐下降, 至105 s后稳定在稍高于基线水平, 钙波持续时间为91.0±7.2 s, 两组峰值相比无显著性差异, 钙波持续时间相比有显著性差异(P<0.01, 图1). 表明ET-1引起HSCs峰值的出现系源于细胞内贮存钙的释放, 而外钙内流介导了钙波的增宽.
(1)RSM+ET-1组: 在含钙细胞培养液(A液), RSM预处理后加入ET-1, [Ca2+]i的峰值为115.0%±11.6%, 钙波持续时间为69.1±12.5 s, 同单纯ET-1组相比钙锋值无显著性差异, 而钙波持续时间有显著性差异(P<0.01, 表1). (2)EGTA+RSM+ET-1组: 无钙细胞培养液(B液)中加入RSM预处理后, ET-1引起的[Ca2+]i峰值(104.3%±10.3%), 同RSM组相比无显著性差异, 钙波持续时间为78.5±13.4 s, 同RSM组相比无显著性差异(P>0.05), 表明RSM主要通过细胞内的机制抑制[Ca2+]i升高(表1). (3)RSM+KCl组: RSM预处理后, 加入KCl可降低其诱发的[Ca2+]i的升高, 峰值降至26.3%±1.2%, 钙波宽度降至15.9±5.1 s, 同单纯KCl组比均有显著性差异(P均<0.01), 钙波宽度低于尼索地平+KCl组, 但二者无统计学差异, 表明RSM具有L-型电压依赖性钙通道(voltage-operated calcium channel, VOCC)阻断作用(表1).
RSM是目前临床应用较为广泛的主要活血化瘀药物, 以RSM为主药的系列中药组方抑肝纤、复方861合剂、扶正化瘀方、强肝胶囊以及益肝浓缩煎剂等已证实具有肯定的抗肝纤维化作用[1,3]. 但其在门脉高压治疗中的研究尚少, Yao et al[2]通过临床和动物实验研究表明, RSM可改善肝硬化患者临床症状, 降低门静脉内径、血流量, 同时降低肝硬化犬门静脉压, 而对平均动脉压、心率无影响. 表明RSM既可有效降低肝硬化犬的门静脉压力, 又无全身血液动力学副作用, 为一有希望的降门脉压药物. 多项体内外研究表明, HSCs在肝脏微循环调节以及门脉高压的形成中起重要作用[4-5]. 其中ET-1引起的收缩反应最强, 在肝硬化门脉高压中发挥重要作用[6], 因此, 本研究首先探讨了ET-1引发HSCs [Ca2+]i变化的细胞内机制, 藉此为实验基础, 进一步观察了RSM对ET-1引发的HSCs [Ca2+]i的影响, RSM如能抑制HSCs [Ca2+]i的增加, 则其有可能藉此途径发挥降低肝内血流阻力的作用.
目前有关ET-1引起[Ca2+]i增高的机制多集中在对血管平滑肌细胞、心肌细胞等的研究, 多认为ET-1引起的细胞收缩需要细胞内贮钙释放和外钙内流共同介导[6-11], 而对ET-1介导HSCs [Ca2+]i增高机制的研究很少, 已有的研究认为ET-1引发的HSCs内贮钙释放导致了[Ca2+]i增加, 介导了细胞收缩, 但外钙内流是否参与了ET-1引发的HSCs [Ca2+]i增高目前尚存在分歧[12-14], 有认为ET-1引起的内钙释放和外钙内流共同介导了HSCs [Ca2+]i增加, 而有者则持相反观点, 认为ET-1引发的HSCs [Ca2+]i的变化主要由细胞内贮钙释放所致, 而与外钙内流无关. 因此, 进一步阐明ET-1引起HSCs [Ca2+]i增加的机制将为靶向选择药物抑制ET-1介导的HSCs [Ca2+]i的增加提供依据, 从而可能有助于门脉高压的治疗.
采用钙荧光探针Fluo-3/AM和LSCM成像技术, 观察了ET-1对HSCs [Ca2+]i的影响, Fluo-3/AM是一种敏感性钙荧光指示剂, 能特异性地与Ca2+结合, 并在一定波长激发光激发后产生荧光, 藉荧光强度变化指示[Ca2+]i浓度的相应变化. 为了明确细胞外钙内流是否参与了ET-1引发的HSCs [Ca2+]i增加, 分别在含钙和无钙细胞外液观察由ET-1介导的HSCs [Ca2+]i变化. 结果显示, 在含钙和无钙细胞外液中, ET-1均能引起HSCs钙峰(钙峰系同加药前相比, 细胞[Ca2+]i增加的最高值, 主要代表细胞内贮存钙的释放)的出现, 含钙和无钙细胞外液相比无显著差异, 表明细胞外液钙的有无并不影响ET-1引起的钙峰值的高低; 而无钙组钙波(钙波指加药后从细胞[Ca2+]i增加到逐渐回至基线趋于平稳的时间, 主要由外钙内流介导)持续时间明显短于含钙组(P<0.01), 同时, 无钙组细胞面积减少亦低于含钙组(P<0.05), 表明外钙内流在一定程度上也介导了HSCs面积减少. 已证实HSCs细胞面积减少是细胞产生收缩力的重要标志, 目前多数研究认为, 当HSCs面积减少时代表细胞有收缩, 特别是减少>8%时, 此种收缩作用同钙峰值及钙波持续时间密切相关[15-16]. 尽管ET-1在含钙和无钙细胞外液中均可引起细胞收缩, 但在无钙细胞外液引起的收缩明显小于含钙细胞外液, 表明外钙内流亦介导了ET-1引发的HSCs收缩. 甚至有研究表明, 单纯细胞内贮钙释放引起的钙峰不足以引发细胞收缩, 而细胞内贮钙排空后引发的外钙内流介导了HSCs收缩[13,17]. 基于以上结论, 抑制ET-1引发的HSCs [Ca2+]i升高, 一方面抑制内贮钙的释放, 另一方面抑制外钙内流. 细胞内贮钙的释放系由细胞膜受体介导激活内质网三磷酸肌醇(IP3)受体所致, 但目前尚无IP3受体特异性拮抗剂; 目前认为外钙内流可能由VOCC、受体依赖性钙通道(receptor-operated calcium channel, ROCC)和钙贮库调控的钙通道(stroe-operated calcium channel, SOCC)介导, VOCC系在膜电位发生变化时被激活, 由通道的开放介导细胞外钙内流; ROCC介导外钙内流的机制尚未阐明, 有学者认为受体被激活后促进VOCC开放; SOCC系在细胞钙贮库钙排空后为补充钙贮库中的Ca2+被激活, 他引发细胞外钙内流[9,18-20], 因此, 如采用VOCC, ROCC, SOCC抑制剂可能对抑制外钙内流介导的HSCs收缩有效.
RSM是否通过以上所述途径抑制HSCs收缩, 目前鲜有研究, 从RSM对内皮细胞、血小板、心肌细胞等的研究表明, RSM可抑制细胞内钙增高, 罗伟波 et al[21]用丹酚酸B可抑制低氧引起的人脐静脉内皮细胞钙离子的升高, 王唯 et al[22]研究表明丹酚酸B可抑制凝血酶激发的兔血小板内钙升高, 李全凤 et al[23]发现RSM滴丸可抑制心肌细胞缺血缺氧所致钙超载, 有认为RSM抑制细胞内贮钙升高的机制可能与其具有L-型VOCC阻断作用有关, 徐长庆 et al[24]采用膜片钳全细胞式记录方法, 观察RSM酮Ⅱa对豚鼠单个心室肌细胞跨膜电位及L-型钙电流的影响, 证明RSM酮Ⅱa有类异搏停样L-型VOCC阻断作用, 陈旭华 et al[25]、钱卫民 et al[26]亦观察到同样结果, 我们将HSCs用RSM预处理后可抑制KCl对L-型VOCC激活, 表明RSM具有L-型VOCC阻断作用. 尽管RSM可通过L-型VOCC抑制外钙内流, 但本研究表明在含钙和无钙细胞外液, RSM均可抑制ET-1介导HSCs [Ca2+]i升高, 含钙组同无钙组钙峰值及钙波宽度相比并无显著性差异, 表明RSM对ET-1介导的HSCs [Ca2+]i主要通过抑制细胞内钙增加从而抑制HSCs收缩, 由于细胞内钙增加的机制十分复杂, RSM究竟系通过何种途径发挥作用尚需深入研究.
肝硬化系内科常见疾病, 严重威胁着人类健康. 门脉高压高动力循环是肝硬化腹水形成、上消化道出血、肝肾综合征等严重并发症的病理基础, 其发病机制尚未完全阐明, 目前认为门脉高压的形成系肝内血流阻力以及门脉血流量增加综合作用的结果. 多项研究表明肝星状细胞(HSCs)在肝脏微循环调节以及门脉高压的形成中起重要作用. 目前他已作为预防和治疗慢性肝病的靶细胞. 因此, 能抑制HSCs收缩的药物有可能在门脉高压治疗中发挥重要作用.
近年来, 大多数研究都集中在HSCs激活后细胞外基质合成增加的分子机制, 而对HSCs激活后引起细胞收缩力增加的机制研究尚少. 因此, 从细胞学水平研究门脉高压的机制是当前研究的热点.
本研究采用目前具有最强缩血管作用的内皮素-1(ET-1)作为刺激因子, 观察丹参预处理后对ET-1介导HSCs Ca2+的影响, 探讨丹参降低门脉压力的机制, 此种方法目前国内外尚无报道.
目前对肝硬化门脉高压尚缺有效而乏副作用的预防及治疗药物, 本研究表明丹参在门脉高压的预防和治疗中发挥重要作用, 其应用安全有效而乏副作用, 系一良好的慢性肝病治疗药物.
本文有一定创新性, 立论依据充分, 设计较严谨, 实验技术可行, 讨论部分逻辑性强, 建议后续研究中进一步对不同剂量进行研究.
电编: 张敏 编辑:潘伯荣
| 1. | 王 晓玲, 刘 平, 童 普德, 谭 英姿, 钱 汝江, 胡 旭东, 蒋 文娟. 丹参对转化生长因子b1刺激的NIH/3T3细胞表达Ⅰ型胶原和c-fos mRNA的影响. 中西医结合肝病杂志. 2001;11:19-20. |
| 2. | Yao XX, Cui DL, Sun YF, Li XT. Clinical and experimental study of effect of Raondix Salviae Militiorrhiza and other blood-activating and stasis-eliminating Chinese herbs on hemodynamics of portal hypertension. World J Gastroenterol. 1998;4:439-442. [PubMed] [DOI] |
| 4. | Safadi R, Friedman SL. Hepatic fibrosis-role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] [DOI] |
| 5. | Rockey DC. Hepatic blood flow regulation by stellate cells in normal and injured liver. Semin Liver Dis. 2001;21:337-349. [PubMed] |
| 7. | Curtis TM, Scholfield CN. Transient Ca2+-activated Cl-currents with endothelin in isolated arteriolar smooth muscle cells of the choroid. Invest Ophthalmol Vis Sci. 2000;41:2279-2285. [PubMed] |
| 8. | Wilson SM, Mason HS, Smith GD, Nicholson N, Johnston L, Janiak R, Hume JR. Comparative capacitative calcium entry mechanisms in canine pulmonary and renal arterial smooth muscle cells. J Physiol. 2002;543:917-931. [PubMed] [DOI] |
| 9. | McFadzean I, Gibson A. The developing relation-ship between receptor-operated and store-operated calcium channels in smooth muscle. Br J Pharmacol. 2002;135:1-13. [PubMed] [DOI] |
| 10. | Curtis TM, Scholfield CN. Evidence for two endothelin Et(A) receptor subtypes in rabbit arteriolar smooth muscle. Br J Pharmacol. 2001;134:1787-1795. [PubMed] [DOI] |
| 11. | Curtis TM, Scholfield CN. Nifedipine blocks Ca2+ store refilling through a pathway not involving L-type Ca2+ channels in rabbit arteriolar smooth muscle. J Physiol. 2001;532:609-623. [PubMed] [DOI] |
| 12. | Bataller R, Gines P, Nicolas JM, Gorbig MN, Garcia-Ramallo E, Gasull X, Bosch J, Arroyo V, Rodes J. Angiotensin II induces contraction and proliferation of human hepatic stellate cells. Gastroenterology. 2000;118:1149-1156. [PubMed] [DOI] |
| 13. | Pinzani M, Failli P, Ruocco C, Casini A, Milani S, Baldi E, Giotti A, Gentilini P. Fat-storing cells as liver-specific pericytes. Spatial dynamics of agonist-stimulated intracellular calcium transients. J Clin Invest. 1992;90:642-646. [PubMed] [DOI] |
| 14. | Gasull X, Bataller R, Gines P, Sancho-Bru P, Nicolas JM, Gorbig MN, Ferrer E, Badia E, Gual A, Arroyo V. Human myofibroblastic hepatic stellate cells express Ca(2+)-activated K(+) channels that modulate the effects of endothelin-1 and nitric oxide. J Hepatol. 2001;35:739-748. [PubMed] [DOI] |
| 15. | Bataller R, Gasull X, Gines P, Hellemans K, Gorbig MN, Nicolas JM, Sancho-Bru P, De Las Heras D, Gual A, Geerts A. In vitro and in vivo activation of rat hepatic stellate cells results in de novo expression of L-type voltage-operated calcium channels. Hepatology. 2001;33:956-962. [PubMed] [DOI] |
| 16. | Bataller R, Nicolas JM, Ginees P, Gorbig MN, Garcia-Ramallo E, Lario S, Tobias E, Pinzani M, Thomas AP, Arroyo V. Contraction of human hepatic stellate cells activated in culture: a role for voltage-operated calcium channels. J Hepatol. 1998;29:398-408. [PubMed] [DOI] |
| 17. | Tao J, Mallat A, Gallois C, Belmadani S, Mery PF, Nhieu JT, Pavoine C, Lotersztajn S. Biological effects of C-type natriuretic peptide in human myofibroblastic hepatic stellate cells. J Biol Chem. 1999;274:23761-23769. [PubMed] [DOI] |
| 18. | Hoth M. Depletion of intracellular calcium stores activates an outward potassium current in mast and RBL-1 cells that is correlated with CRAC channel activation. FEBS Lett. 1996;390:285-288. [PubMed] [DOI] |