修回日期: 2006-06-28
接受日期: 2006-07-10
在线出版日期: 2006-08-28
目的: 探讨(EA)足三里穴抗大鼠应激性胃黏膜损伤作用与NTS(NTS)内受体关系.
方法: 健康♂SD大白鼠56只随机分为8组: 应激模型组、EA-应激组、生理盐水(NS)-EA-应激组、哌唑嗪-EA-应激组、育亨宾-EA-应激组、心得安-EA-应激组、阿托品-EA-应激组、纳络酮-EA-应激组. 采用束缚-冷方法制备大鼠应激性胃溃疡模型, 观察NTS内微量注入不同受体阻断剂, 胃溃疡指数(UI)的变化.
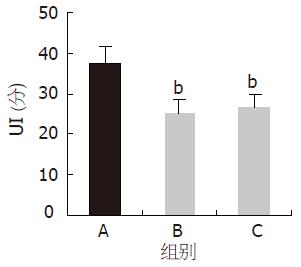
结果: NS-EA-应激组、EA-应激组大鼠胃黏膜损伤明显减轻, UI分别为26.3±3.5, 25.4±3.1, 与应激模型组37.5±4.2比较有显著性差异(t = 5.42, t = 6.13, P<0.01). 哌唑嗪-EA-应激组UI为34.6±3.4明显高于NS-EA-应激组(t = 4.50, P<0.01). 育亨宾-EA-应激组和心得安-EA-应激组分别与NS-EA-应激组比较, UI无显著性差异. 阿托品-EA-应激组大鼠UI为33.1±3.7明显高于NS-EA-应激组(t = 3.53, P<0.01), 纳络酮-EA-应激组与NS-EA-应激组比较, UI无显著性意义.
结论: EA对大鼠应激性胃黏膜损伤的保护作用部分是通过NTS内α1, M受体介导的, 而与α2, β和阿片肽受体无明显关系.
引文著录: 黄碧兰, 王秋桂, 余良主, 唐琼, 丁洁琼. 电针足三里穴抗大鼠应激性胃黏膜损伤作用与NTS内受体的关系. 世界华人消化杂志 2006; 14(24): 2444-2447
Revised: June 28, 2006
Accepted: July 10, 2006
Published online: August 28, 2006
AIM: To investigate the relationship between the effect of electroacupuncturing (EA) Zusanli point on the stress-induced gastric mucosal injury and the receptors in nucleus tractus solitarius (NTS) in rats.
METHODS: Fifty-six male SD rats were randomly divided into 8 groups, and gastric ulcer was induced in all the rats by constraint cold method. Except those in model group, the rats were treated with EA, NS+EA, prazisin+EA, yohimbine+EA, propranolol+EA, atropine+EA, and naloxone+EA, respectively. The ulcer indexes were observed after microinjection of various receptor antagonists into NTS.
RESULTS: In comparison with that in model group, the UI was significantly reduced in NS+EA or EA group (26.3 ± 3.5, 25.4 ± 3.1 vs 37.5 ± 4.2, t = 5.42, t = 6.13, both P < 0.01). In comparison with that NS+EA stree group, the UI was markedly increased in prazisin+EA or tropine+EA group (34.6 ± 3.4, 33.1 ± 3.7 vs 26.3 ± 3.5, t = 4.50, t = 3.53, both P < 0.01), but it was not notably different from that in yohimbine+EA, propranolo+EA and naloxone-EA group.
CONCLUSION: Electroacupuncture plays a protective role in gastric mucosa against stress-induced injury in rats, which is partly mediated by α1 and M type receptors, but not related to α2, β and opioid receptors.
- Citation: Huang BL, Wang QG, Yu LZ, Tang Q, Ding JQ. Effect of electroacupuncturing Zusanli point on stress-induced gastric mucosal injury and and its relationship with receptors in nucleus tractus solitaries. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2444-2447
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2444.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2444
针刺足三里穴对应激性胃黏膜损伤的保护作用, 已被大量的临床和实验研究所证实[1-2], 但其确切机制仍不明确, 尤其是中枢核团对其调控的资料很少. 孤束核(nucleus tractus solitarius, NTS)是脑干内接受内脏初级传入信息的重要核团, 含有多种神经肽类和递质, 并存在多种受体, 通过这些肽类或递质与外周神经和中枢其他部进行信息传递[3]. 有资料报道, NTS参与大鼠胃缺血-再灌注损伤的调控作用[4]. 我们在前期工作也观察到损毁大鼠双侧NTS, 电针(EA)足三里穴对应激性胃黏膜损伤的保护作用减弱, 证明了NTS参与了EA对胃黏膜损伤的保护作用. 但这一作用是否由NTS内的受体介导或由何种受体介导?我们通过核团内微量注射不同受体阻断剂, 以探讨EA足三里穴抗大鼠应激性胃黏膜损伤作用与NTS内受体关系, 从而为EA防治应激性胃黏膜损伤提供理论和实验依据.
健康♂SD大鼠56只, 体质量230±20 g(由本院实验动物中心提供). 动物随机分为8组: 应激模型组、EA-应激组、生理盐水(NS)-EA-应激组、哌唑嗪-EA-应激组、育亨宾-EA-应激组、心得安-EA-应激组、阿托品-EA-应激组、纳络酮-EA-应激组. 哌唑嗪(prazosin)、育亨宾(yohimbine)Sigma公司产品. 心得安(propranolol)江苏丹阳制药厂生产. 阿托品(atropine)徐州第二制药厂生产. 纳络酮(naloxone)北京四环制药厂生产. 脑立体定位仪(DW-5型)成都泰盟科技有限公司.
NTS埋管及微量注射: 大鼠用戊巴比妥钠(30 mg/kg)ip麻醉后, 借助于脑立体定位仪, 参照Paxinos et al[5]脑图谱, 向双侧NTS(坐标AP13 mm, L或R0.6-0.8 mm, H7.7-7.8 mm)埋植直径0.6 mm不锈钢导管. 导管插入术后7 d, 将外径0.3 mm注射管插入该导管内, 恒速注入药液或NS(注药量为阿托品0.5 g/L, 心得安1 g/L, 育亨宾2 g/L, 哌唑嗪1 g/L, 纳络酮2 g/L), 药液注入30 min后进行EA. 实验完毕向两侧NTS注入少量滂胺天蓝, 动物处死后取脑置于40 g/L甲醛溶液, 然后作脑切片以确定注射点部位, 未注中者不纳入统计. EA处理: 大鼠放置特制的鼠笼内, 双后肢充分暴露. 在大鼠双后肢膝关节下方腓骨小头内5 mm处取足三里穴, 用CDM1-2型双频针麻治疗仪剌激, 频率20 Hz, 强度以大鼠下肢轻微抖动为度, 连续EA 30 min后再应激. 束缚-冷应激性胃溃疡模型制备: 大鼠禁食24 h, 禁水2 h, 乙醚轻度麻醉后, 束缚四肢于自制木板上, 待其清醒后放入4 ℃冰箱, 应激3 h取出, 将大鼠处死剖腹, 于胃幽门和贲门两处用线结扎, 并向胃腔内注入40 g/L甲醛溶液8-10 mL, 取出胃置同一浓度的甲醛溶液固定. 沿胃大弯剪开展平, 按Guth et al[6]指数评定法计算胃黏膜溃疡指数(UI): 溃疡面的长度小于1 mm为1分, 1-2 mm为2分, 2-3 mm为3分, 3-4 mm为4分, 大于4 mm将其分割为若干段, 每段按上法计算. 溃疡宽度大于1 mm则分值×2, 累积得分, 即为该大鼠胃黏膜UI.
统计学处理 数据均采用SPSS 11.0软件包进行统计学分析. 实验结果以均数±标准差(mean±SD)表示, 组间比较采用t检验, P<0.05为差异有统计学意义.
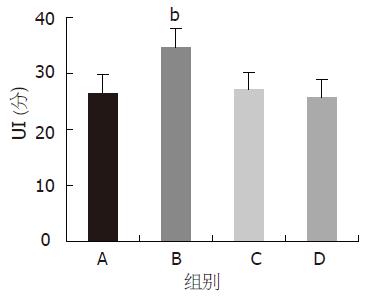
NS-EA-应激组、EA-应激组大鼠胃黏膜损伤明显减轻, UI分别为26.3±3.5, 25.4±3.1, 与应激模型组(UI为37.5±4.2)比较有显著性差异(P<0.01, 图1). 哌唑嗪-EA-应激组UI为34.6±3.4明显高于NS-EA-应激组(P<0.01). 育亨宾-EA-应激组UI 27.1±3.0、心得安-EA-应激组UI 25.7±3.2分别与NS-EA-应激组比较无显著性差异(P>0.05, 图2). 结果表明, 哌唑嗪可削弱EA对胃黏膜损伤的保护作用, 育亨宾、心得安对EA的作用无明显的影响.
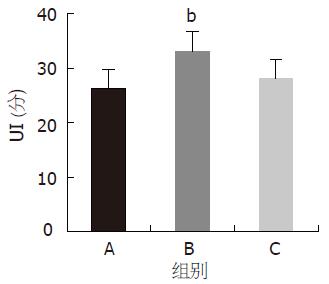
阿托品-EA-应激组大鼠, 胃黏膜损伤加重, UI为33.1±3.7升高, 与NS-EA-应激组比较有显著性意义(P<0.01, 图3), 结果表明, 阿托品可部分阻断EA对胃黏膜损伤的保护作用.
纳络酮-EA-应激组UI为28.1±3.5, 与NS-EA-应激组比较, 无显著性意义(图3). 结果提示, 纳络酮对EA保护胃黏膜损伤作用无明显影响.
EA足三里穴对胃黏膜的保护作用已被大量临床观察和实验研究所证实. 他是一种复杂的多因素综合作用的病理生理过程, 其机制可能通过下丘脑和某些胃肠激素及神经肽的影响来实现的, 如对一氧化氮合酶、生长抑素、表皮生长因子、生长激素、前列腺素E2、降钙素基因相关肽等的影响来调节胃的分泌、血流及黏膜和黏膜屏障的再生和修复[7-8]. 但有关EA对应激性胃黏膜损伤的保护作用中枢机制仍不明确, 尤其是中枢核团及受体对其调控的资料很少. NTS是结构和功能非常复杂的神经核团, 位于延髓背侧, 在吻尾方向上形成y字型的细胞柱, 其吻侧1/3是味觉初级传入的终止部位, 尾侧2/3是接受胸腹腔脏器初级传入的中枢[9]. Kalia et al[10]根据细胞构筑将NTS分为9个亚区, 胃肠道的初级传入纤维通过迷走神经主要终止于NTS的内侧亚核, 其次为背侧亚核连合亚核和胶状质亚核. 胃的牵拉反应及饱胀感觉经迷走传入神经可到达NTS[11-12], 且NTS和迷走神经背核之间存在P物质(SP)、胆囊收缩素(CCK)等肽能神经纤维的投射[13]. 而迷走神经背核是支配胃的迷走神经传出纤维的起始核. 有文献报道[8], 心理性应激条件可以导致延髓的迷走神经背核神经元细胞自发放电频率呈现相对紊乱状态, 给予EA刺激其迷走神经背核自发放电频率较应激组有相对稳定的趋势. 由于NTS与迷走神经背核有密切的联系, NTS是调节胃生理功能的重要中枢结构[14].
有资料表明, 在NTS内有多种肽类或神经递质和受体, 并参与信息传递与中枢其他部位存在复杂的结构和功能联系[15-16]. 由于NTS内的神经递质、受体种类较多, 因而其生理功能呈多样性. 有文献报道, NTS参与室旁核加压素能神经元对大鼠胃缺血-再灌注损伤的调控作用[17]. 水浸束缚应激能导致胃溃疡的产生, 可能与伤害性剌激激活脑干儿茶酚胺能神经元, 后者进一步增强下丘脑室旁核、脑干NTS的活动有关[18]. 我们前期工作也观察到损毁大鼠双侧NTS, 可削弱EA对应激性胃黏膜损伤保护作用, 证明了NTS参与了EA对应激性胃黏膜损伤保护作用. 但这一作用是否由NTS内的受体介导以及由何种受体介导?为此我们通过核团内分别微量注射肾上腺素能α1, α2, β受体阻断剂哌唑嗪、育亨宾、心得安和胆碱能M受体阻断剂阿托品以及阿片受体阻断剂纳络酮. 结果显示, NTS注入哌唑嗪或阿托品, 大鼠UI增大, EA对应激性胃黏膜损伤的保护作用减弱; 而NTS注入育亨宾、心得安、纳络酮对EA的作用无明显的影响. 结果提示, EA对应激性胃黏膜损伤有保护作用, 此作用可能部分是通过NTS内α1和M受体介导的, 而与α2, β和阿片受体无明显关系. 已有文献证实[3], NTS内存在许多肾上腺素能纤维, 其末梢与NTS内的胞体、轴体和树突构成突触, 放射自显影法也证实NTS内存在α和β受体; 另外在NTS内的一些细胞体存在乙酰胆碱, 在NTS尾部和中间部存在胆碱乙酰转移酶和胆碱能受体. 但至于NTS内α1受体或M受体是如何介导EA作用, 其具体机制还有待进一步研究.
NTS是脑干内接受内脏初级传入信息的重要核团, 含有多种神经肽类和递质, 并存在多种受体, 通过这些肽类或递质与外周神经和中枢其他部进行信息传递. 本文课题组在前期工作中已证明了NTS参与了EA对胃黏膜损伤的保护作用.
机体对应激性的反应发动于中枢神经系统, 然后影响到外周神经系统和体液因素. 因而中枢神经系统功能的变化在应激性溃疡的发病过程中无疑是 非常重要的. EA对胃黏膜损伤的保护作用机制涉及到多种复杂因素综合的作用, 目前的研究主要集 中在中枢神经递质、受体、激素在EA抗应激性胃黏膜损伤中的作用以及他们之间相互作用关系.
本文通过NTS注射不同受体阻断剂, 证实了NTS参与EA对应激性胃黏膜损伤保护作用, 此作用部分是通过NTS内α1和M受体介导的, 而与α2, β和阿片受体无明显关系.
本文探讨了EA足三里穴抗大鼠应激性胃黏膜损伤作用与NTS内受体关系, 阐述了针灸对应激性胃黏 膜损伤保护作用的部分中枢机制, 从而为EA防治应激性胃黏膜损伤提供理论和实验 依据.
电编: 李琪 编辑:张焕兰
| 5. | Paxinos G, watson C. The rat brain in stereotaxic coordinates. 2nd Revised. Sydney: Academic Press 1986; F23-F26; F70-F72. |
| 6. | Guth PH, Aures D, Paulsen G. Topical aspirin plus HCl gastric lesions in the rat. Cytoprotective effect of prostaglandin, cimetidine, and probanthine. Gastroenterology. 1979;76:88-93. [PubMed] |
| 10. | Kalia M, Sullivan JM. Brainstem projections of sensory and motor components of the vagus nerve in the rat. J Comp Neurol. 1982;211:248-265. [PubMed] |
| 11. | Carlson SH, Osborn JW. Splanchnic and vagal denervation attenuate central Fos but not AVP responses to intragastric salt in rats. Am J Physiol. 1998;274:R1243-1252. [PubMed] |
| 12. | Carlson SH, Beitz A, Osborn JW. Intragastric hypertonic saline increases vasopressin and central Fos immunoreactivity in conscious rats. Am J Physiol. 1997;272:R750-R758. [PubMed] |
| 13. | Berk ML, Smith SE. Local and commissural neuropeptide-containing projections of the nucleus of the solitary tract to the dorsal vagal complex in the pigeon. J Comp Neurol. 1994;347:369-396. [PubMed] |
| 15. | Ladic LA, Buchan AM. Three-dimensional spatial relationship of neuropeptides and receptors in the rat dorsal vagal complex. Brain Res. 1998;795:312-324. [PubMed] |