修回日期: 2006-07-12
接受日期: 2006-07-19
在线出版日期: 2006-08-28
目的: 探讨淋巴管内皮细胞透明质酸受体-1(LYVE- 1)在胃癌组织中的表达及临床意义.
方法: 采用组织芯片技术和免疫组化方法对85例胃癌组织和40例正常胃组织中LYVE-1的表达及淋巴管密度(LVD)进行检测.
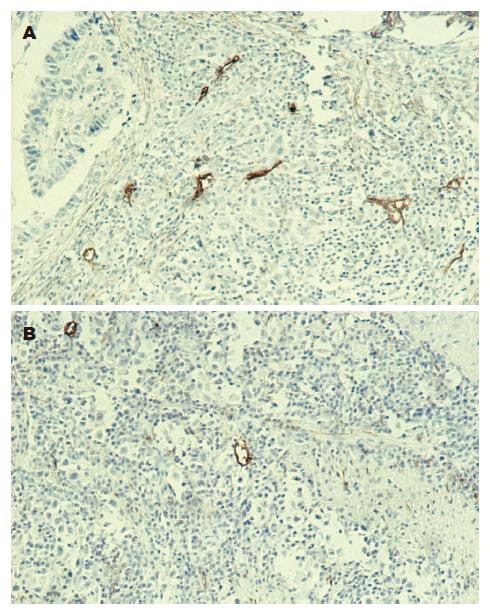
结果: LYVE-1的阳性产物表达于淋巴管内皮细胞胞质中, 呈棕黄色染色. 胃癌组织中LYVE-1阳性LVD显著高于正常胃组织(7.89±2.14 vs 1.15±1.62, P<0.01); 瘤周的LYVE-1阳性LVD明显高于瘤内组织(9.28±1.18 vs 4.75±1.19, P<0.01); 低分化(9.21±2.32)、Ⅲ-Ⅳ期(9.46±2.45)、有淋巴结转移(9.37±3.39)和远处转移(9.55±3.50)的胃癌组织中LYVE-1阳性LVD分别比高中分化(7.56±2.24)、Ⅰ-Ⅱ期(7.58±2.36)、无淋巴结转移(7.23±2.74)和远处转移(7.35±2.25)的明显增高(P<0.01, P<0.05).
结论: 胃癌组织内及瘤周的LYVE-1阳性LVD明显增高, 提示胃癌组织内的新生淋巴管主要位于瘤周, 从而促进了肿瘤淋巴道转移. 应用组织芯片大规模高效检测临床组织标本是可行的, 具有快速、方便、经济、准确的特点.
引文著录: 李蕾, 张翠萍, 赵清喜, 刘晖, 李玉军. 淋巴管内皮细胞透明质酸受体-1在胃癌组织中的表达及意义. 世界华人消化杂志 2006; 14(24): 2421-2424
Revised: July 12, 2006
Accepted: July 19, 2006
Published online: August 28, 2006
AIM: To investigate the expression of lymphatic vessel endothelial hyaluronan receptor-1 (LYVE-1) and its clinical significance in gastric cancer.
METHODS: Tissue microarray technique and immunohistochemistry were used to detect the expression of LYVE-1 and lymphatic vessel density (LVD) in 85 cases of gastric cancer tissues and 40 cases of normal gastric tissues.
RESULTS: LYVE-1 was expressed in the endothelial cytoplasm of lymphatic vessels, showing as brown and yellow staining. The values of LYVE-1-positive LVD in gastric cancer and peritumoral tissues were significantly higher than those in normal gastric and intratumoral tissues (7.89 ± 2.14 vs 1.15 ± 1.62, P < 0.01; 9.28 ± 1.18 vs 4.75 ± 1.19, P < 0.01). In gastric cancer tissue, the value of LYVE-1-positive LVD was markedly higher in the cases with low differentiation (9.21 ± 2.32), clinical stage Ⅲ-Ⅳ (9.46 ± 2.45), lymph node metastasis (9.37 ± 3.39) or distant metastasis (9.55 ± 3.50) than that in the ones with well and moderate differentiation (7.56 ± 2.24), clinical stage Ⅰ-Ⅱ (7.58 ± 2.36), and without lymph node metastasis (7.23 ± 2.74) or distant metastasis (7.35 ± 2.25), respectively (P < 0.01 or P < 0.05).
CONCLUSION: The high value of LYVE-1-positive LVD in gastric cancer and peritumoral tussues indicates that lymphatic angiogenesis mainly locates in peritumoral tussues, which promotes lymphatic metastasis. Tissue microarray is a feasible, rapid, economic and accurate approach for screening clinical tissue specimens in a large scale.
- Citation: Li L, Zhang CP, Zhao QX, Liu H, Li YJ. Expression of lymphatic vessel endothelial hyaluronic acid receptor-1 and its significance in gastric cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2421-2424
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2421.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2421
胃癌是消化道最常见的恶性肿瘤, 淋巴转移是胃癌最常见的转移途径, 也是影响胃癌术后复发及5年生存率的主要原因之一. 但是长期以来由于缺乏淋巴管内皮细胞特异性标志物, 因而对肿瘤淋巴管生成的研究一直滞后于肿瘤血管生成的研究. 而最近发现的淋巴管内皮细胞透明质酸受体-1(LYVE-1)被认为是目前特异性最强的淋巴管内皮细胞标志物之一. 本研究应用组织芯片技术和免疫组化方法检测LYVE-1在胃癌组织中的表达, 计数淋巴管密度(LVD), 以分析胃癌组织中的淋巴管生成情况, 并进一步探讨淋巴管生成与肿瘤转移的关系.
收集青岛大学医学院附属医院2004-12/2005-10手术切除并经病理证实为胃腺癌的石蜡包埋标本85例. 所有患者术前均未接受放疗和化疗. 其中高、中分化腺癌29例, 低分化腺癌56例; 有淋巴结转移者53例, 无淋巴结转移者32例; 有远处转移者8例, 无远处转移者77例; TNM分期:Ⅰ-Ⅱ期27例, Ⅲ-Ⅳ期58例. 另取40例正常胃组织的石蜡包埋标本(经病理证实基本正常或慢性浅表性胃炎标本)作为对照.
取85例胃腺癌及40例正常胃组织的石蜡包埋标本切片, HE染色, 阅片, 标记HE染色切片上的典型病变区域; 根据需要将组织按不同的种类或顺序设计组织样品的排列方式; 用组织芯片仪(tissue arrayer)在无组织的空白芯片蜡块上钻孔(直径2 mm); 借助玻片上的标记找准标本蜡块上的相应部位, 钻孔采集组织芯; 将组织芯转移到空白芯片蜡块的孔中. 如此反复将数十个组织芯整齐有序地安插在空白芯片蜡块中, 制成组织芯片蜡块. 将组织芯片蜡块3-4 mm连续切片, 胶片捞片, 常规HE染色复核诊断. 用PV-9000二步法免疫组化染色, 兔抗人LYVE-1多克隆抗体工作浓度为1:200. 操作步骤按照试剂盒说明书进行, 以PBS溶液代替一抗作为阴性对照, 用已知LYVE-1阳性肺鳞癌组织切片作为阳性对照. LYVE-1免疫组化染色阳性物质主要定位于细胞质, 呈棕黄色细颗粒状. 将LYVE-1染色棕黄色的内皮细胞簇或内皮细胞形成的条状、隙状结构及有管腔者作为一个淋巴管计数. 每例组织首先在低倍镜下随机选择3个淋巴管着色最密集的区域, 然后在200倍光镜下分别计数淋巴管数, 取3个视野的均值作为LVD.
统计学处理 采用SPSS 11.0统计学软件进行方差分析和t检验.
LYVE-1的阳性产物表达于淋巴管内皮细胞胞质中, 呈棕黄色染色. 胃癌组织中LYVE-1阳性的管腔为新生的淋巴管, 主要位于瘤周间质内, 在扩张的LYVE-1阳性的淋巴管腔中可发现肿瘤栓子. 胃癌组织中LYVE-1阳性LVD高于正常胃组织(P<0.01, 表1); 瘤周的LYVE-1阳性LVD高于瘤内(P<0.01, 表1, 图1).
低分化胃腺癌中的LVD显著高于高、中分化胃腺癌(P<0.01); TNM分期: Ⅲ-Ⅳ期的LVD显著高于Ⅰ-Ⅱ期(P<0.05); 有淋巴结转移的LVD显著高于无淋巴结转移的(P<0.01); 有远处转移的LVD显著高于无远处转移的(P<0.05, 表2).
临床和病理研究已经证实淋巴道转移是大多数实体肿瘤播散的早期事件, 是肿瘤细胞播散的重要途径之一[1-2]. 近年来, 随着淋巴管生成特异性调控因子以及淋巴管内皮细胞特异性标志物的相继发现, 已有大量的实验研究表明, 淋巴管生成在肿瘤转移过程中起着不容忽视的作用[3-4]. 目前多数学者倾向于肿瘤淋巴管生成发生在肿瘤周边而不是肿瘤内, 肿瘤细胞淋巴道转移主要是通过诱导肿瘤周边新生淋巴管生成而完成的. 检测肿瘤组织中的淋巴管密度, 可作为评价肿瘤淋巴管生成及判断肿瘤转移与预后的一个指标[5-6].
LYVE-1被认为是特异性最强的淋巴管内皮细胞标志物之一, 本实验采用免疫组化方法对胃癌中LYVE-1表达及淋巴管生成情况的研究发现, LYVE-1表达在淋巴管内皮细胞胞质中, 呈棕黄色细颗粒状. 胃癌组织中LYVE-1阳性LVD明显高于正常胃组织, 瘤周的LYVE-1阳性LVD明显高于瘤内的, 低分化、Ⅲ-Ⅳ期、有淋巴结转移和远处转移的胃癌组织中LYVE-1阳性LVD明显高于高中分化、Ⅰ-Ⅱ期、无淋巴结转移和远处转移的, 差异均有统计学意义; 表明胃癌组织内有新生淋巴管生成, 且淋巴管生成主要位于瘤周, 从而增加了肿瘤发生淋巴道转移的机会. 目前肿瘤抗淋巴管生成治疗尚处于实验阶段, 我们可以进一步在动物模型中进行胃癌抗淋巴管生成研究, 从而探索抗淋巴管生成技术在降低淋巴管生成进而抑制肿瘤淋巴道转移方面的作用.
组织芯片又称组织微阵列(tissue microarray, TMA), 是1998年由Kononen et al[7]在cDNA微阵列的基础上发明的一种特殊的生物芯片. 其原理是根据不同需要, 将成百上千个小块组织样本高密度地固定排列在一个阵列蜡块上, 然后切片进行免疫组化、原位杂交或其他分子病理检测, 以研究目的基因或其表达产物在不同组织、不同肿瘤以及肿瘤不同发展阶段之间的表达差异情况.组织芯片具有体积小、信息含量高、并可根据不同需要进行组合和设计的特点, 一次性实验即可获得大量结果[8]. 该技术对于原始病理资料的保存和大量样本的回顾性研究具有重要的意义[9]. 目前, 有不少研究者已经通过实验证实应用组织芯片进行原位杂交和免疫组化检测所得结果与常规切片技术所得结果具有很高的一致性[9-12]. 组织芯片还可与基因芯片组成联合检测系统, 快速、高效地分析鉴定基因芯片筛选出的众多侯选标志基因及其表达产物[13]. 一个组织芯片蜡块除了可做100张以上连续切片, 还可用同一套组织芯片迅速地对上百种生物分子标记进行分析、检测, 因而倍受组织病理学家的重视. 我们制作了85例胃癌和40例正常胃组织的组织芯片, 每张组织芯片上40-50个样品, 排列整齐, 外形为圆形或类圆形, 没有脱片现象. 仅用几张芯片就完成了全部实验, 极大节约了研究经费, 降低了劳动量. 因此, 应用组织芯片大规模高效检测临床组织样本是可行的, 具有快速、方便、经济、准确的特点.
近年来, 随着淋巴管生成特异性调控因子以及淋巴管内皮细胞特异性标志物的相继发现, 已有大量的实验研究表明, 淋巴管生成在肿瘤转移过程中起着不容忽视的作用. 目前多数学者倾向于肿瘤淋巴管生成发生在肿瘤周边而不是肿瘤内, 肿瘤细胞淋巴道转移主要是通过诱导肿瘤周边新生淋巴管生成而完成的.
淋巴管生成在肿瘤的淋巴转移过程中可能起着不容忽视的作用. 进一步研究肿瘤淋巴管生成、抗淋巴管生成与肿瘤转移的关系, 可能成为下一步研究的前沿和热点.
Bono et al在对侵润性导管乳腺癌的研究中表明肿瘤内部缺少淋巴管生成, 而肿瘤周边淋巴管是增殖的, 且肿瘤周边淋巴管密度与乳腺癌的淋巴结转移及不良预后有关.
本文观察LYVE-1在胃癌组织中的表达, 计数淋巴管密度, 以分析胃癌组织中的淋巴管生成情况, 并进一步探讨淋巴管生成与肿瘤转移的关系, 为胃癌的治疗提供依据.
淋巴管内皮特异性标志物: 是指可以确认淋巴管内皮的特异分子, 是区分淋巴管内皮与血管内皮的重要标志;
组织芯片又称组织微阵列(TMA): 是将数十个、数百个乃至上千个小块组织样本高密度地固定排列在一个阵列蜡块上, 然后切片进行免疫组化、原位杂交或其它分子病理检测, 以研究目的基因或其表达产物在不同组织、不同肿瘤以及肿瘤不同发展阶段之间的差异表达情况.
本文研究LYVE-1在胃癌组织中的表达, 并对LYVE-1阳性表达淋巴管密度进行检测, 发现其与胃癌分化程度、分期及转移显著相关, 具有较高的科学价值, 研究采用组织芯片这一较新的技术, 结果可靠, 文字叙述简明清晰.
电编: 李琪 编辑:张焕兰
| 1. | Stacker SA, Achen MG, Jussila L, Baldwin ME, Alitalo K. Lymphangiogenesis and cancer metastasis. Nat Rev Cancer. 2002;2:573-583. [PubMed] |
| 2. | He Y, Karpanen T, Alitalo K. Role of lymphangiogenic factors in tumor metastasis. Biochim Biophys Acta. 2004;1654:3-12. [PubMed] |
| 3. | Williams CS, Leek RD, Robson AM, Banerji S, Prevo R, Harris AL, Jackson DG. Absence of lymphangiogenesis and intratumoural lymph vessels in human metastatic breast cancer. J Pathol. 2003;200:195-206. [PubMed] |
| 4. | Karpanen T, Egeblad M, Karkkainen MJ, Kubo H, Yla-Herttuala S, Jaattela M, Alitalo K. Vascular endothelial growth factor C promotes tumor lymphangiogenesis and intralymphatic tumor growth. Cancer Res. 2001;61:1786-1790. [PubMed] |
| 5. | Nathanson SD, Zarbo RJ, Wachna DL, Spence CA, Andrzejewski TA, Abrams J. Microvessels that predict axillary lymph node metastases in patients with breast cancer. Arch Surg. 2000;135:586-593; discussion 593-594. [PubMed] |
| 6. | Maeda K, Chung YS, Ogawa Y, Takatsuka S, Kang SM, Ogawa M, Sawada T, Sowa M. Prognostic value of vascular endothelial growth factor expression in gastric carcinoma. Cancer. 1996;77:858-863. [PubMed] |
| 7. | Kononen J, Bubendorf L, Kallioniemi A, Barlund M, Schraml P, Leighton S, Torhorst J, Mihatsch MJ, Sauter G, Kallioniemi OP. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med. 1998;4:844-847. [PubMed] |
| 9. | Pacifico MD, Grover R, Richman P, Daley F, Wilson GD. Validation of tissue microarray for the immunohistochemical profiling of melanoma. Melanoma Res. 2004;14:39-42. [PubMed] |
| 10. | Hendriks Y, Franken P, Dierssen JW, De Leeuw W, Wijnen J, Dreef E, Tops C, Breuning M, Brocker-Vriends A, Vasen H. Conventional and tissue microarray immunohistochemical expression analysis of mismatch repair in hereditary colorectal tumors. Am J Pathol. 2003;162:469-477. [PubMed] |
| 11. | Fernebro E, Dictor M, Bendahl PO, Ferno M, Nilbert M. Evaluation of the tissue microarray technique for immunohistochemical analysis in rectal cancer. Arch Pathol Lab Med. 2002;126:702-705. [PubMed] |
| 12. | Gancberg D, Di Leo A, Rouas G, Jarvinen T, Verhest A, Isola J, Piccart MJ, Larsimont D. Reliability of the tissue microarray based FISH for evaluation of the HER-2 oncogene in breast carcinoma. J Clin Pathol. 2002;55:315-317. [PubMed] |
| 13. | Hao X, Sun B, Hu L, Lahdesmaki H, Dunmire V, Feng Y, Zhang SW, Wang H, Wu C, Wang H. Differential gene and protein expression in primary breast malignancies and their lymph node metastases as revealed by combined cDNA microarray and tissue microarray analysis. Cancer. 2004;100:1110-1122. [PubMed] |