修回日期: 2006-07-03
接受日期: 2006-07-10
在线出版日期: 2006-08-28
目的: 探讨P53, P63和P73蛋白表达与胃腺癌临床病理特征之间的关系.
方法: 用免疫组织化学技术, 检测72例胃腺癌及其癌旁正常组织中P53, P63和P73蛋白表达情况. 所有研究对象均为湖北地区汉族人. 其中, 癌肿位于胃远端(胃窦、胃角)51例, 胃近端(胃底、胃体)21例; 肠型GAC 44例、弥漫型28例; 高分化腺癌20例、中分化腺癌29例、低分化和未分化腺癌23例; TNM分期: Ⅰ和Ⅱ期13例, Ⅲ和Ⅳ期59例.
结果: 胃腺癌组织中P53, P63和P73蛋白阳性表达率均明显高于正常组织(χ2 = 4.72, P<0.05; χ2 = 5.51, P<0.05; χ2 = 9.75, P<0.01); 胃窦/胃角腺癌与胃底/胃体腺癌组织P53蛋白表达率无显著差异(P>0.05); 在弥漫型胃腺癌中的表达率明显高于肠型胃腺癌(χ2 = 4.68, P<0.05); 在低分化腺癌与高中分化腺癌之间以及Ⅲ, Ⅳ期腺癌与Ⅰ, Ⅱ期胃腺癌之间的表达率的差异均有显著性(χ2 = 7.06, P<0.05; χ2= 3.95, P<0.05). P63蛋白在低分化腺癌组织中表达率明显高于高中分化腺癌(χ2 = 7.36, P<0.05); 在胃窦/胃角腺癌与胃底/胃体腺癌之间、在弥漫型与肠型胃腺癌之间、在Ⅰ,Ⅱ期胃腺癌与Ⅲ, Ⅳ期腺癌之间均无显著差异. P73蛋白在Ⅰ,Ⅱ期胃腺癌组织中的阳性表达率明显低于Ⅲ, Ⅳ期腺癌(χ2 = 4.14, P<0.05), 在胃窦/胃角腺癌与胃底/胃体腺癌之间、在弥漫型与肠型胃腺癌之间、在高、中及低分化胃腺癌之间均无显著差异. 在P53蛋白阳性与阴性表达的胃腺癌之间, P63和P73蛋白阳性表达率的差异无显著性.
结论: P53, P63和P73过度表达与胃腺癌的发生相关联, 但并无交互作用.
引文著录: 刘荣, 贺降福, 朱尤庆, 吕永红, 肖绍树. 胃腺癌组织P53, P63和P73蛋白表达的意义. 世界华人消化杂志 2006; 14(24): 2416-2420
Revised: July 3, 2006
Accepted: July 10, 2006
Published online: August 28, 2006
AIM: To explore the relationships between the expressions of P53, P63 and P73 protein and the carcinogenesis of gastric adenocarcinoma (GAC).
METHODS: Immunohistochemistry method was used to detect the expressions of P53, P63 and P73 proteins in tissues from 72 GACs and adjacent normal tissues.
RESULTS: The positive rates of P53, P63 and P73 expression in GAC were significantly higher than those in the normal tissues (χ2 = 4.72, P < 0.05; χ2 = 5.51, P < 0.05; χ2 = 9.75, P < 0.01). The expression of P53 protein was distinctly higher in GAC of diffuse type than that in GAC of intestinal type (χ2 = 4.68, P < 0.05), and marked differences were observed between lowly-differentiated GAC and highly-, moderately-differentiated GAC (χ2 = 7.06, P < 0.05) as well as between GAC of stage Ⅰ, Ⅱand stage Ⅲ, Ⅳ (χ2 = 3.95, P < 0.05). There was significant difference for P63 expression between lowly-differentiated GAC and highly-, moderately-differentiated GAC (χ2 = 7.36, P < 0.05). The expression of P73 was significantly lower in patients of stage Ⅰand Ⅱthan that of stage Ⅲ and Ⅳ (χ2 = 4.14, P < 0.05). P73 expression was not correlated with the differentiation, tumor location and Lauren types. P63 and P73 expression were not markedly different between P53-positive and negative patients.
CONCLUSION: The expression of P53, P63 and P73 are associated with the carcinogenesis of GAC, but no correlations exist among them.
- Citation: Liu R, He JF, Zhu YQ, Lv YH, Xiao SS. Expression of P53, P63 and P73 protein and their significances in gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2416-2420
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2416.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2416
应用免疫组织化学技术, 检测胃腺癌及其癌旁正常组织中的P53, P63和P73蛋白表达情况, 探讨P53, P63和P73蛋白表达与胃腺癌临床病理特征之间的关系.
黄石市第五人民医院病理科1997年至今存档且经病理证实湖北地区汉族人胃腺癌(GAC)及距癌旁5 cm外正常黏膜组织各72例, 其中, 新鲜肿瘤组织及其癌旁正常组织共6例, 一式2份, 一份常规石蜡包埋, 另一份放-80 ℃保存. 并收集患者年龄、性别、肿瘤发生部位、临床分期、分化程度等临床资料. 其中男39例, 女33例, 年龄30-68(平均56±12)岁, >60岁29例, <60岁43例; 癌肿位于胃远端(胃窦、胃角)51例, 胃近端(胃底、胃体)21例; 肠型 44例, 弥漫型28例; 高分化20例, 中分化29例, 低分化和未分化23例; TNMⅠ, Ⅱ期13例, Ⅲ, Ⅳ期59例. 手术前无放、化疗或免疫治疗, 术前3 mo无抗生素及非甾体抗炎药服用史; 无食管或肠道其他恶性病变者; 无胃手术史及胃癌家族史者. 小鼠抗人P53, P63, P73 mAb, SP试剂盒(Ultra SensitiveTM S-P Kit), 3-3-二氨基联苯胺(DAB)显色剂, 均购自福州迈新生物技术公司.
采用免疫组织化学SP法进行染色, 操作过程参照试剂盒说明书. PBS缓冲液代替一抗作为阴性对照. DAB显色, 苏木素复染, 中性树胶封固. 染色结果由病理医师(未提供临床资料)单独读片. 每张切片随机观察5个高倍视野, 计算阳性细胞数占总细胞数的比例. 肿瘤P53蛋白表达的评价参考文献[1], 阳性细胞少于5%为阴性, 大于5%为阳性. 参照国外学者P63, P73阳性病例评判标准, 切片阳性细胞率≥20%者为阳性病例, <20%者为阴性病例. 以试剂盒中阳性切片作为染色的阳性对照. 图象分析采用全自动图象分析仪: 显微摄像系统(Olympus BX50); 数码像机(Dalariod DMC1); 联想2000型计算机; HPIAS2000图像分析软件(同济大学千屏影像工程公司).
统计学处理 计数资料采用χ2检验或确切概率法, 多个样本均数的比较采用单因素方差分析(F-q检验). P<0.05为有统计学差异.
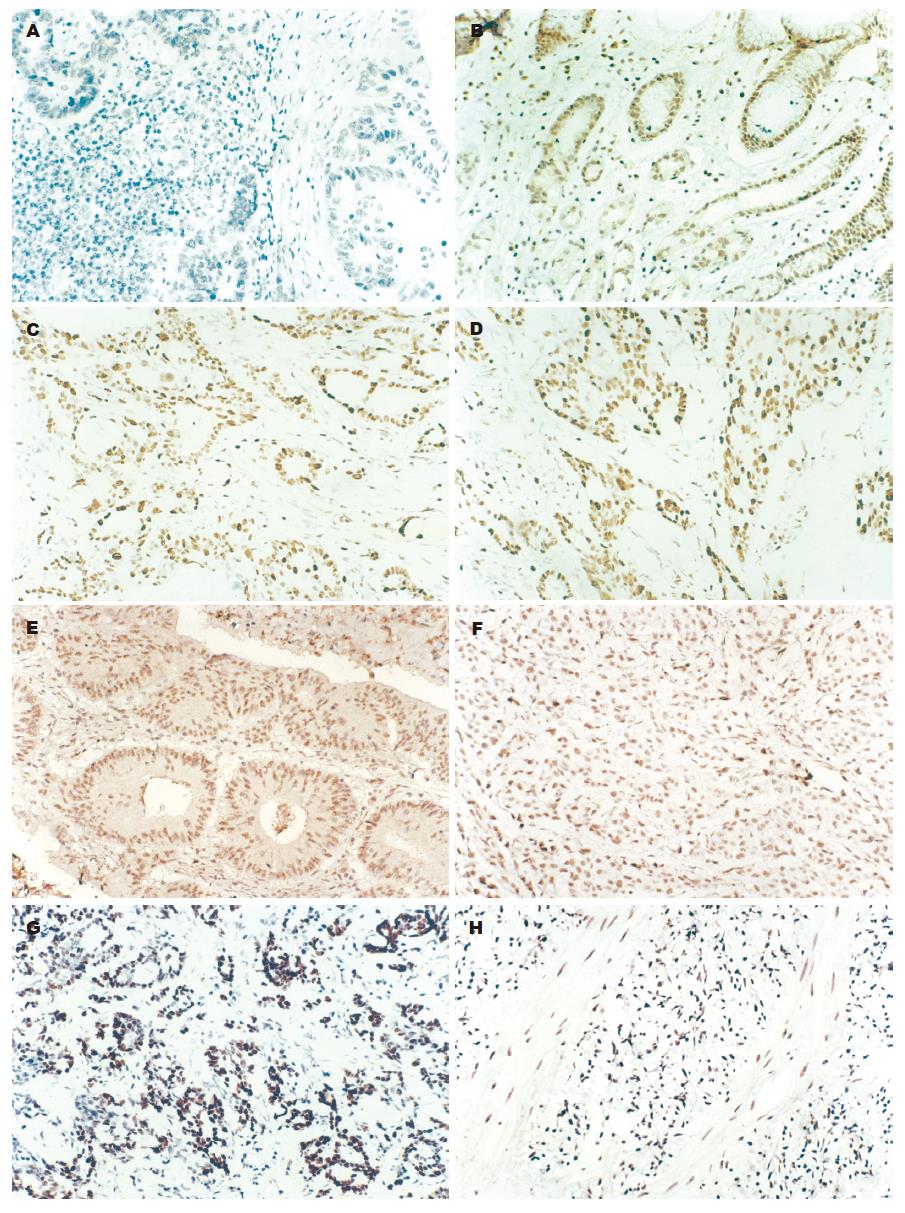
阳性染色均为细胞核含黄色均匀颗粒. 细胞核含深黄色者为P53阳性细胞, 暗黄色者为P63阳性细胞, 黄褐色者为P73阳性细胞(图1, 表1).
| 研究对象 | n | P53 | P63 | P73 |
| 肿瘤组织 | 72 | 40(55.6)a | 47(65.3)a | 35(48.6)b |
| 胃窦/胃角 | 51 | 30(58.8) | 36(70.6) | 27(52.9) |
| 胃底/胃体 | 21 | 10(47.6) | 11(52.4) | 8(38.1) |
| 肠型 | 44 | 20(45.5) | 31(70.5) | 25(56.8) |
| 弥漫型 | 28 | 20(71.4)a | 16(57.1) | 10(35.7) |
| 高分化 | 20 | 9(45.0) | 12(60.0) | 8(40.0) |
| 中分化 | 29 | 13(44.8) | 15(51.7) | 13(44.8) |
| 低分化 | 23 | 18(78.3)b | 20(87.0)b | 14(60.9) |
| Ⅰ, Ⅱ期 | 13 | 4(30.8) | 6(46.2) | 3(23.1) |
| Ⅲ, Ⅳ期 | 59 | 36(61.0)a | 41(69.5) | 32(54.2)a |
| >60岁 | 29 | 19(65.5) | 21(72.4) | 18(62.1) |
| <60岁 | 43 | 21(48.8) | 26(60.5) | 17(39.5) |
| 正常组织 | 72 | 27(37.5) | 33(45.8) | 17(23.6) |
p53是最重要的抑癌基因之一, 人类50%以上的肿瘤组织存在P53蛋白的异常表达. P53蛋白的生物学功能可概括为肿瘤抑制(包括对细胞周期G1/S和G2/M转变的抑制)和诱导凋亡, 他在多种肿瘤的发生和组织损伤中发挥重要作用. 其转录翻译出的蛋白分子P53通过与凋亡相关靶基因p21, MDM2, Bax, PERP作用而使有潜在癌变倾向的细胞凋亡, 一些DNA损伤诱发的细胞凋亡过程也依赖于p53分子的启动. p63和p73基因均为新近发现的p53基因家族成员, 其蛋白分子P63和P73与P53有结构上的相似性, 且功能亦与细胞凋亡相关, 但P63和P73在细胞周期和肿瘤发生中的作用, 与p53基因(或蛋白)和其他相关分子的相互作用、及其诱导细胞凋亡的详细机制尚且不清. 目前, 同时检测P53, P63, P73在胃腺癌中表达情况的国内外相关文献报道较少. Tannapfel et al[2]检测32例胃腺癌患者68块肿瘤标本中P53, P63和P73蛋白的表达情况, 18例患者中34%(23/68)肿瘤组织存在p53基因突变, 24例患者中48.5%(33/68)肿瘤组织P73阳性表达, 21例患者中36.8%(25/68)肿瘤组织P63阳性表达. P63蛋白阳性表达与胃腺癌分化程度有关, 肠上皮化生和慢性萎缩性胃炎组织中, P63蛋白表达也明显升高. P53, P63和P73均与胃腺癌患者的预后无关. 且p73和p63基因在胃腺癌组织极少突变, P63在中度分化胃癌中表达增加, 认为P53, P63和P73与胃癌发生有关. Victorzon et al[3]报道242例胃癌患者癌肿组织中, P53蛋白强阳性表达率为39%, P53蛋白表达与胃癌的临床分期(P<0.01)、远位器官的转移(P = 0.04)、肠型胃癌(P = 0.04)明显相关, 与患者的发病年龄、淋巴结转移无明显相关, P53高表达组的患者, 其平均生存时间为19 mo, 明显低于P53低表达组(65 mo), P53蛋白高表达与胃癌患者的预后负相关(P = 0.0005). Sud et al[4]研究26例胃癌组织中p53基因突变和杂合性缺失情况, 发现31%(8/26)组织存在p53基因突变, p53基因突变的8例肿瘤组织中, 7例肿瘤组织p53野生型基因表达缺失, 92.3%的肿瘤组织中至少存在一处突变(P53基因第5-8外显子中), p53基因杂合性缺失率为37.5%, 认为p53基因变异在胃癌的发生中起着重要作用. Hsieh et al[5]报道80例原发性胃癌组织中, 22.5%肿瘤组织(18例)存在p53基因突变(第5-8外显子), 以乳头状腺癌多见(58.3%), 肠型腺癌(37.5%)中p53基因的突变率显著高于弥漫型胃腺癌(12.5%), 认为p53基因遗传性改变可能与肠型胃癌有关. Kataoka et al[6]用免疫组化技术检测胃腺癌组织中P53蛋白的表达情况, 胃腺癌组织中P53阳性表达率为50%(21/42), P53蛋白阳性表达与肿瘤浸润的深度显著相关. 6例无淋巴结转移的早期胃癌中, P53蛋白表达均为阴性, 认为P53蛋白表达与进展期胃腺癌有关. 我们的研究表明, P53蛋白在胃腺癌组织中阳性表达率均明显高于正常组织, 其表达率的差异有显著性(P<0.05), P53蛋白在胃窦/胃角腺癌与胃底/胃体腺癌组织中表达率的差异无显著性(P>0.05); 在弥漫型胃腺癌中的表达率(71.4%)明显高于肠型胃腺癌(45.5%), 其表达率的差异有显著性(P<0.05); 在低分化腺癌与高、中分化腺癌之间以及Ⅲ, Ⅳ期腺癌与Ⅰ,Ⅱ期胃腺癌之间的表达率的差异均有显著性(P<0.05); 在>60, <60岁胃腺癌患者中表达率的差异无显著性(P>0.05), 我们认为, P53蛋白过度表达与胃腺癌的发生相关联, 肿瘤多为低分化腺癌, 以弥漫型胃腺癌和Ⅲ或Ⅳ期腺癌多见, 与胃腺癌的发生部位、患者的发病年龄无关. 此结论与上述观点相似.
P63, P73与P53结构上的相似性并不决定功能上的一致性, 与P53不同, 经PCR-SSCP检测的细胞株和人类肿瘤(如肺癌、前列腺癌、大肠癌和膀胱癌等)极少有p73基因的突变[7-10], p63在前列腺癌[11]、卵巢癌[12]、肝癌[13]等肿瘤中也未发现有突变. 在p73和p63基因敲除小鼠实验中发现, p73基因缺失的小鼠并不易患肿瘤, 却有脑和免疫系统的发育异常[14]; p63基因缺失的小鼠有上皮组织和肢体发育严重缺陷[15], 在细胞内DNA受损时, P53可被诱导表达, 放线菌素D和紫外线辐射处理细胞引起的DNA损伤, 均不能诱导P73的表达, 这表明p73, p63可能并不像p53基因那样作为细胞的"安全卫士"[16]. 一些能与P53相互作用导致P53蛋白失活的病毒癌蛋白, 包括腺病毒的E1B55K、SV40的大T抗原、人乳头状瘤病毒的E6对P73的稳定性或转录活性并无影响[17], P63亦被证实不能和SV40的大T抗原、人乳头状瘤病毒的E6结合而影响转录[18], 因此, P73, P63并不是病毒诱导细胞转化所必须的作用靶. 由此可见, 作为p53基因家族的每一个成员, 他们的结构、功能既有一些重叠性, 又存在较大的差异性. Ishida et al[19]在一系列比较实验中认为, p63与p53基因在功能上有相近之处. 另有学者用半定量RT-PCR对32例胃癌与正常胃组织的P73及P63的转录水平分析表明, 与相应正常胃组织P73阳性表达率相比, 胃癌组织中P73过表达明显, 两者之间有显著性差异(P<0.01), TNM Ⅲ, Ⅳ期胃癌组织的P73阳性表达率明显高于TNMⅠ, Ⅱ期(P<0.05). 由此可见, P73过表达与胃癌的进程密切相关. P63在胃癌组织中的表达量亦明显高于正常胃组织(P<0.05). 有研究表明, P73 mRNA, P63 mRNA水平在胃癌组织中呈现明显的增高态势, 且在胃癌中存在P53的高突变率, 提示细胞癌变后, P73和P63有可能取代P53发挥对肿瘤细胞的生长调节作用. 认为, P73和P63以高表达方式参与胃癌发生发展, 与胃癌的进程密切相关.
我们的研究结果表明, P63和P73蛋白在胃腺癌组织中阳性表达率均明显高于正常组织, 其表达率的差异均有统计学意义(P63: P<0.05; P73: P<0.01); P63蛋白低分化腺癌组织中表达率明显高于高、中分化腺癌, 其差异有统计学意义(P<0.05); P63蛋白的表达率在胃窦/胃角腺癌与胃底/胃体腺癌之间、在弥漫型与肠型胃腺癌之间、在Ⅰ,Ⅱ期胃腺癌与Ⅲ, Ⅳ期腺癌之间、在老年与非老年胃腺癌之间的差异均无统计学意义; P73蛋白在Ⅰ,Ⅱ期胃腺癌组织中的阳性表达率明显低于Ⅲ, Ⅳ期腺癌, 其阳性表达率的差异有统计学意义(P<0.05), P73蛋白的表达率在胃窦/胃角腺癌与胃底/胃体腺癌之间、在弥漫型与肠型胃腺癌之间、在高、中及低分化胃腺癌之间、在老年与非老年胃腺癌之间的差异均无显著性. 认为, P63蛋白过度表达与胃腺癌的发生相关联, 肿瘤多为低分化腺癌, 与肿瘤的组织类型、发生部位、临床分期及发病年龄均无关联; P73蛋白过度表达与胃腺癌的发生相关联, 多见于Ⅲ或Ⅳ期腺癌, 与胃腺癌其他临床特征无明显的相关性. 此外, 我们还做了p53, p63和p73基因的相关性研究. 结果发现, 在P53蛋白阳性与阴性表达的胃腺癌之间, P63蛋白阳性表达率的差异无显著性, P73蛋白阳性表达率的差异也无显著性. 我们认为, P53, P63和P73在胃腺癌发生发展过程中并无交互作用, 此与国外学者的研究结果有相似之处. 总之, P53, P73和P63以高表达方式参与胃癌发生发展, 与胃癌的进程密切相关. 至于p53基因家族各成员在胃癌发生发展中的具体作用, 仍有待于进一步研究.
p53是研究较为广泛的抑癌基因, 随着p53的广泛和深入研究, 其家族成员p63与p73陆续被发现后, 即成为人们关注的热点.
尽管作为p53家族的新成员, p63与p73的产物与P53蛋白有许多相似之处, 但p63与p73在肿瘤的发生发展过程中似乎更多的起癌基因的作用. 可能原因是P63与P73存在功能截然不同的异构体, 但目前有关P63与P73异构体的研究还不多.
已经有人对P63, P73与P53的结构相似而功能差异进行了较为深入的研究, 认为P63, P73在肿瘤中很少发生突变, 而且与正常组织相比表达增加; DNA的损伤也不诱导P63, P73的表达增加.表明他们在肿瘤中发挥的作用与P53存在明显的差异.
研究内容有特色, 指标较先进, 结论较明确. 讨论部分条理分明, 有较系统的理论分析. 但方法较简单.
电编: 李琪 编辑:潘伯荣
| 1. | Tang H, Hokita S, Che X, Baba M, Aridome K, Kijima F, Tanabe G, Takao S, Aikou T. Comparison of p53 expression in proximal and distal gastric cancer: histopathologic correlation and prognostic significance. Ann Surg Oncol. 1997;4:470-474. [PubMed] |
| 2. | Tannapfel A, Schmelzer S, Benicke M, Klimpfinger M, Kohlhaw K, Mossner J, Engeland K, Wittekind C. Expression of the p53 homologues p63 and p73 in multiple simultaneous gastric cancer. J Pathol. 2001;195:163-170. [PubMed] |
| 3. | Victorzon M, Nordling S, Haglund C, Lundin J, Roberts PJ. Expression of p53 protein as a prognostic factor in patients with gastric cancer. Eur J Cancer. 1996;32A:215-220. [PubMed] |
| 4. | Sud R, Wells D, Talbot IC, Delhanty JD. Genetic alterations in gastric cancers from British patients. Cancer Genet Cytogenet. 2001;126:111-119. [PubMed] |
| 5. | Hsieh LL, Hsieh JT, Wang LY, Fang CY, Chang SH, Chen TC. p53 mutations in gastric cancers from Taiwan. Cancer Lett. 1996;100:107-113. [PubMed] |
| 6. | Kataoka M, Okabayashi T, Johira H, Nakatani S, Nakashima A, Takeda A, Nishizaki M, Orita K, Tanaka N. Aberration of p53 and DCC in gastric and colorectal cancer. Oncol Rep. 2000;7:99-103. [PubMed] |
| 7. | Nimura Y, Mihara M, Ichimiya S, Sakiyama S, Seki N, Ohira M, Nomura N, Fujimori M, Adachi W, Amano J. p73, a gene related to p53, is not mutated in esophageal carcinomas. Int J Cancer. 1998;78:437-440. [PubMed] |
| 8. | Mai M, Yokomizo A, Qian C, Yang P, Tindall DJ, Smith DI, Liu W. Activation of p73 silent allele in lung cancer. Cancer Res. 1998;58:2347-2349. [PubMed] |
| 9. | Marin MC, Kaelin WG Jr. p63 and p73: old members of a new family. Biochim Biophys Acta. 2000;1470:M93-M100. [PubMed] |
| 10. | Kang MJ, Park BJ, Byun DS, Park JI, Kim HJ, Park JH, Chi SG. Loss of imprinting and elevated expression of wild-type p73 in human gastric adenocarcinoma. Clin Cancer Res. 2000;6:1767-1771. [PubMed] |
| 11. | Takahashi H, Fukutome K, Watanabe M, Furusato M, Shiraishi T, Ito H, Suzuki H, Ikawa S, Hano H. Mutation analysis of the p51 gene and correlation between p53, p73, and p51 expressions in prostatic carcinoma. Prostate. 2001;47:85-90. [PubMed] |
| 12. | Shinozaki H, Okamoto A, Shimizu K, Saito M, Yokota J, Ochiai K. Absence of p51 alteration in human ovarian cancer. Int J Oncol. 2001;18:549-552. [PubMed] |
| 13. | Hamada K, Koyama T, Shimizu K, Ikawa S, Kawate S, Yokota J, Ohwada S, Morishita Y. Absence of p51 mutation in human hepatocellular carcinoma. Cancer Lett. 2000;148:161-164. [PubMed] |
| 14. | Yang A, Walker N, Bronson R, Kaghad M, Oosterwegel M, Bonnin J, Vagner C, Bonnet H, Dikkes P, Sharpe A. p73-deficient mice have neurological, pheromonal and inflammatory defects but lack spontaneous tumours. Nature. 2000;404:99-103. [PubMed] |
| 15. | Mills AA, Zheng B, Wang XJ, Vogel H, Roop DR, Bradley A. p63 is a p53 homologue required for limb and epidermal morphogenesis. Nature. 1999;398:708-713. [PubMed] |
| 16. | Kaghad M, Bonnet H, Yang A, Creancier L, Biscan JC, Valent A, Minty A, Chalon P, Lelias JM, Dumont X. Monoallelically expressed gene related to p53 at 1p36, a region frequently deleted in neuroblastoma and other human cancers. Cell. 1997;90:809-819. [PubMed] |
| 17. | Marin MC, Jost CA, Irwin MS, DeCaprio JA, Caput D, Kaelin WG Jr. Viral oncoproteins discriminate between p53 and the p53 homolog p73. Mol Cell Biol. 1998;18:6316-6324. [PubMed] |
| 18. | Roth J, Dobbelstein M. Failure of viral oncoproteins to target the p53-homologue p51A. J Gen Virol. 1999;80:3251-3255. [PubMed] |
| 19. | Ishida S, Yamashita T, Nakaya U, Tokino T. Adenovirus-mediated transfer of p53-related genes induces apoptosis of human cancer cells. Jpn J Cancer Res. 2000;91:174-180. [PubMed] |