修回日期: 2006-06-20
接受日期: 2006-06-30
在线出版日期: 2006-08-28
目的: 探讨癌细胞淋巴管转移机制, 观察细胞黏附分子LYVE-1, ICAM-1及LFA-1在结肠腺癌组织及淋巴管的表达.
方法: 结肠腺癌患者术后组织标本60例, 其中淋巴结转移30例, 无淋巴结转移30例, 运用免疫组织化学的方法检测LYVE-1, ICAM-1及LFA-1在结肠腺癌组织及淋巴管的表达.
结果: 有淋巴结转移组的结肠腺癌淋巴管数密度(5.05±1.57 vs 3.45±1.84, P<0.01)和吸光度(0.231±0.078 vs 0.196±0.089, P<0.05)均比无淋巴结转移组增加, 单个淋巴管的平均面积减少; ICAM-1在淋巴结转移组结肠腺癌的癌细胞中表达上调(0.069±0.036 vs 0.017±0.012, P<0.01), 淋巴管不表达; LFA-1在结肠腺癌的血管及转移组部分淋巴管内皮上有表达.
结论: LYVE-1, ICAM-1及LFA-1在人结肠腺癌中的表达, 可能与淋巴管增生和扩张, 促进癌细胞的淋巴转移有关.
引文著录: 王晓蕾, 李晓冬, 周显礼, 李玉兰, 赵玲辉, 张雅芳. 结肠腺癌LYVE-1, ICAM-1及LFA-1的表达与淋巴道转移的关系. 世界华人消化杂志 2006; 14(24): 2411-2415
Revised: June 20, 2006
Accepted: June 30, 2006
Published online: August 28, 2006
AIM: To explore the mechanism of lymphatic metastasis by observing the expression of lymphatic vessel endothelial hyaluronan receptor-1 (LYVE-1), intercellular adhesion molecular-1 (ICAM-1) and lymphocyte function-associated antigen-1 (LFA-1) in colon adencarcinoma and lymphatic vessels.
METHODS: Immunohistochemistry was used to detect the expression of LYVE-1, ICAM-1 and LFA-1 in 60 patients (30 cases with lymphatic metastasis, 30 cases without lymphatic metastasis) with colon adencarcinoma.
RESULTS: The number density (5.05 ± 1.57 vs 3.45 ± 1.84, P < 0.01) and absorbency (0.231 ± 0.078 vs 0.196 ± 0.089, P < 0.05) of lymphatic vessels in patients with lymphatic metastasis were markedly higher than those in ones without lymphatic metastasis, and the average area of single lymphatic vessel was decreased. The expression of ICAM-1 (0.069 ± 0.036 vs 0.017 ± 0.012, P < 0.01) was increased in the cancer cells from patients with lymphatic metastasis in comparison with that in ones without metastasis, and it was not found in lymphatic vessels. The expression of LFA-1 was detected in the blood vessels and some lymphatic endothelia of colon adencarcinoma patients with lymphatic metastasis.
CONCLUSION: The expression of LYVE-1, ICAM-1 and LFA-1 may lead to hyperplasia and dilation of lymphatic vessels as well as the lymphatic metastasis of colon adencarcinoma.
- Citation: Wang XL, Li XD, Zhou XL, Li YL, Zhao LH, Zhang YF. Correlations of lymphatic vessel endothelial hyaluronan receptor-1, intercellular adhesion molecular-1 and lymphocyte function-associated antigen-1 expression with lymphatic metastasis in colon adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2411-2415
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2411.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2411
结肠癌是我国常见的恶性肿瘤之一, 其发病机制尚未十分明了. 由于饮食结构的改变等, 结肠癌的发病率有逐年增加的趋势. 结肠癌早期易发生淋巴道转移, 他的侵袭和转移是造成宿主死亡的主要因素. 因此, 研究结肠癌淋巴道转移机制已成为预后判断和防治的迫切需要. 近年来, 研究细胞黏附分子在肿瘤组织中的表达及其在肿瘤发生、侵袭及转移过程中的规律性变化成为肿瘤学研究的热点. 我们通过免疫组织化学的方法, 观察LYVE-1, ICAM-1及LFA-1在结肠腺癌组织及淋巴管的表达情况, 为探讨结肠腺癌细胞淋巴道浸润转移机制提供理论依据.
结肠腺癌标本60例取自哈尔滨医科大学附属第二医院病理科, 有淋巴结转移组和无淋巴结转移组各30例, 男36例, 女24例, 年龄33-80(平均55.8±11.2)岁, 标本均经HE染色病理诊断证实. 兔抗大鼠LFA-1多克隆抗体及兔抗大鼠ICAM-1多克隆抗体购自博士德公司, 兔抗人LYVE-1多克隆抗体购自Santa Cruz公司, PV-9000免疫组化试剂盒及SP-9002免疫组化试剂盒购自北京中杉金桥生物技术有限公司.
标本取结肠癌组织与正常组织交界处, 40 g/L多聚甲醛固定, 石蜡包埋, 连续切片; 石蜡切片常规脱蜡脱水, 30 mL/L H2O2浸30 min阻断内源性过氧化物酶; 0.01 mol/L枸橼酸盐缓冲液(pH 6.0)抗原修复; 血清封闭; 滴加一抗(1: 100), 4 ℃冰箱过夜; 加二抗37 ℃恒温烤箱内放置30 min; 以上各步骤间均以0.01 mol/LPBS缓冲液冲洗5 min×3; DAB显色, 苏木精复染, 脱水, 透明, 中性树脂封片. 采用真彩色病理图像分析系统4.0版本, 以吸光度(A)表示黏附分子在组织和淋巴管上的表达强度, 吸光度值越高, 表达越强, 如果值小于等于0, 视为无表达. 在每张载玻片上选取淋巴管或血管最多的5个视野进行统计, 对肿瘤组织随机选取3个视野进行统计.
统计学处理 应用SPSS 10.0软件包进行统计分析, 表达率的比较采用χ2检验, P<0.05时差别有显著性.
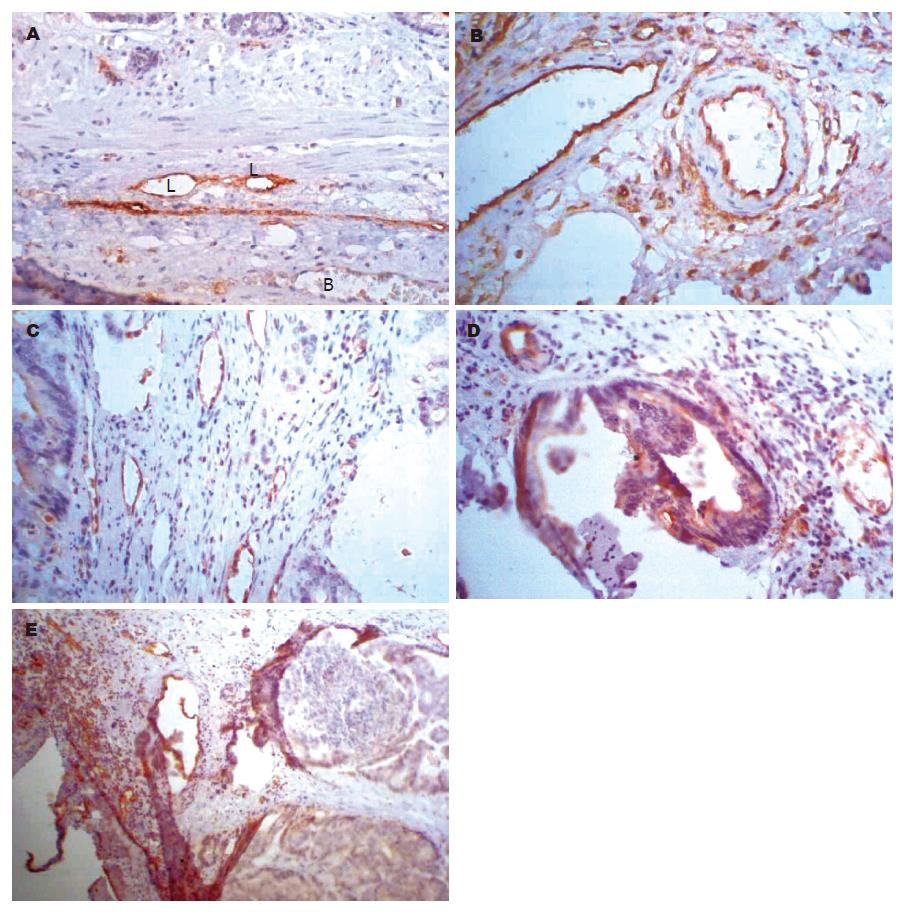
于癌组织中可见LYVE-1阳性表达的管状结构, 呈褐色. 这些管道管壁菲薄, 并且不规则, 管腔大, 通常呈塌陷状, 内皮细胞核大, 向腔内突出, 符合毛细淋巴管的典型形态学特征(图1A). 淋巴管腔内有时可见絮状物质、淋巴细胞、肿瘤细胞及其碎片. 毛细淋巴管主要分布在肿瘤组织与正常组织交界处, 肿瘤中心处的实质内几乎无淋巴管. 有淋巴结转移组的淋巴管数密度和吸光度均比无淋巴结转移组有明显增加, 在统计学上有意义(P<0.05). 此结果显示, 淋巴管数密度的增加、淋巴管壁吸光度的增强与淋巴结转移呈正相关. 淋巴管面密度虽然在有淋巴结转移组稍增加, 但无统计学意义(P>0.05). 平均单个淋巴管面积在两组间的差异虽然无统计学意义(P>0.05), 但可看出有下降的趋势.
所有60例标本中, ICAM-1对血管均有表达(图1B), 血管吸光度值大于0.2, 有淋巴结转移组与无淋巴结转移组的对比中, 无统计学意义(P>0.05). 在对血管数密度统计中, 显示有淋巴结转移组中的血管数密度明显大于无淋巴结转移组的血管数密度, 有显著意义(P<0.01). ICAM-1在所有标本的癌细胞中呈弱表达, 其吸光度值在0.1以下, 无淋巴结转移组的癌细胞中, 一部分近乎无表达, 其吸光度几乎为0, 有淋巴结转移组与无淋巴结转移组的吸光度进行比较, 差别有显著意义(P<0.01), 说明在有淋巴结转移组的结肠癌中, ICAM-1的表达上调(表1). 在所有60例标本中均未见ICAM-1在淋巴管上表达.
关于肿瘤淋巴道转移机制研究的关键问题就是淋巴管的识别. 因为毛细血管和毛细淋巴管形态学上辨认较困难, 导致肿瘤淋巴管的研究远远落后于血管的研究. LYVE-1可特异地结合细胞外基质成份中的透明质酸(HA)[1], 而且只局限于淋巴管壁的腔面, 而完全不表达在血管内皮上. 有报道LYVE-1还可表达在肝细胞上[2]. 我们看到, LYVE-1阳性表达在管壁较薄且不规则, 管腔较大, 通常呈塌陷状的管道上, 内无红细胞, 由核大向腔内突出的单层内皮细胞构成, 这符合毛细淋巴管的典型形态特征, 因此我们认为, LYVE-1可以作为癌组织淋巴管的特异性标记物. 我们观察到有淋巴结转移组的结肠癌其淋巴管数密度及吸光度与无淋巴结转移组相比显著增加, 说明淋巴管数密度及吸光度的增加与淋巴结转移呈正相关, 这一结果也说明了肿瘤的发展和淋巴结的转移可以促进肿瘤与正常组织交界处的淋巴管新生, 而淋巴管的新生又可能促进肿瘤淋巴道的转移; 淋巴管的表达与淋巴管内皮中HA有关, 也就是说淋巴管内皮中HA的增加与肿瘤转移呈正相关. 但也有研究显示, 在乳腺肿瘤内、肿瘤周边缺少淋巴管生成[3]. 最近, 又有人利用LYVE-1标记淋巴管在前列腺癌[4]、非小细胞肺鳞癌中进行研究[5], 表明肿瘤周边、肿瘤内淋巴管生成相差显著, 肿瘤周边高于肿瘤内淋巴管生成.
目前认为, 肿瘤细胞表达ICAM-1的意义包括矛盾的两方面, 其一是癌细胞与浸润性淋巴细胞的黏附可削弱癌细胞与癌细胞间的黏附, 促发癌细胞播散引起转移[6]; 另一方面, 癌细胞膜上的ICAM-1与T细胞表面的LFA-1结合后, 可为T细胞活化提供一种共刺激信号促进免疫系统对癌细胞的杀伤[7]. 较多研究证明, ICAM-1的表达强度不仅随着癌肿的不断进展而增高, 而且与癌细胞的分化程度密切相关[8-10]. 这些研究支持ICAM-1能促发癌细胞播散转移的作用. 但是, 也有少数学者研究认为, 其表达随病情进展而减低, 与肿瘤转移呈负相关[11-15]. 这又支持了ICAM-1作用的另一个方面, 即ICAM-1表达的降低, 使癌细胞膜上的ICAM-1与T细胞表面的LFA-1结合减少, 降低了免疫系统对癌细胞的杀伤力, 使癌肿增大、发展. 我们的研究结果支持前一种观点. 此外, 虽然ICAM-1在癌细胞中表达较弱, 但其表达随着癌肿的发展和转移而上调, 说明癌细胞表面的ICAM-1活性随着癌肿的发展和转移增强. 本实验中, ICAM-1对所有血管均出现强表达, 有淋巴结转移组的血管密度明显高于无淋巴结转移组, 这说明血管的密度随着肿瘤的进展明显增加, 而且与淋巴结转移具有密切的关系, 也就是说, 这个结论有力的支持了血管密度的增加, 可以促进肿瘤转移的观点, 这可能与血管的增加不仅能更好地支持肿瘤生长, 也能给肿瘤经血道转移提供了更多的方便条件有关. 我们还测定了ICAM-1在血管壁的吸光度, 在有淋巴结转移组与无淋巴结转移组的对比中, 无统计学意义, 说明血管对ICAM-1的表达只是血管内皮的特有表达, 与肿瘤转移与否无内在联系或无明显联系. 虽然ICAM-1在癌细胞中表达较弱, 其吸光度值在0.1以下, 但在有淋巴结转移组与无淋巴结转移组的对比中, 发现其表达随着癌肿的发展和转移而上调, 经统计学分析, 具有显著差异(P<0.01), 说明癌细胞表面的ICAM-1活性随着癌肿的发展和转移增强. 我们同时观察到, 作为ICAM-1的配体LFA-1在有淋巴结转移组的淋巴管中有少数可见阳性表达, 而无淋巴结转移组均无表达. 虽然例数不多, 但也是一个可喜的发现, 因为这提示我们想到ICAM-1有可能促使肿瘤细胞与有LFA-1活性的淋巴管内皮细胞黏附, 从而进入淋巴管, 造成淋巴道转移. 我们还证实了LFA-1在所有的标本的血管中都有表达, 说明癌细胞可能通过对ICAM-1高度表达的血管造成远处转移. 因此, 如若能阻止LFA-1在淋巴管上的表达, 就可能减少这一途径的远处淋巴结转移.
本研究显示, LYVE-1可以作为癌组织淋巴管的特异性标记物; ICAM-1及LFA-1这些黏附分子在肿瘤浸润和转移中发挥着重要的促进作用, 随着对其进行深入的研究, 有望开辟肿瘤治疗的又一重要途径.
肿瘤的发生、发展、侵袭和转移是一个十分复杂的生物学现象, 受到许多复杂因素的影响和制约, 其中也包括黏附分子的表达, 目前较多研究认为, ICAM-1与肿瘤转移有关, 也可能为肿瘤侵袭、转移的促进因素之一, 但其如何促进肿瘤转移的机制尚未阐述清楚.
在过去的10余年中, 人们对肿瘤转移的研究热点主要集中在肿瘤新生血管的研究上, 尤其是对血管内皮细胞生长因子(VEGF)的研究较多, 肿瘤血管形成以及抗血管形成的研究取得了令人瞩目的成就, 直到近几年, 人们开始认识到, 肿瘤淋巴管的形成在肿瘤的转移中同样发挥着重要的作用, 而黏附分子在其中发挥着重要的作用, 对其进行深入的研究, 有望开辟肿瘤治疗的又一重要途径.
以往对肿瘤转移的研究重点主要集中在微血管上, 对微小淋巴管的研究由于缺乏有效的淋巴管标记物, 研究较少. 本文立足于观察肿瘤淋巴转移、黏附分子、淋巴管三者的关系, 研究肿瘤淋巴管转移与黏附分子的关系.
目前, 针对抑制肿瘤血管新生的药物有许多优点, 如这类制剂作用广泛、可用于多种肿瘤、不诱导肿瘤细胞的耐药性、可多次重复应用、副作用少等. 因此对抑制淋巴管生成的研究无疑已成为当前抗癌研究的新热点. 可以预见, 随着对肿瘤的抗淋巴转移治疗的进一步深入研究, 有可能开辟肿瘤治疗的一个重要有效的途径.
本文研究的内容比较新颖, 通过研究得出了一定的数据与结果, 提供了有意义的信息, 具有科学性与创新性.
电编: 王晓瑜 编辑:潘伯荣
| 1. | Yonemasu H, Takashima M, Nishiyama KI, Ueki T, Yao T, Tanaka M, Tsuneyoshi M. Phenotypical characteristics of undifferentiated carcinoma of the pancreas: a comparison with pancreatic ductal adenocarcinoma and relevance of E-cadherin, alpha catenin and beta catenin expression. Oncol Rep. 2001;8:745-752. [PubMed] |
| 2. | Cursiefen C, Schlotzer-Schrehardt U, Kuchle M, Sorokin L, Breiteneder-Geleff S, Alitalo K, Jackson D. Lymphatic vessels in vascularized human corneas: immunohistochemical investigation using LYVE-1 and podoplanin. Invest Ophthalmol Vis Sci. 2002;43:2127-2135. [PubMed] |
| 3. | Williams CS, Leek RD, Robson AM, Banerji S, Prevo R, Harris AL, Jackson DG. Absence of lymphangiogenesis and intratumoural lymph vessels in human metastatic breast cancer. J Pathol. 2003;200:195-206. [PubMed] |
| 4. | Trojan L, Michel MS, Rensch F, Jackson DG, Alken P, Grobholz R. Lymph and blood vessel architecture in benign and malignant prostatic tissue: lack of lymphangiogenesis in prostate carcinoma assessed with novel lymphatic marker lymphatic vessel endothelial hyaluronan receptor (LYVE-1). J Urol. 2004;172:103-107. [PubMed] |
| 6. | Natali P, Nicotra MR, Cavaliere R, Bigotti A, Romano G, Temponi M, Ferrone S. Differential expression of intercellular adhesion molecule 1 in primary and metastatic melanoma lesions. Cancer Res. 1990;50:1271-1278. [PubMed] |
| 7. | Lefor AT, Fabian DF. Enhanced cytolytic activity of tumor infiltrating lymphocytes (TILs) derived from an ICAM-1 transfected tumor in a murine model. J Surg Res. 1998;75:49-53. [PubMed] |
| 8. | Wilting J, Tomarev SI, Christ B, Schweigerer L. Lymphangioblasts in embryonic lymphangiogenesis. Lymphat Res Biol. 2003;1:33-40. [PubMed] |
| 9. | Prevo R, Banerji S, Ferguson DJ, Clasper S, Jackson DG. Mouse LYVE-1 is an endocytic receptor for hyaluronan in lymphatic endothelium. J Biol Chem. 2001;276:19420-19430. [PubMed] |
| 10. | 宿 志弘, 李 继承, 季 一鸣. 结肠癌淋巴转移时细胞间黏附分子(ICAM-1)表达和树突状细胞分布. 浙江大学学报(理学版). 2003;3:327-331. |
| 11. | Ura H, Denno R, Hirata K. Correlation between nm23 protein and several cell adhesion molecules in human gastric carcinoma. Jpn J Cancer Res. 1996;87:512-517. [PubMed] |
| 12. | Heicappell R, Podlinski J, Buszello H, Ackermann R. Cell surface expression and serum levels of intercellular adhesion molecule-1 in renal cell carcinoma. Urol Res. 1994;22:9-15. [PubMed] |
| 13. | Tanaka H, Yashiro M, Sunami T, Ohira M, Hirakawa-Y S Chung K. Lipid-mediated gene transfection of intercellular adhesion molecule-1 suppresses the peritoneal metastasis of gastric carcinoma. Int J Mol Med. 2002;10:613-617. [PubMed] |
| 14. | Natali P, Nicotra MR, Cavaliere R, Bigotti A, Romano G, Temponi M, Ferrone S. Differential expression of intercellular adhesion molecule 1 in primary and metastatic melanoma lesions. Cancer Res. 1990;50:1271-1278. [PubMed] |
| 15. | Lefor AT, Fabian DF. Enhanced cytolytic activity of tumor infiltrating lymphocytes (TILs) derived from an ICAM-1 transfected tumor in a murine model. J Surg Res. 1998;75:49-53. [PubMed] |