修回日期: 2006-05-15
接受日期: 2006-06-14
在线出版日期: 2006-08-08
目的: 研究市售医用微生态制剂分离的单菌株对白假丝酵母菌芽管形成的影响.
方法: 分离市售益生菌产品单菌株10株, 采用结晶紫芽管染色法, 通过计算出芽率检测各益生菌分离菌株培养上清, 活菌体和热灭活菌体对白假丝酵母菌的出芽抑制.
结果: 五种微生态制剂单菌的中性培养上清对白假丝酵母菌的芽管生成均具有显著的抑制作用(P<0.01); 长双歧杆菌1, 嗜酸乳杆菌及两株芽孢杆菌的活菌可以抑制出芽; 热灭活菌体无法抑制白假丝酵母菌的出芽.
结论: 市售医用微生态制剂具备抑制白假丝酵母菌出芽的抑菌效果.
引文著录: 唐欢, 但国蓉, 魏泓. 医用微生态制剂分离菌株对白假丝酵母菌芽管形成的抑制作用. 世界华人消化杂志 2006; 14(22): 2237-2240
Revised: May 15, 2006
Accepted: June 14, 2006
Published online: August 8, 2006
AIM: To study the effect of the strains separated from probiotic products for medicinal purposes on the germ tube formation of Candida albicans.
METHODS: Ten single strains were isolated from the probiotic products bought from the market, respectively. Crystal violet-based germ tube assay was used and the inhibition efficiency of the culture supernatant, live bacteria and heat-killed bacteria from each probiotic products were evaluated by germination rate.
RESULTS: Neutralized spend culture suspension of all the single strains separated from probiotic products suppressed the germination of Candida albicans significantly (all P < 0.01). Live bacteria of Bifidobacterium longum 1, Lactobacillus acidophilus and Bacillus inhibited the germination while all the heat-killed bacteria didn't.
CONCLUSION: Probiotic products for medicinal purposes can inhibit the growth of germ tube of Candida albicans.
- Citation: Tang H, Dan GR, Wei H. Inhibition of Candida albicans germination by strains separated from probiotic products for medicinal purposes. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2237-2240
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2237.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2237
白假丝酵母菌(Candida albicans, C.albicans)性肠炎婴幼儿发病率较高, 多继发于长期腹泻, 营养不良及重症所致体质虚弱者, 尤其是在长期大量使用抗生素或激素等导致肠道菌群失调后更易诱发[1]. 临床上使用培菲康、金双歧、丽珠肠乐等微生态药物治疗此类感染, 效果与抗真菌药物无显著性差异, 且无副作用[2-4], 但除病例分析外, 对其拮抗白假丝酵母菌感染的机制并未做进一步研究. 白假丝酵母菌此类双相真菌可通过酵母相向菌丝相的转变增强其毒力[5], 而芽管结构是其菌相转化的起点, Hawser et al[6]研究表明, 药物对于芽管形成的干涉作用比抑制白假丝酵母菌本身的生长更适合作为评价抗真菌药物有效性的指标, 因此, 我们以抑制芽管形成为指标, 研究市售医用微生态制剂对白假丝酵母菌芽管形成的影响, 以探讨医用微生态制剂拮抗白假丝酵母菌感染的机制.
菌株及培养基(表1). 白假丝酵母菌在含有300 mL/L甘油的YPD培养基中于-70℃保存. 取冻存菌液按照1∶100的比例接种于新鲜的YPD液体培养基中, 30℃静置培养48-72 h; 乳杆菌和肠球菌分别于MRS及M17液体培养基中, 37℃静置培养24 h; 芽孢杆菌于营养培养基中, 37℃振荡培养24 h; 双歧杆菌于PTYG液体培养基中, 37℃厌氧培养24 h.
| 菌株名称 | 培养基 | 来源 | 备注 |
| ATCC90028(白假丝酵母菌) | YPD | 第三军医大学西南医院皮肤科惠赠 | NCCLS推荐使用菌株 |
| 嗜酸乳杆菌 | MRS(Oxoid) | 分离自培菲康 | 上海医药(集团)有限公司 |
| 长双歧杆菌1 | PTYG | 信谊制药总厂 | |
| 粪肠球菌 | M17(Difco) | ||
| 保加利亚乳杆菌 | MRS(Oxoid) | 分离自金双歧 | 内蒙古双歧股份有限公司 |
| 长双歧杆菌2 | PTYG | ||
| 嗜热链球菌 | M17(Difco) | ||
| 青春双歧杆菌 | PTYG | 分离自丽珠肠乐 | 丽珠集团丽珠制药厂 |
| 地衣芽孢杆菌 | 营养琼脂(北京奥博星) | 分离自整肠生 | 沈阳第一制药厂 |
| 枯草芽孢杆菌 | 营养琼脂(北京奥博星) | ||
| 屎肠球菌 | M17(Difco) | 分离自妈咪爱 | 北京韩美药品有限公司 |
益生菌菌株的分离及鉴定详见文献[7], 简述如下: 从选择性培养基平皿挑取典型单菌落进行表型鉴定和常规生化鉴定[8], 同时提取各单菌落培养物的基因组DNA[9], 以提取的细菌基因组DNA为模板, 使用细菌通用引物27f及1492r[10]对其进行16S rDNA序列扩增, 将测定序列上传至GenBank数据库获Accession Number, 用BLAST工具将测定的序列与GenBank中的序列进行同源性比对分析. 白假丝酵母菌CFU测定使用10倍系列稀释法, 于最后3个稀释度各取100 μL滴入YPD培养基平皿上, 并用L形棒涂布均匀, 各做2个重复, 置37℃有氧条件下培养48 h后进行CFU计数. 收获新鲜白假丝酵母菌ATCC90028菌液, 使用1×PBS (pH 7.4)漂洗2次, 洗涤后的样品使用FBS (fetal bovine serum, 天津TBD公司)重悬, 将菌浓度调至5×109 CFU/L; 调节好浓度的白假丝酵母菌按照100 μL/孔的量加入96孔板中, 再加入等量的添加物使体系血清终浓度为50%, 37℃孵育2 h诱导出芽. 与白假丝酵母菌共孵育的添加物分为益生菌培养上清、益生菌活菌及热灭活菌体, 对照孔添加物为等体积PBS (pH 7.4). 由产品中分离的益生菌菌株, 经过24 h培养后12 000 g离心获取上清液, 所有上清液均调节至中性, 0.22 μm微孔滤膜过滤后即获中性培养上清; 活菌经1×PBS (pH 7.4)漂洗2次后调节至不同菌密度; 80℃处理30 min获得热灭活菌体. 芽管形成定量检测以Abe et al[11]的结晶紫染色法为基础加以改进, 方法如下: 孵育后的样品使用700 mL/L的乙醇洗涤1次; 吸去乙醇后, 每孔中加入2.5 g/L SDS 200 μL, 弃去SDS, 去离子水洗涤3次以清除SDS; 显微镜观察, 确定没有出芽黏附的白假丝酵母菌已经被洗掉后, 每孔中添加1 g/L的结晶紫100 μL, 染色10 min; 倒掉染液后, 96孔板使用去离子水洗涤3次, 使用2.5 g/L的SDS洗涤1次, 去离子水再洗涤2次; 96孔板自然干燥后, 每孔加入异丙醇-0.04 mol/L HCl 200 μL和2.5 g/L SDS 50 μL, 在摇床上进行短暂固定; 酶标仪读取A590nm的值; 计算出芽率, 公式为: 出芽率(%) = (实验孔A590-空白孔A590)/(对照孔A590-空白孔A590).
统计学处理 采用SPSS12.0软件, t检验组间比较, P<0.05为统计学上有显著差异.
益生菌10株的培养上清(pH 7.4)对于白假丝酵母菌的芽管形成均具有显著的抑制作用, 且双歧杆菌、乳杆菌、肠球菌同种不同株的抑菌效果存在显著差异(表2).
| 培养上清, pH 7.4 | A590 | 出芽率(%) |
| 长双歧杆菌1 | 0.226±0.04 | 43.27±8.87d |
| 长双歧杆菌2 | 0.278±0.03 | 54.77±5.49da |
| 青春双歧杆菌 | 0.333±0.02 | 67.09±6.39da |
| 嗜酸乳杆菌 | 0.181±0.04 | 33.32±11.05d |
| 保加利亚乳杆菌 | 0.408±0.05 | 83.65±2.66db |
| 粪肠球菌 | 0.154±0.03 | 27.33±4.40d |
| 屎肠球菌 | 0.191±0.02 | 35.39±6.36dc |
| 嗜热链球菌 | 0.342±0.03 | 68.90±3.55d |
| 枯草芽孢杆菌 | 0.248±0.03 | 48.08±6.60d |
| 地衣芽孢杆菌 | 0.259±0.02 | 50.63±8.08d |
| 对照(PBS, pH 7.4) | 0.482±0.01 | 100±8.87 |
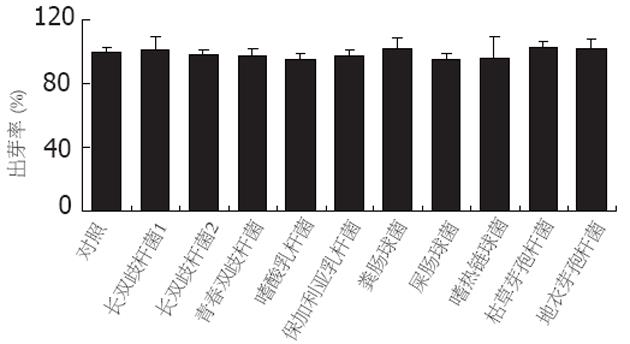
益生菌与白假丝酵母菌浓度之比对益生菌的抑菌能力有一定影响, 该比例降低则对芽管的抑制能力也有所降低, 仅枯草芽孢杆菌和地衣芽孢杆菌的抑菌效果未受浓度变化的影响(表3).
| 活菌 | 出芽率(%) | |
| Probiotic: C.albicans=10∶1 | Probiotic: C.albicans=1∶1 | |
| 长双歧杆菌1 | 69.44±9.91d | 95.43±18.25 |
| 长双歧杆菌2 | 94.99±12.10a | 96.14±6.99 |
| 青春双歧杆菌 | 99.88±8.40a | 101.30±3.96 |
| 嗜酸乳杆菌 | 84.94±5.27c | 104.97±2.82 |
| 保加利亚乳杆菌 | 96.77±3.44b | 101.58±2.74 |
| 粪肠球菌 | 103.08±10.52 | 100.71±23.08 |
| 屎肠球菌 | 92.59±10.28 | 101.18±5.84 |
| 嗜热链球菌 | 107.65±20.14 | 111.20±20.96 |
| 枯草芽孢杆菌 | 91.64±20.27c | 84.07±10.73c |
| 地衣芽孢杆菌 | 92.43±2.12c | 91.25±4.02c |
| 对照(PBS, pH 7.4) | 100±3.48 | 100±6.24 |
近年来, 医源性菌群失调频发, 继发真菌感染明显增多, 白假丝酵母菌成为深部真菌感染的主要致病菌之一. 由于白假丝酵母菌性肠炎患者多为婴幼儿及危重患者, 而临床一线抗真菌药物普遍具有较强的胃肠道反应, 因此使用微生态疗法治疗真菌性肠炎日益受到关注. 目前国内医用微生态制剂主要选用的益生菌包括双歧杆菌、乳杆菌、芽孢杆菌及肠球菌等, 这些益生菌具备提供肠道营养、提高机体免疫能力、维持肠道低pH环境及帮助恢复肠道菌群等复合作用, 而针对单一标靶性致病菌的抑制和拮抗, 其确切的功效成分及特异的抑菌机制仍缺乏深入研究. 我们分离鉴定了5种微生态药物的10株益生菌单菌株, 其中性培养上清和部分活菌可显著的抑制白假丝酵母菌的芽管形成. 与热灭活菌体共孵育并没有降低出芽率, 说明无代谢能力的益生菌不具备拮抗白假丝酵母菌的能力, 加之将培养上清调节至中性完全避免了pH值本身对于白假丝酵母菌的抑制, 因此抑制芽管形成、拮抗白假丝酵母菌感染的主要作用因子极可能为益生菌的代谢产物本身, 该结果与Noverr et al[12]对三株乳杆菌拮抗白假丝酵母菌的结果相似. 双歧杆菌、乳杆菌、肠球菌及链球菌等乳酸细菌均可代谢产生大量短链脂肪酸(如乙酸、丙酸、丁酸等), 但是有研究显示, 乙酸, 丙酸及乳酸随着其pH值的中和逐渐失去抗真菌活性[13-14]; 丁酸则具有较强的免疫调节活性, 并且可通过抑制几丁质合成酶、破坏真菌细胞壁而阻止真菌发生形态改变[15], 即便在中性pH值下对于白假丝酵母菌的芽管形成也具有明显的阻断作用[12], 因此丁酸的抗真菌作用机制值得进一步深入研究. 结合我们后续的抑菌实验结果, 10株菌中仅2株芽孢杆菌的中性SCS可形成阳性抑菌圈, 其余均为阴性, Kim et al[16]的研究显示, 地衣芽孢杆菌可产生抗菌能力极强的苯乙酸, 直接杀死包括白假丝酵母菌在内的多种真菌, 由此可见, 芽孢杆菌对白假丝酵母菌的抑菌机制可能有别于乳酸菌.
当前, 针对传统抗真菌药物的毒副作用和真菌耐药性的增强, 开展医用微生态制剂抗真菌感染的机制研究, 对于拓展微生态药物的适应症、促进其在抗真菌感染中的运用具有积极意义. 我们首次将国内主要微生态药品的所有单菌株用于体外芽管抑制实验, 并发现微生态药物可以通过其代谢产物抑制试验芽管形成, 结果提示, 这可能是微生态药物拮抗肠道试验感染的机制之一.
近年来, 白假丝酵母菌成为医源获得性感染的主要病原菌之一, 胃肠道真菌感染患者增多, 除传统抗真菌药物外, 微生态疗法也已广泛应用于霉菌性腹泻的治疗. 益生菌药物疗效显著, 安全性高, 具备开发为抗真菌药物的潜力, 但其拮抗此类条件性致病真菌的基础研究相对较少, 作用机制的研究亟待深入.
芽管结构作为白假丝酵母菌明确的致病因子成为筛选抗双相真菌药物的标靶. 芽管可以促进白假丝酵母菌对宿主细胞的黏附, 穿透及破坏, 芽管的形成与白色念珠菌毒力的增强密切相关. 当前大量报道聚焦于芽管的萌发过程、诱导条件、阻断途径等.
我国主要微生态药物对白假丝酵母菌抑菌活性的实验研究尚无报道, 而对益生菌抑制白假丝酵母菌的研究重点大部分仍定位于数量抑制, 本文首次将药品分离的10株益生菌单菌株用于白假丝酵母菌的芽管抑制实验, 进一步明确了微生态制剂抑制白假丝酵母菌生长并削弱其毒力的作用方式.
临床病例分析已经表明医用微生态制剂具有治疗真菌性肠炎的良好疗效, 但目前我国尚无微生态药物标注有相关适应症, 本文为拓宽微生态药物的适应症积累了药效学资料. 此外, 对于白假丝酵母菌芽管的定量检测, 结晶紫芽管染色法较传统的光镜观察计数法更为快速和客观.
1 益生菌制剂: 可以改善宿主肠道微生态平衡且含生理性活菌的微生物制剂.
2 芽管: 白假丝酵母行无性繁殖, 芽体从母细胞表面膨出并最终以菌丝态从母体缢断的过程称为出芽, 萌发过程中形成的早期结构成为芽管, 芽管进一步发展成为新的菌丝.
本研究初步探讨了10株微生态制剂对白色念珠菌芽管形成的抑制作用, 观察微生态单菌及其培养上清的抗真菌活性, 得到了有意义的结果, 但研究方法较为简单.
电编: 张敏 编辑:潘伯荣
| 1. | Dong Y, Wang BC, Zhang YX. Clinical and experimental study on treatment of infantile mycotic enteritis by jiechang mixture. Zhongguo Zhongxiyijiehe Zazhi. 2001;21:419-421. |
| 5. | van Burik JA, Magee PT. Aspects of fungal pathogenesis in humans. Annu Rev Microbiol. 2001;55:743-772. [PubMed] [DOI] |
| 6. | Hawser S, Islam K. Comparisons of the effects of fungicidal and fungistatic antifungal agents on the morphogenetic transformation of Candida albicans. J Antimicrob Chemother. 1999;43:411-413. [PubMed] [DOI] |
| 9. | Cheng HR, Jiang N. Extremely rapid extraction of DNA from bacteria and yeasts. Biotechnol Lett. 2006;28:55-59. [PubMed] [DOI] |
| 10. | Suzuki K, Sasaki J, Uramoto M, Nakase T, Komagata K. Agromyces mediolanus sp. nov., nom. rev., comb. nov., a species for "Corynebac-terium mediolanum" Mamoli 1939 and for some aniline-assimilating bacteria which contain 2, 4-diaminobutyric acid in the cell wall peptidogly-can. Int J Syst Bacteriol. 1996;46:88-93. [PubMed] [DOI] |
| 11. | Abe S, Satoh T, Tokuda Y, Tansho S, Yamaguchi H. A rapid colorimetric assay for determination of leukocyte-mediated inhibition of mycelial growth of Candida albicans. Microbiol Immunol. 1994;38:385-388. [PubMed] [DOI] |
| 12. | Noverr MC, Huffnagle GB. Regulation of Candida albicans morphogenesis by fatty acid metabolites. Infect Immun. 2004;72:6206-6210. [PubMed] [DOI] |
| 13. | Atanassova M, Choiset Y, Dalgalarrondo M, Chobert JM, Dousset X, Ivanova I, Haertle T. Isolation and partial biochemical characterization of a proteinaceous anti-bacteria and anti-yeast compound produced by Lactobacillus paracasei subsp. paracasei strain M3. Int J Food Microbiol. 2003;87:63-73. [PubMed] [DOI] |
| 14. | Lind H, Jonsson H, Schnurer J. Antifungal effect of dairy propionibacteria-contribution of organic acids. Int J Food Microbiol. 2005;98:157-165. [PubMed] [DOI] |
| 15. | Hoberg KA, Cihlar RL, Calderone RA. Inhibitory effect of cerulenin and sodium butyrate on germination of Candida albicans. Antimicrob Agents Chemother. 1983;24:401-408. [PubMed] [DOI] |
| 16. | Kim Y, Cho JY, Kuk JH, Moon JH, Cho JI, Kim YC, Park KH. Identification and antimicrobial activity of phenylacetic acid produced by Bacillus licheniformis isolated from fermented soybean, Chungkook-Jang. Curr Microbiol. 2004;48:312-317. [PubMed] [DOI] |