修回日期: 2006-05-20
接受日期: 2006-05-29
在线出版日期: 2006-07-28
目的: 采用尾静脉液压法注射SB转座元(sleeping beauty transposon)系统转人类白细胞介素10 (human interleukin-10, hIL-10)在大鼠肝组织中的表达.
方法: 采用Ringers溶液20 mL经尾静脉10-12 s内快速注射. 实验分组: Ringers 20 mL对照组、DOTAP 100 μg空白组、DOTAP 100 μg+pT-hIL-10 50 μg转基因组、pT-hIL-10 50 μg+pCMV-SB 5 μg共注射组(每组n = 6). 尾静脉注射后采血检测肝功能和转基因组血清中hIL-10的表达. RT-PCR法检测转基因组术后7, 14 d肝组织中hIL-10 mRNA的表达.
结果: 尾静脉注射后1, 4, 7 d Ringers 20 mL组、DOTAP组、DOTAP+pT-hIL-10组、pT-hIL-10+pCMV-SB共注射组ALT水平分别为: 4339±602, 13 516±535, 6576±347, 4451±465; 984±125, 4087±600, 2117±243, 1158±130; 592±85, 2339±300, 1384±165, 40±663 nkat/L. DOTAP+pT-hIL-10组、pT-hIL-10+pCMV-SB共注射组术后1, 4, 7, 14 d血清hIL-10浓度分别为: 818.3±24.9, 640.7±20.6, 441.3±25.4, 322.3±15.4和1008.3±65.8, 820.8±20.9, 675.8±31.6, 438.2±26.0 μg/L, 两组相比有显著差异(P<0.01). 转座元转基因组2 wk后仍有hIL-10 mRNA表达, 高于DOTAP转基因组.
结论: 尾静脉液压法注射转hIL-10可在大鼠肝组织中较长时间表达, 联合SB转座元系统转hIL-10可提高转基因的效率.
引文著录: 成峰, 王学浩, 肇毅, 黄蓬. 尾静脉液压法注射转hIL-10在大鼠肝组织中的表达. 世界华人消化杂志 2006; 14(21): 2135-2138
Revised: May 20, 2006
Accepted: May 29, 2006
Published online: July 28, 2006
AIM: To study hydrodynmics-based delivery of human interleukin-10 (hIL-10) transferred with Sleeping Beauty (SB) transposon system in rats.
METHODS: All the rats were injected with 20 mL Rinegers solution within 10-12 s via the tail vein. The rats were divided into the following groups according to different treatments: Ringers control; 100 μg empty liposome DOTAP; 100 μg liposome DOTAP + 50 μg pT-hIL-10; 50 μg pT-hIL-10 + 5 μg pCMV-SB (n = 6, in each group). The levels of alanine aminotransferase (ALT) were measured in each group, and the concentrations of hIL-10 in the serum were examined by enzyme-linked immunosorbent assay (ELISA) on postoperative day 1, 4, 7, 14 in transferred gene groups, respectively. The expression of hIL-10 mRNA was detected by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: The levels of alanine aminotransferase were as follows: 4339 ± 602, 13 516 ± 535, 6576 ± 347, 4451 ± 465; 984 ± 125, 4087 ± 600, 2117 ± 243, 1158 ± 130; 592 ± 85, 2339 ± 300, 1384 ± 165, 667 ± 90 nkat/L on postoperative day 1, 4, 7 in the group of Ringers control, empty liposome DOTAP, liposome DOTAP + pT-hIL-10 and pT-hIL-10 + pCMV-SB, respectively. The concentrations of hIL-10 in the serum were 818.3 ± 24.9, 640.7 ± 20.6, 441.3 ± 25.4, 322.3 ± 15.4 and 1008.3 ± 65.8, 820.8 ± 20.9, 675.8 ± 31.6, 438.2 ± 26.0 μg/L on postoperative day 1, 4, 7, 14 in the latter two groups, respectively, and there were significantly differences between the two groups (P < 0.01). In pT-hIL-10 + pCMV-SB transferred gene group, hIL-10 mRNA expression was still detected on postoperative day 14.
CONCLUSION: High level of hIL-10 gene can be expressed by hydrodynmics-based delivery in rats, and the transfection rate efficacy can be improved with combination of SB transposon system.
- Citation: Cheng F, Wang XH, Zhao Y, Huang P. Hydrodynmics-based delivery of human interleukin-10 gene in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(21): 2135-2138
- URL: https://www.wjgnet.com/1009-3079/full/v14/i21/2135.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i21.2135
质粒介导外源基因在体内的表达是研究基因功能和基因治疗的主要手段. 自从Wolff et al[1]最先证明骨骼肌可被DNA转染以来, 裸质粒DNA注射介导外源基因转移和表达已被广泛应用. 质粒具有制备简便、廉价, 且安全性较高等优点, 但也存在着转染效率差、表达水平低等缺点. 因此如何提高裸DNA注射介导外源基因转移效率和表达水平是该研究领域的重点. Liu et al[2]与Zhang et al[3-4]从小鼠尾静脉快速注射大容量DNA溶液, 能够介导外源基因的高效表达, 与常规方法相比能够提高100-1000倍, 在肝脏中荧光素酶表达水平最高, 同时在脾、肾、心、肺中也检测到低水平的表达. 该方法介导裸质粒转移及表达水平主要决定于注射时在体内形成的瞬时液压, 被称为尾静脉液压法或尾静脉大容量快速注射法. 我们在构建转座元表达质粒pT-hIL-10 (human interleukin-10)的基础上, 采用尾静脉液压法注射SB转座元(sleeping beauty transposon)系统转hIL-10, 并与阳离子脂质体DOTAP介导的方法相比较, 研究转导基因在大鼠肝组织中的表达.
SD大鼠由江苏省实验动物中心提供, 体质量200-220 g, 均在南京医科大学动物中心无病理条件下饲养, 术前12 h禁食. hcDNA片段插入带EF启动子的转座元表达质粒框架即pT-hIL-10(与上海复旦大学生命科学院基因治疗试验室卢斌博士合作完成), 转座酶表达质粒pCMV-SB由Dr. Zoltan Ivics[5]提供.
所有实验组采用Ringers溶液20 mL经尾静脉10-12 s内快速注射, 实验分组: Ringers 20 mL对照组(n = 6)、100 μg DOTAP空白组(n = 6)、100 μg DOTAP+50 μg pT-hIL-10转基因组(n = 6)、50 μg pT-hIL-10+5 μg pCMV-SB共注射组(n = 6). 尾静脉注射后1, 4, 7 d采血检测肝功能和转基因组1, 4, 7, 14 d检测血清中hIL-10的表达. RT-PCR法检测转基因组术后7, 14 d肝组织中hIL-10 mRNA的表达. 肝穿刺取各组(n = 3)大鼠肝脏组织, 液氮中速冻后转移至-70℃冰箱保存. 取100 mg组织抽提总RNA, A260/A280在1.8-2.0之间. hIL-10的引物上游5'GG(GAATTC)ATGCACAGCTCAGCACTGC3'括号内为EcoRⅠ酶切位点; 下游引物为5'CC(GGATCC)GATTTTGGAGAC3', 括号内为BamHⅠ酶切位点, 扩增片段为610 bp. β-actin的引物上游5'CCTTCCTGTGCATGGAGTCCT3', 下游引物为5'GGAGCAATGATCTTGATCTTC3', 扩增片段为202 bp. 反应条件: 94℃预变性5 min; 94℃变性45 s, 55℃退火1 min, 72℃延伸1 min, 共38个循环; 再72℃延伸7 min, 4℃保存.
Ringers对照组术后4 d肝功能基本恢复正常, SB转座元组肝功能与Ringers对照组之间无差异, DOTAP组术后1, 4, 7 d ALT水平明显高于同一时间段的SB转座元组和Ringers对照组(P<0.01). DOTAP基因治疗组的肝功能损伤程度较DOTAP对照组轻, 两组之间有显著性差异(P<0.01)(表1).
DOTAP+pT-hIL-10组、pT-hIL-10+pCMV-SB共注射组术后1, 4, 7, 14 d血清hIL-10浓度分别为: 818.3±24.9, 640.7±20.6, 441.3±25.4, 322.3±15.4和1008.3±65.8, 820±20.9, 676±31.6, 438±26.0 μg/L. 两组之间差异性显著(P<0.01).
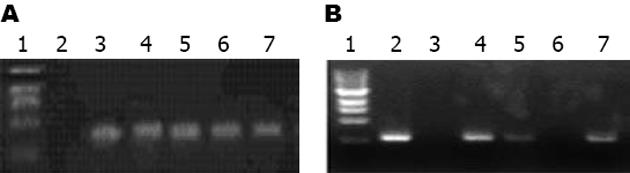
转座元转导hIL-10基因和DOTAP治疗组术后1 wk时均可检测到mRNA表达, 术后2 wk转座元转导hIL-10基因组仍可表达mRNA, 而DOTAP治疗组未能检测到mRNA表达(图1).
裸质粒作为基因表达及基因治疗载体, 与病毒载体相比有许多突出的优点, 如制备简易, 廉价, 注射后无载体本身引起的免疫反应, 安全性高等. 但由于裸质粒体内转染效率低, 所以应用受到了限制. 裸质粒体内转染效率的提高一直是该领域的研究热点. 液压法(hydrodynamics-based procedure, 又称尾静脉大容量快速注射法)是近年发展起来的血管注射途径介导裸质粒高水平表达的又一简易注射方法. 这种尾静脉液压法不仅可用于小鼠, 也可用于大鼠. Maruyama et al[6]将Epo表达质粒通过尾静脉以25 mL体积15 s速度注射到大鼠体内(100 mL/kg体质量)得到Epo的最大表达水平. 由于大鼠对频繁采血监测血液参数更加耐受, 因此更加适合生物医学研究. 血管注射途径介导的裸质粒转移效率及表达水平之高十分令人吃惊, 可与病毒载体相媲美, 液压法介导的DNA高效转移机制也成为近年来的研究热点. Budker推测可能的机制是: (1)细胞膜大面积破坏. 血管高压注射能介导外源基因在体内许多组织中高水平表达, 但需要大体积快速注射, 在血管中形成压力. 这种注射过程会产生两种力量破坏细胞膜: 作用于血管壁的总体压力和液体由血管腔流到细胞造成的剪切力. 与膜破坏理论相悖的观点是, 靶器官中只有特定的细胞表达外源基因, 如肌肉中只有肌纤维, 肝脏中只有肝细胞表达外源基因(内皮细胞不表达). 所以此理论不能充分解释裸质粒DNA在肝脏和肌肉的实质细胞中的定位表达. (2)细胞膜小孔形成. 这一假说认为质粒DNA通过细胞膜上瞬间的穿孔进入细胞, 这种穿孔或者是自然产生, 或者由于注射过程造成. 注射早期质粒DNA的摄取可能由此介导. 尾静脉液压法介导质粒注射后外源基因在最初几天维持高水平表达, 此后迅速下降, 30 d时降到最底水平. 为了提高此方法的应用价值, 研究者们发展了许多延长外源基因表达的措施. SB转座元是近年发现的哺乳动物转座元, 可在SB转座酶作用下将所携带的外源基因整合到脊椎动物细胞染色体上, 介导外源基因长期表达. 他不存在病毒载体的缺点(多拷贝插入, 细胞复制时才可整合, DNA大小的严格限制, 整合到表达易被削弱的位点, 外壳蛋白引起的免疫反应, 生产困难等). 尽管转座元作为基因转移载体仍存在许多潜在的问题, 如转座效率, 转座引起的后果, 以及将转座元载体有效转移到细胞核中等, 但转座元在基因治疗中的应用是必然的, 尤其在肝细胞生物学研究中具有重要的应用价值[7-16]. Yant et al[17]将转座元系统携带的人FIX注射到小鼠体内后, 人FIX表达框架在5%-6%被转染的肝细胞中发生整合, 人FIX在体内的77-105 μg/L表达量持续5 mo以上, 这些结果为基因治疗载体设计提供了新的策略.
我们采用液压法选择SB转座元介导hIL-10基因, 并与DOTAP包裹hIL-10质粒进行转基因比较其在大鼠肝组织中的表达. DOTAP可与带负电荷的DNA高效结合, 产生稳定的转染复合物与细胞结合, 将DNA释放入细胞内. DOTAP具有高效、低毒、适用细胞类型多的特点, 在有血清和无血清的情况下均可使用. 液压法对各实验组肝功能损伤的结果表明, Ringers对照组术后4 d肝功能基本恢复正常, SB转座元组肝功能与Ringers对照组之间无差异, DOTAP对大鼠肝功能的影响也不容忽略, 本组实验中术后1, 4, 7 d ALT水平明显高于同一时间段的SB转座元组和Ringers对照组(P<0.01). 从而表明脂质体DOTAP对大鼠肝功能的损伤较大. 同时实验中发现DOTAP基因治疗组的肝功能损伤程度较DOTAP对照组轻, 两组之间有显著性差异(P<0.01). 对此情况可能的解释是一方面DOTAP对肝组织有损伤, 另一方面与转导的目的基因hIL-10有关, IL-10是强有力的炎症抑制因子, 在炎症的发生中起重用的作用. Higuchi et al[18]采用液压法注射转vIL-10基因在大鼠肝组织中的表达, 术后vIL-10的峰值为656.1 μg/L, 低于本实验中DOTAP转hIL-10组, 从而表明DOTAP介导大鼠体内转基因治疗可提高基因的转导效率, 但转导效率仍明显低于SB转座元组(P<0.01), 且维持高浓度表达hIL-10时间短, 实验中术后1, 4, 7, 14 d hIL-10水平明显低于同一时间段的SB转座元组(P<0.01); 对转座元转导hIL-10基因检测表明术后2 wk仍可表达mRNA, 明显高于DOTAP治疗组(P<0.01). 液压法注射脂质体DOTAP介导的转基因治疗由于其肝功能损伤严重, 转导后表达的目的基因持续时间较SB介导转基因短. 尾静脉液压法注射转hIL-10可在大鼠肝组织中较长时间的表达, 是一种简便、有效的转基因方法. 尾静脉液压法注射SB转座元系统转hIL-10可提高转基因的效率, 为我们进一步研究打下基础.
裸质粒DNA注射介导外源基因转移和表达已被广泛应用, 但存在着转染效率差、表达水平低等缺点. 从小鼠尾静脉快速注射大容量DNA溶液, 能够介导外源基因的高效表达, 与常规方法相比能够提高100-1000倍. Sleeping Beauty转座元(SB)是近年发现的哺乳动物转座元, 可在Sleeping Beauty转座酶作用下将所携带的外源基因整合到脊椎动物细胞染色体上, 介导外源基因长期表达.
Maruyamaetal将Epo表达质粒通过尾静脉以25 mL体积15 s速度注射到大鼠体内(100 mL/kg体质量)得到Epo的最大表达水平. 由于大鼠对频繁采血监测血液参数更加耐受, 因此更加适合生物医学研究. Yant et al将SB转座元系统携带的人FIX注射到小鼠体内后, 人FIX表达框架在5%-6%被转染的肝细胞中发生整合, 人FIX在体内的77-105 ng/mL表达量持续5 mo以上.
尾静脉液压法注射SB转座元系统转hIL-10可提高转基因的效率, 转导的目的基因可较长时间高表达, 为转基因实验研究提供了一个简便有效的方法.
本研究采用尾静脉液压法注射SB转座元系统转hIL-10后, 目的基因在大鼠肝组织中的表达效率, 以寻求一种有效的裸质粒转染方法, 具有一定的实验价值.
电编: 张敏 编辑:潘伯荣
| 1. | Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A, Felgner PL. Direct gene transfer into mouse muscle in vivo. Science. 1990;247:1465-1468. [PubMed] [DOI] |
| 2. | Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 1999;6:1258-1266. [PubMed] [DOI] |
| 3. | Zhang G, Budker V, Wolff JA. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Hum Gene Ther. 1999;10:1735-1737. [PubMed] [DOI] |
| 4. | Zhang G, Song YK, Liu D. Long-term expression of human alpha1-antitrypsin gene in mouse liver achieved by intravenous administration of plasmid DNA using a hydrodynamics-based procedure. Gene Ther. 2000;7:1344-1349. [PubMed] [DOI] |
| 5. | Ivics Z, Hackett PB, Plasterk RH, Izsvak Z. Molecular reconstruction of Sleeping Beauty, a Tc1-like transposon from fish, and its transposition in human cells. Cell. 1997;91:501-510. [PubMed] [DOI] |
| 6. | Maruyama H, Higuchi N, Nishikawa Y, Kameda S, Iino N, Kazama JJ, Takahashi N, Sugawa M, Hanawa H, Tada N. High-level expression of naked DNA delivered to rat liver via tail vein injection. J Gene Med. 2002;4:333-341. [PubMed] [DOI] |
| 7. | Frommolt R, Rohrbach F, Theobald M. Sleeping Beauty transposon system-future trend in T-cell-based gene therapies? Future Oncol. 2006;2:345-349. [PubMed] [DOI] |
| 8. | Boezaart AP, Raw RM. Sleeping beauty or big bad wolf? Reg Anesth Pain Med. 2006;31:189-191. [PubMed] [DOI] |
| 9. | Saeki Y. Stable CNS gene delivery with Sleeping Beauty armed with a high-capacity HSV virion. Mol Ther. 2006;13:457-458. [PubMed] [DOI] |
| 10. | Wilber A, Frandsen JL, Geurts JL, Largaespada DA, Hackett PB, McIvor RS. RNA as a source of transposase for sleeping beauty-mediated gene insertion and expression in somatic cells and tissues. Mol Ther. 2006;13:625-630. [PubMed] [DOI] |
| 11. | Score PR, Belur LR, Frandsen JL, Guerts JL, Yamaguchi T, Somia NV, Hackett PB, Largaespada DA, McIvor RS. Sleeping Beauty-mediated transposition and long-term expression in vivo: use of the LoxP/Cre recombinase system to distinguish transposition-specific expression. Mol Ther. 2006;13:617-624. [PubMed] [DOI] |
| 12. | Starr TK, Largaespada DA. Cancer gene discovery using the Sleeping Beauty transposon. Cell Cycle. 2005;4:1744-1748. [PubMed] [DOI] |
| 13. | Huang X, Wilber AC, Bao L, Tuong D, Tolar J, Orchard PJ, Levine BL, June CH, McIvor RS, Blazar BR. Stable gene transfer and expression in human primary T cells by the Sleeping Beauty transposon system. Blood. 2006;107:483-491. [PubMed] [DOI] |
| 14. | Eisenstein M. Wake-up call for Sleeping Beauty. Nat Methods. 2005;2:637. [PubMed] [DOI] |
| 15. | Izsvak Z, Ivics Z. Sleeping Beauty hits them all: transposon-mediated saturation mutagenesis in the mouse germline. Nat Methods. 2005;2:735-736. [PubMed] [DOI] |
| 16. | Converse AD, Belur LR, Gori JL, Liu G, Amaya F, Aguilar-Cordova E, Hackett PB, McIvor RS. Counterselection and co-delivery of transposon and transposase functions for Sleeping Beauty-mediated transposition in cultured mammalian cells. Biosci Rep. 2004;24:577-594. [PubMed] [DOI] |