修回日期: 2006-05-20
接受日期: 2006-05-24
在线出版日期: 2006-07-28
目的: 通过对犬胰腺微波固化后的机体生理状态及病理改变的观察, 以期探讨微波固化应用于胰腺的可行性与安全性.
方法: 成年健康杂种犬15条, 无菌手术暴露胰腺下叶后, 利用微波探头以50 W功率, 1 cm为间距固化5点, 每点固化时间为3 min. 术后监测淀粉酶等血生化指标, 并分别于术后即刻、1 d及1 wk各处死5条. 利用HE法、NADH组织活性染色及TUNEL染色对固化中心区及固化旁组织进行病理分析.
结果: 术后即刻血淀粉酶开始升高, 术后48-72 h出现峰值, 无并发症者均于1 wk内降至正常. 术后即刻可见固化区组织呈凝固性坏死, 组织活性消失, 与周围组织分解明显. 1 d后可于固化旁组织发现大量凋亡细胞. 1 wk后固化区纤维组织增生包裹.
结论: 微波固化治疗胰腺疾病是安全可行的.
引文著录: 崔云甫, 郑宏群, 黄睿, 石炯. 利用微波固化犬胰腺的实验观察. 世界华人消化杂志 2006; 14(21): 2073-2076
Revised: May 20, 2006
Accepted: May 24, 2006
Published online: July 28, 2006
AIM: To evaluate the feasibility and safety of microwave tissue coagulation to pancreas through the observation of physiological state and pathological changes after the coagulation of canine pancreas.
METHODS: Microwave tissue coagulation of fifteen healthy mongrel dogs' pancreas was performed hrough laparotomy. The power and time were set on 50 Watt and three minutes respectively. The 5 coagulated points were selected at an interval of 1 cm. The blood amylase and other parameters were examined regularly after the operation. The dogs were killed at the instant time (n = 5), the 1st d (n = 5) and 1st wk (n = 5) after the operation. Hematoxylin and eosin (HE) staining together with nicotinamide adenine dinucleotide (NADH) and TUNEL staining was used to observe the pathological changes.
RESULTS: The level of blood amylase increased immediately after the operation and the maximal value occurred within 48-72 h. Furthermore, it returned to normal level 1 wk later if no complications occurred. The segmental microwave lesions included hyperintense zone of coagulative necrosis and peripheral hypointense zone. Apoptosis was observed at the peripheral zone 1 d after the operation. The fibrosis and tissue absorption occurred finally 1 wk after the operation.
CONCLUSION: Microwave tissue coagulation is safe and feasible, and it may be used in the treatment of pancreatic cancer at the late stage.
- Citation: Cui YF, Zheng HQ, Huang R, Shi J. Experimental study on microwave tissue coagulation of canine pancreas. Shijie Huaren Xiaohua Zazhi 2006; 14(21): 2073-2076
- URL: https://www.wjgnet.com/1009-3079/full/v14/i21/2073.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i21.2073
胰腺癌(pancreatic cancer)是常见的消化道恶性肿瘤之一, 由于其早期诊断困难, 因此预后极差, 5年生存率不足5%. 目前, 胰腺癌的有效治疗方法仍然是以外科手术为主, 放射治疗及化学治疗为辅的综合治疗. 20世纪末, 随着一系列肿瘤热疗手段的出现, 为胰腺癌的治疗提供了新的选择. 我们通过对犬胰腺微波固化后的机体生理状态及病理改变的观察, 以期探讨微波固化应用于胰腺的可行性与安全性及其价值.
成年健康杂种犬15条, 体质量16-18 kg, 雌雄不限, 由哈尔滨医科大学附属第二医院动物实验中心提供; 北京恒福微波治疗仪-Ⅰ型, 由哈尔滨鑫迪瑞科贸有限公司提供; 细胞凋亡检测试剂盒购自Sigma公司. 成年健康杂种犬随机分为术后即刻处死组(n = 5)、1 d处死组(n = 5)及1 wk处死组(n = 5).
实验动物术前12 h禁食, 以30 g/L戊巴比妥钠按1 mL/kg im麻醉. 取仰卧位, 固定四肢, 备皮及消毒后, 铺一次性无菌单. 取上腹部正中切口, 进腹后剪开大网膜, 循十二指肠确定胰腺位置, 可见犬胰腺分上、下两叶. 充分暴露胰腺下叶, 以纱布隔离周围组织, 在距离前缘5 cm, 下缘2.5 cm处为第1点, 与胰腺表面成30°角插入固化探针, 进针深度为2 cm. 设定输出功率为50 W, 时间为3 min, 以1 cm为间距依次水平固化5点, 查无活动出血后关腹. 于术后即刻(n = 5)、1 d (n = 5)及1 wk (n = 5)分别处死动物, 取出胰腺, 于距离固化穿刺点1 cm及2 cm范围内各取组织作为病理标本进行观察分析, 以未固化的胰腺上叶组织作为病理对照. 即刻处死的犬胰腺标本行HE及NADH组织活性染色, 利用图文分析软件进行分析, 计算NADH染色阳性指数(阳性指数 = 阳性染色面积/总面积); 1 d处死的犬胰腺标本行HE及TUNEL染色, 以细胞出现棕色颗粒为阳性, 并计算每高倍视野阳性细胞数; 其余标本仅行HE染色. 1 wk处死组需观察动物的一般生存状态, 如饮食、排便等, 并于术前、术后即刻及此后每12 h抽血监测血淀粉酶.
统计学处理 利用SAS软件进行两个独立样本的秩和检验分析.
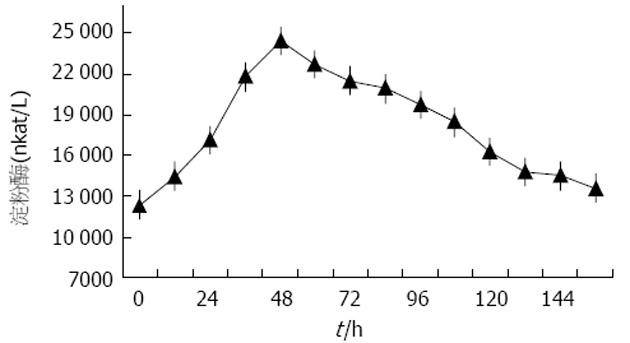
固化开始后, 见胰腺组织开始肿胀, 颜色变灰, 失去光泽, 且范围逐渐扩大. 至3 min时, 关闭电源, 结束固化. 退出固化探头, 尖端无坏死组织黏着, 穿刺孔无出血及胰液渗漏. 所有动物单点固化半径为1.74±0.10 cm, 固化面积为26.07±2.29 cm2. 1 wk处死组动物麻醉清醒后, 出现拒食, 喜饮水. 4只动物于术后3 d起逐步恢复正常饮食及排便, 且生存良好. 1只至处死时始终未恢复正常饮食, 且体质量明显减轻, 解剖于胰腺体尾部发现包裹性积液, 内容浑浊且有腥臭味, 考虑为胰瘘所致. 1 wk处死组术前所测血淀粉酶值为12 362±751 nkat/L, 术后即刻血淀粉酶开始升高, 峰值出现于术后48-72 h, 为24 433±772 nkat/L, 其中4只动物血淀粉酶随后缓慢下降, 1 wk后基本恢复正常(图1). 1只动物血淀粉酶于20 004-23 338 nkat/L间波动, 处死后解剖证实为胰瘘所致.
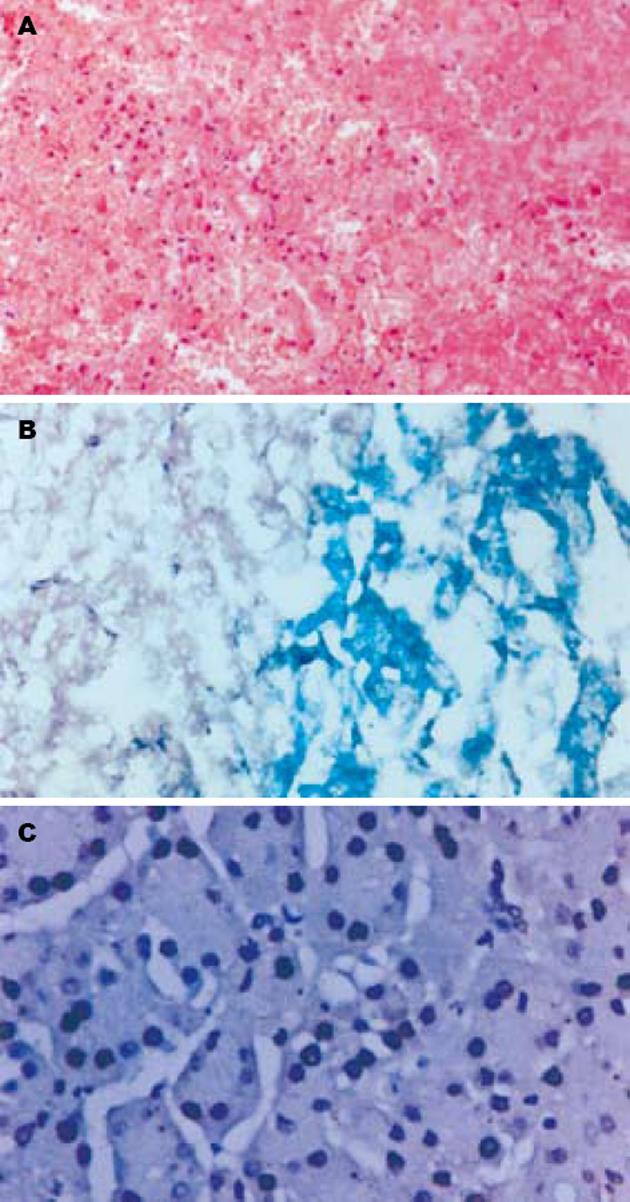
术后即刻, 距固化中心1 cm范围内, 可见大片凝固性坏死(图2A), 细胞核呈固缩、破裂或溶解. 2 cm范围内除坏死细胞外, 可见部分细胞水肿, 且有微小出血灶. 1 d后观察, 1 cm范围内的病理变化与即刻基本相同, 2 cm范围内出现炎症反应区, 并伴有中性粒细胞浸润. 1 wk后观察, 固化区部分纤维化, 成纤维细胞及脂肪细胞增多, 并有毛细血管增生.
术后即刻行NADH组织活性染色, 有活性组织表现为蓝紫色, 无活性组织表现为绿色(图2B). 正常组织平均阳性指数为0.860±0.026, 距固化中心1 cm范围内平均阳性指数为0.035±0.015, 距固化中心2 cm范围内平均阳性指数为0.630±0.055.
固化后, 凝固性坏死区周边组织阳性染色细胞数较正常对照胰腺组织明显增加(图2C). 正常对照胰腺组织每高倍视野阳性细胞数为3.60±0.53, 凝固性坏死区周边组织每高倍视野阳性细胞数为18.20±1.75, 二者有显著差异(u = 6.8598, P = 0.0088).
胰腺癌是常见的消化道恶性肿瘤之一, 由于其早期诊断困难, 大部分患者就诊时已属晚期, 所以其预后极差, 5年生存率不足5%, 有85%的患者在诊断后12 mo内死亡[1]. 尽管胰腺癌的诊断和治疗技术已经有了一定程度的进步, 但根据对美国国立癌症数据库(National Cancer Database) 1985-1995年100 313例胰腺癌患者的数据调查得出的结论: 近20年来, 胰腺癌的总体生存率并没有改变[2]. 热疗是上世纪末兴起的治疗肿瘤的新方法, 其疗效已经被大家公认[3-10], 因此也为胰腺癌姑息性治疗提供了新的选择. 微波固化是近年来出现的治疗实体肿瘤的新的热疗手段, 其利用探头将微波能量集中在一个区域, 使组织细胞内的带点粒子高速振荡, 产生热量. 致局部组织温度达到65-100℃, 从而起到杀灭肿瘤细胞的目的. 还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide, NADH)是细胞呼吸链中的关键物质, 其活性的存在与否可以直接代表细胞活性的有无, 故NADH组织活性染色阴性代表了组织细胞已经发生了不可逆转的坏死变化. 传统的HE染色通过对细胞形态的观察判断细胞的活性, 因此有时难以评定肿瘤热疗后某些区域的坏死程度. 而NADH组织活性染色后, 可见坏死区与非坏死区对比明显, 界限清晰, 且可以利用图文软件将不同区域的组织染色结果量化, 使结果更加客观. 因此, NADH组织活性染色可以作为即刻评价热疗后肿瘤组织坏死程度的方法[11-14].
细胞凋亡(cell apoptosis)的概念是Kerr在1972年最先提出[15]. 他是细胞生命周期中的重要组成部分, 与胚胎发育、组织发生、组织分化、组织修复、内环境的稳定、细胞癌变等过程有紧密的联系. 与细胞坏死不同的是, 他是受基因控制的细胞死亡形式[16]. 许多因素可诱导凋亡或抑制凋亡, 如激素、细胞因子、抗体、超抗原、黏附分子、免疫细胞、化疗药物、致癌药、生长因子缺失、高温、放射线等. 细胞凋亡中, 染色体DNA双链断裂或单链断裂而产生大量的黏性3'-OH末端, 可在脱氧核糖核苷酸末端转移酶(TdT)的作用下, 将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'-末端, 从而可进行凋亡细胞的检测, 这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal-deoxynucleotidyl transferase mediated nick end labeling, TUNEL).
我们发现, 胰腺组织固化后循凝固性坏死-急性炎症反应-机化-纤维包裹-吸收的过程发展[17-18]. 固化早期, 在凝固性坏死区周边可出现炎症反应带, 而本实验利用TUNEL法检测, 结果显示该区域凋亡细胞明显增多. 咎其原因, 可能有以下两个方面: 一是微波固化产生的局部高温虽不能使此区域的细胞即刻坏死, 但可以在细胞、亚细胞和分子水平上产生一系列变化导致细胞膜通透性增加, 酶活性下降, 分裂指数下降, DNA合成抑制以及染色体断裂等, 导致细胞在固化后的一段时间内死亡. 这种变化在组织固化12 h后在固化边缘区域持续存在, 可能对病变的局部控制有利[19]. 二是此区域浸润的炎症细胞释放的细胞因子作用于细胞, 使其走向凋亡. 因此, 微波固化并非仅仅是短时间的高温作用, 其可能在治疗后的一段时间内仍发挥着治疗作用. 此外, 国内尚有直接利用"凋亡温度"达到减瘤效果, 治疗胰腺癌的临床报道[20]. 胰腺肿瘤热疗后, 血淀粉酶仍然是治疗后临床监测的重要生化指标, 并对判断是否出现并发症有重要的指导作用. 通过对血淀粉酶检测结果进行统计分析发现, 无并发症的动物的血淀粉酶术后呈现单峰状变化, 其峰值出现于术后72 h以内, 并于1 wk时基本恢复正常. 因此, 在胰腺肿瘤热疗后的临床观察过程中, 对于那些血淀粉酶持续升高不降或下降后短期内又升高者, 更应提高警惕, 及时发现并发症的存在, 以免导致不良后果. 微波固化应用于胰腺尚处于探索阶段, 相信随着技术设备以及操作方法的日趋成熟, 微波固化将成为胰腺肿瘤安全可行且有效的治疗方法.
热疗是近年来新兴的一种肿瘤局部治疗手段, 其疗效得到初步认可. 微波固化作为一种新的热疗手段, 其在胰腺的应用属于起步阶段, 因此也成为基础及临床研究的热点.
本实验采用固化后连续监测淀粉酶, 并描绘淀粉酶变化曲线的方法, 突破了以往单一时间点观察的局限. 另外, 本实验采用的病理染色方法较丰富, 从不同角度观察病理变化, 也是实验创新之一.
本实验通过对胰腺微波固化后犬的生理及病理变化的观察, 得出该治疗方法针对胰腺是安全有效的, 为其临床应用奠定理论基础. 如进一步进行临床研究将会有深远的社会经济效益.
本文针对晚期胰腺癌积极选择微波固化作为综合疗法的辅助措施, 是该实验明确的目的所在. 文章实验方法先进, 结果计算准确, 讨论深刻, 具有一定的学术水平, 对临床应用有参考价值.
电编: 张敏 编辑:潘伯荣
| 1. | Friess H, Liao Q, Zhao YP, Büchler MW. Surgical treatment for pancreatic cancer. Chin J Hepatobiliary Surg. 2002;8:515-523. |
| 2. | Sener SF, Fremgen A, Menck HR, Winchester DP. Pancreatic cancer: a report of treatment and survival trends for 100,313 patients diagnosed from 1985-1995, using the National Cancer Database. J Am Coll Surg. 1999;189:1-7. [PubMed] [DOI] |
| 3. | Vogl TJ, Mack M, Eichler K, Lehnert T, Nabil M. Effect of laser-induced thermotherapy on liver metastases. Expert Rev Anticancer Ther. 2006;6:769-774. [PubMed] [DOI] |
| 4. | Sutherland LM, Williams JA, Padbury RT, Gotley DC, Stokes B, Maddern GJ. Radiofrequency ablation of liver tumors: a systematic review. Arch Surg. 2006;141:181-190. [PubMed] [DOI] |
| 5. | Ohguri T, Imada H, Kato F, Yahara K, Morioka T, Nakano K, Korogi Y. Radiotherapy with 8 MHz radiofrequency-capacitive regional hyperthermia for pain relief of unresectable and recurrent colorectal cancer. Int J Hyperthermia. 2006;22:1-14. [PubMed] [DOI] |
| 6. | Haemmerich D, Laeseke PF. Thermal tumour ablation: devices, clinical applications and future directions. Int J Hyperthermia. 2005;21:755-760. [PubMed] [DOI] |
| 7. | Gannon CJ, Curley SA. The role of focal liver ablation in the treatment of unresectable primary and secondary malignant liver tumors. Semin Radiat Oncol. 2005;15:265-272. [PubMed] [DOI] |
| 8. | Wu F, Wang ZB, Zhu H, Chen WZ, Zou JZ, Bai J, Li KQ, Jin CB, Xie FL, Su HB. Feasibility of US-guided high-intensity focused ultrasound treatment in patients with advanced pancreatic cancer: initial experience. Radiology. 2005;236:1034-1040. [PubMed] [DOI] |
| 9. | Wu F, Wang ZB, Zhu H, Chen WZ, Zou JZ, Bai J, Li KQ, Jin CB, Xie FL, Su HB. Extracorporeal high intensity focused ultrasound treatment for patients with breast cancer. Breast Cancer Res Treat. 2005;92:51-60. [PubMed] [DOI] |
| 10. | Li CX, Xu GL, Jiang ZY, Li JJ, Luo GY, Shan HB, Zhang R, Li Y. Analysis of clinical effect of high-intensity focused ultrasound on liver cancer. World J Gastroenterol. 2004;10:2201-2204. [PubMed] |
| 11. | Scudamore CH, Lee SI, Patterson EJ, Buczkowski AK, July LV, Chung SW, Buckley AR, Ho SG, Owen DA. Radiofrequency ablation followed by resection of malignant liver tumors. Am J Surg. 1999;177:411-417. [PubMed] [DOI] |
| 12. | Patterson EJ, Scudamore CH, Owen DA, Nagy AG, Buczkowski AK. Radiofrequency ablation of porcine liver in vivo: effects of blood flow and treatment time on lesion size. Ann Surg. 1998;227:559-565. [PubMed] [DOI] |
| 13. | Hansen PD, Rogers S, Corless CL, Swanstrom LL, Siperstien AE. Radiofrequency ablation lesions in a pig liver model. J Surg Res. 1999;87:114-121. [PubMed] [DOI] |
| 14. | Jeffrey SS, Birdwell RL, Ikeda DM, Daniel BL, Nowels KW, Dirbas FM, Griffey SM. Radiofrequen-cy ablation of breast cancer: first report of an emerg-ing technology. Arch Surg. 1999;134:1064-1068. [PubMed] [DOI] |
| 15. | O'Rourke MG, Ellem KA. John Kerr and apoptosis. Med J Aust. 2000;173:616-617. [PubMed] |
| 16. | Formigli L, Conti A, Lippi D. "Falling leaves": a survey of the history of apoptosis. Minerva Med. 2004;95:159-164. [PubMed] |
| 17. | Merkle EM, Haaga JR, Duerk JL, Jacobs GH, Brambs HJ, Lewin JS. MR imaging-guided radio-frequency thermal ablation in the pancreas in a porcine model with a modified clinical C-arm system. Radiology. 1999;213:461-467. [PubMed] [DOI] |
| 19. | Ohno T, Kawano K, Sasaki A, Aramaki M, Yoshida T, Kitano S. Expansion of an ablated site and induction of apoptosis after microwave coagulation therapy in rat liver. J Hepatobiliary Pancreat Surg. 2001;8:360-366. [PubMed] [DOI] |