修回日期: 2006-05-20
接受日期: 2006-05-22
在线出版日期: 2006-07-28
目的: 观察银杏叶提取物(GBE)对大鼠肝纤维化的防治效果及其机制.
方法: ♂SD大鼠30只随机分为3组: 正常对照组(n = 10)、模型组(n = 10)及GBE干预组(n = 10), 模型组及GBE干预组给予500 mL/L CCl4 ip, 1 mL/kg, 每周2次, 共8 wk, 干预组每天同时给予GBE灌胃, 0.4 g/kg. 实验结束后, 心脏取血分离血清行肝功能生化指标检测, 处死动物取肝脏液氮冻存及甲醛固定, 常规行HE染色, 免疫组化检测Activin A, RT-PCR检测Activin A mRNA的表达, TUNEL法检测肝细胞凋亡.
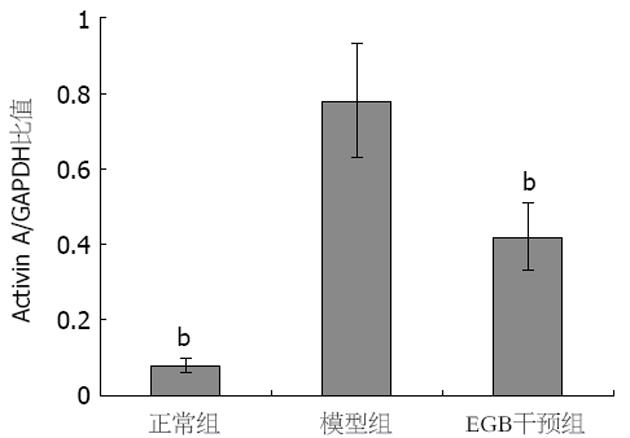
结果: 光镜下组织学检查纤维化分级GBE干预组低于模型组(P<0.05), 肝功能生化指标检测GBE干预组优于模型组(分别为ALT: 2806.9±576.1 nkat/L vs 4452.9±709.5 nkat/L; AST: 5314.2±1042 nkat/L vs 15 743.4±625.8 nkat/L; ALB: 31.0±2.1 g/L vs 21.7±1.8 g/L; P均<0.05), 免疫组化和RT-PCR检测Activin A的表达GBE干预组低于模型组(免疫组化: 4.2±0.8 vs 11.4±1.2; RT-PCR: 0.42±0.09 vs 0.78±0.15; P均<0.01), 凋亡指数(AI) GBE干预组低于模型组(7.56±3.36 vs 16.06±8.84, P<0.01).
结论: GBE对CCl4诱导的大鼠肝纤维化有良好的防治作用, 其作用机制可能与肝组织Activin A表达降低及肝细胞凋亡减少有关.
引文著录: 时昭红, 刘浩, 刘嵩, 张介眉, 涂晋文. 银杏叶提取物抗大鼠肝纤维化中激活素A和肝细胞凋亡的作用. 世界华人消化杂志 2006; 14(21): 2060-2066
Revised: May 20, 2006
Accepted: May 22, 2006
Published online: July 28, 2006
AIM: To investigate the effects of Ginkgo biloba extract (GBE) on CCl4-induced liver fibrosis as well as the underlying mechanisms.
METHODS: Thirty adult male Sprague Dawley rats were randomized into 3 groups: control group (n = 10), model group (n = 10) and treatment group (n = 10). Except the rats in the control group, the others were intraperitoneally injected with 500 mL/L CCl4 (1 mL/kg) to induce liver cirrhosis (twice a week, for 8 weeks). Moreover, the rats in treatment group were intragastrically administered with GBE (0.4 g/kg) for 8 weeks. At the end of the 8th week, all the rats were sacrificed. Blood samples were collected for the determination of biochemical indicators. Tissue samples were used for histopathological examinations. The expression of activin A was determined by immunohistochemistry and reverse transcription-polymerase chain reaction (RT-PCR). Hepatocellular apoptosis was determined by the method of terminal deoxynucleotidyl transferase mediated dUTP nick end labeling (TUNEL) method.
RESULTS: The grade of liver fibrosis in treatment group was lower than that in the model group (P < 0.05). The serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST) and albumin (ALB) in treatment group were significantly improved as compared with those in the model group (ALT: 2806.9 ±576.1 nkat/L vs 4452.9 ± 709.5 nkat/L; AST: 5314.2 ± 1042 nkat/L vs 15 743.4 ± 625.8 nkat/L; ALB: 31.0 ± 2.1 g/L vs 21.7 ± 1.8 g/L; all P < 0.05). GBE treatment markedly reduced mRNA and protein levels of activin A (mRNA: 0.42 ± 0.09 vs 0.78 ± 0.15; protein: 4.2 ± 0.8 vs 11.4 ± 1.2; both P < 0.01). In comparison with that in the model group, the apoptosis index was decreased in treatment groups (7.56 ± 3.36 vs 16.06 ± 8.84, P < 0.01).
CONCLUSION: GBE can markedly attenuate the degrees of hepatic fibrosis, and the mechanism may be correlated with the expression of activin A and hepatocellular apoptosis.
- Citation: Shi ZH, Liu H, Liu S, Zhang JM, Tu JW. Roles of activin A and hepatocellular apoptosis in the anti-liver fibrosis process induced by Ginkgo biloba extract in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(21): 2060-2066
- URL: https://www.wjgnet.com/1009-3079/full/v14/i21/2060.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i21.2060
银杏叶提取物(Ginkgo biloba extract, GBE)是一种用途广泛、无不良反应的天然物质, 主要成分为银杏黄酮甙和萜类, 其药理作用有改善心肌缺血、脑组织血液供应、清除氧自由基、抗血小板活化因子等. 临床上用GBE治疗冠心病心绞痛、脑缺血、脑老化、老年性痴呆、脑功能不全、哮喘等, 已收到满意的效果[1-5]. 目前, 亦有大量的研究表明其在慢性肝损伤、肝纤维化过程中也具有保护预防作用[6-10]. 我们通过四氯化碳(CCl4)诱导大鼠肝纤维化模型, 同时用银杏叶提取物进行干预, 观察实验过程中细胞因子激活素A (Activin A)表达及肝细胞凋亡的变化, 研究银杏叶提取物预防大鼠肝纤维化的作用机制, 为临床合理应用银杏叶提取物提供参考依据.
SPF级♂SD大鼠30只(160±20 g), 购于武汉大学实验动物中心; GBE由武汉市第一医院中药制剂室提供, 经湖北午时药业股份有限公司检验, 编号02-391; 四氯化碳为郑州化学试剂二厂产品; Activin A mAb购自美国R&D公司; SP试剂盒为北京中杉金桥生物技术有限公司产品; TUNEL法凋亡试剂盒购自武汉博士德生物制剂有限公司; Trizol试剂购自Invitrogen公司, 逆转录酶为Promega公司产品, Taq DNA聚合酶购自Biostar公司, RNA酶抑制剂和100 bp DNA Ladder购自华美生物工程公司, 焦磷酸乙二脂(DEPC)、琼脂糖为Sigma公司产品; 引物由上海生工生物公司合成, 大鼠Activin A上游引物: 5'GGACCTAACTCTCAGCCAGAGATG3', 下游引物: 5'TCTCAAAATGCAGTGTCTTCCTGG3', 全长280 bp; 大鼠GAPDH上游引物: 5'CATGACCACAGTCCATGCCATC3', 下游引物: 5'CACCCTGTTGCTGTAGCCATATTC3', 全长450 bp; HPIAAS-2000彩色图文分析系统; Biometra PCR仪; Bio-rad凝胶图像分析系统; Eppendoff低温离心机; 721分光光度仪; HW-8B型超级微量恒温器等.
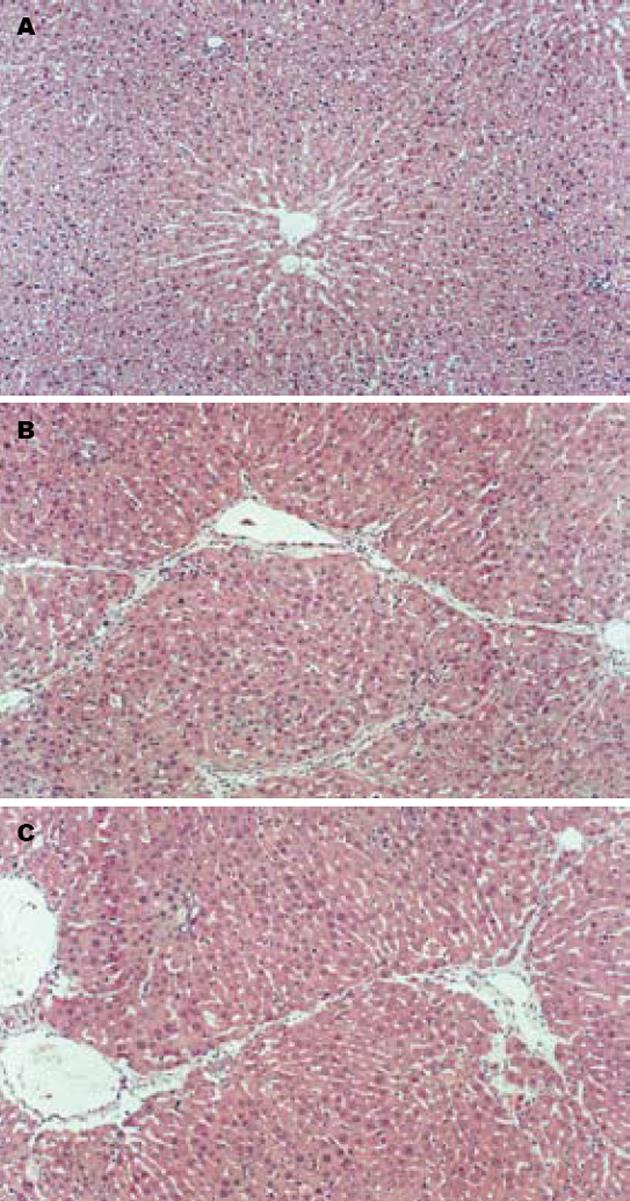
将30只♂SD大鼠随机分为3组, 正常组(10只)、模型组(10只)、GBE干预组(10只), 组间暴露无差异. 大鼠肝纤维化模型制备方法为首次应用纯CCl4(分析纯)ip, 剂量为3 mL/kg, 后改为500 mL/L CCl4 ip, 剂量为1 mL/kg, 2次/wk, 共8 wk. 模型组在造模的同时给予生理盐水灌胃, 1次/d; GBE干预组在造模的同时给予银杏叶制剂悬浊液按每只0.3 g/kg的剂量灌胃, 1次/d; 正常组只用生理盐水ip和灌胃, 处理方法同上. 造模过程中, 模型组死亡1只大鼠, 实验总周数为8 wk, 大鼠处死前禁食24 h, 处死时, 大鼠乙醚麻醉, 迅速从心脏取血, 分离血清, -20℃保存. 然后处死动物, 迅速切取肝脏标本置于冰盐水中充分洗涤, 取右叶相同的部分以40 g/L福尔马林固定, 3 d内石蜡包埋备组织病理检测; 余下肝脏于液氮中速冻、-80℃冰箱内保存, 备肝组织匀浆抽提RNA. 将固定好的肝组织石蜡包埋切片, 常规行HE染色, 光镜下观察. HE染色由同一病理专科医生予以纤维化分级, 分级标准根据其纤维化程度分为0-4级. 0级: 无纤维化; 1级: 纤维结缔组织仅局限于汇管区或汇管区扩大, 有向小叶发展的倾向; 2级: 纤维结缔组织增生进入肝小叶2/3及有1级同样的改变; 3级: 纤维结缔组织进入肝小叶中央静脉周围; 4级: 纤维结缔组织在肝小叶呈多处弥漫性增生, 有假小叶形成, 并有3级同样的改变. 取大鼠血液, 3000 r/min离心10 min, 取血清, -20℃保存, 送检验科以CX全自动生化分析仪(美国Backman公司产品)检测肝功能指标: 谷丙转氨酶(ALT)、谷草转氨酶(AST)和白蛋白(ALB).
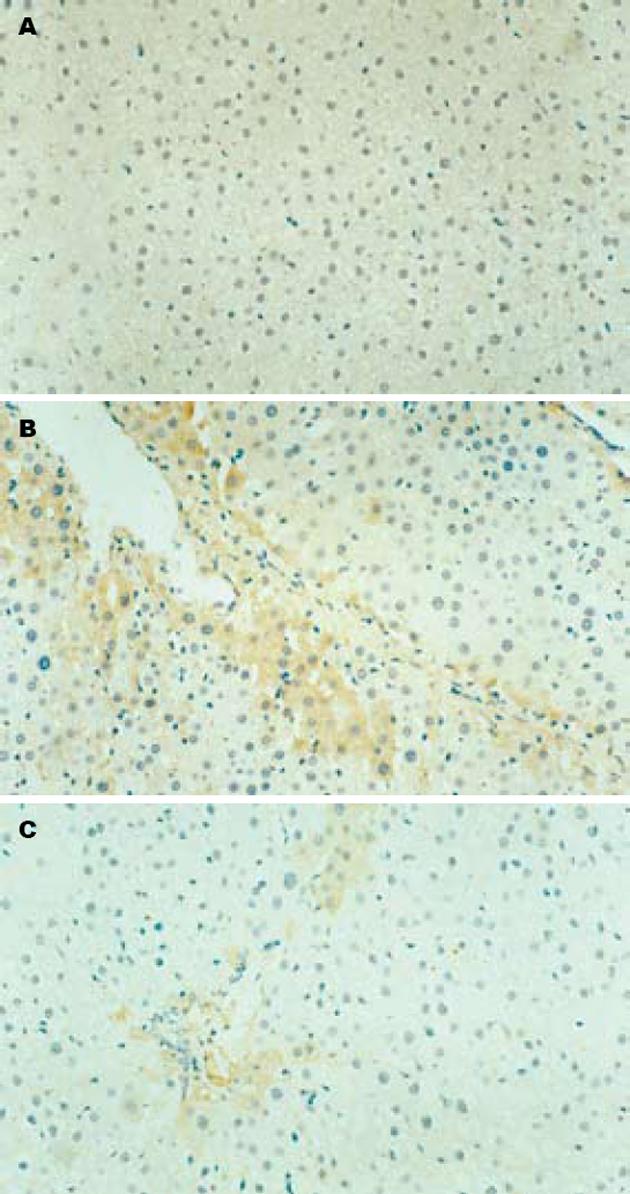
1.2.1 免疫组织化学检查: 采用石蜡包埋常规切片, SP法, Activin A mAb以1∶100稀释, DAB显色, 苏木素复染. PBS代替一抗作为阴性对照. 显色结果采用HPIAS-2000型多媒体彩色图像分析系统对染色阳性部位进行光密度值测定. 通过显微摄像系统放大200倍, 在每张切片上随机选取3个视野, 以胞质内出现棕色颗粒为Activin A阳性表达, 测定其平均光密度值(MOD)、阳性区域面积百分比.
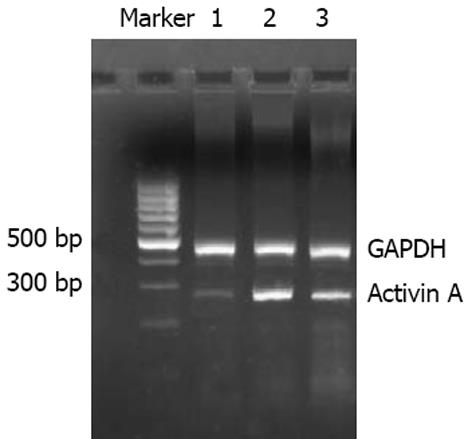
1.2.2 RT-PCR: 称取肝组织50-100 mg用Trizol提取总RNA, 采用分光光度法测定其含量及纯度, 测定A260/A280值. 取总RNA 2 µg, 42℃逆转录90 min. 参数设置94℃变性, 3 min×1循环. 94℃变性30 s, 53℃退火30 s, 72℃延伸45 s, 共35个循环. 最后72℃彻底延伸7 min×1循环, 同法扩增GAPDH作为内参照. 取5 µL PCR产物15 g/L琼脂糖凝胶电泳. 凝胶图像分析系统检测灰度, Activin A/GAPDH比值表示Activin A mRNA相对水平.
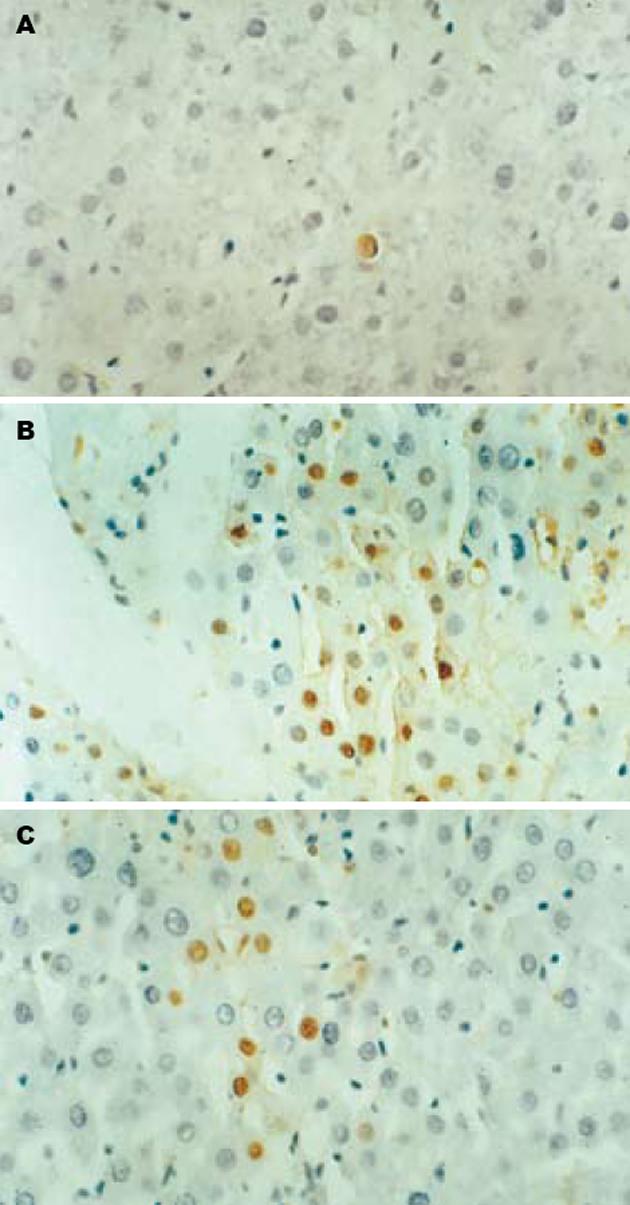
1.2.3 细胞凋亡原位检测: 采用TUNEL法, 严格按试剂盒说明书进行操作, 以不加末端脱氧核酸转移酶(TdT)作为阴性对照. 光镜下观察, 胞核染成棕黄色为阳性细胞. 观察不少于5个高倍视野(400倍), 以平均每100个细胞核中含凋亡细胞个数作为凋亡指数(AI).
统计学处理 处理结果计量资料用mean±SD表示, SPSS10.0软件进行配对t检验, 纤维化计数资料采用Ridit分析.
肝脏HE染色显示, 正常大鼠可见少量胶原着色, 病理模型组肝小叶结构破坏, 纤维组织增生明显, 将肝小叶分隔成大小不等的肝细胞团, 肝细胞广泛变性坏死, 汇管区扩大、胶原沉积. GBE干预组肝细胞有不同程度的变性坏死, 汇管区及小叶间有少量纤维组织增生, 纤维间隔细小, 与模型组比较差异显著. 统计分析, GBE干预组较模型组纤维化程度轻(P<0.05, 图1, 表1). 模型组ALT、AST显著升高, ALB显著降低; GBE干预组ALT, AST较模型组明显降低, ALB则显著升高(表1).
正常组肝组织中几乎不表达Activin A, 模型组Activin A阳性表达主要位于中央小叶和门静脉周围肝细胞中, 并在Kuffer细胞、类间质细胞质及其周围也可见其表达, GBE干预组阳性染色程度均较模型组明显减轻(P<0.01, 表1, 图2).
正常组大鼠肝组织中偶见凋亡细胞, 模型组大鼠肝组织的凋亡细胞多分布在肝实质中, 胞核呈棕黄色, 镜下视野可见广泛肝细胞凋亡, GBE干预组凋亡肝细胞数目显著减少, 各组间肝细胞AI差异有显著性(P<0.01或P<0.05, 表1, 图3).
肝纤维化是慢性肝病重要的病理特征, 也是进一步向肝硬化发展的主要中间环节. 其发生、发展是一个非常复杂的过程, 具体机制目前还不十分明了. 但可以肯定的是, 肝纤维化是慢性肝损伤引起肝脏代谢和细胞间相互作用紊乱的结果[11-12]. 无论何种原因引起的慢性肝病, 其特征为: 肝实质细胞的慢性炎症和慢性坏死以及细胞间基质的数量和质量的变化从而引起细胞间质的沉积. 肝纤维化过程中在细胞水平上可能涉及肝星状细胞(hepatic stellate cell, HSC)、Kupffer细胞、巨噬细胞的活化; 在分子水平上, 他与生长因子、细胞因子、化学因子、细胞间质生成和沉积的改变有关[13-16]. 近年来, GBE普遍应用于临床, 其主要药理作用为抗氧化, 在心、脑血管疾病中研究较多. GBE具有很强的抗氧自由基、增强抗氧化酶活性的作用, 还可抑制血小板抑制因子, 改善微循环等, 对心、脑血管缺血性损伤有明显的保护作用. GBE还能明显的抗氧化和抗脂质过氧化, 减少氧自由基对ATP酶的攻击, 增强中枢神经系统功能、调节神经递质和激素的水平等[2-3,5]. 此外, Daba et al研究表明GBE可通过抑制脂质过氧化而对博莱霉素(bleomycin)诱导的肺纤维化具有保护作用[17], 而国内的研究亦显示GBE能使肺间质纤维化减轻[18]. 在肝脏方面, 研究显示, GBE对肝窦状内皮细胞具有保护作用[6], 可以改善慢性肝损伤后的微循环紊乱[6-7]. 我们前期的研究也表明, GBE对实验性大鼠慢性肝损伤、肝纤维化具有保护作用[8-10]. 我们利用CCl4诱导实验性肝纤维化模型, 同时应用GBE进行干预, 结果显示, 造模8 wk后模型组肝细胞广泛变性坏死, 纤维组织增生明显, 将肝小叶分隔成大小不等的肝细胞团, 表示造模成功. 而GBE干预组仅汇管区及小叶间有少量纤维组织增生, 纤维间隔细小, 与模型组相比差异显著. 并且, GBE干预组ALT, AST等各项肝功能指标也明显优于模型组. 这说明GBE对实验性大鼠肝纤维化具有预防和抑制作用, 结果与以前的研究相一致.
Activin是转化生长因子超家族成员, 是近年来发现的一组重要细胞因子. 他具有广泛的生物学活性, 如在动物胚胎中诱导中胚层和前后极性分化, 在动物和人体内刺激多种细胞分化等. Activin是由2个β亚基构成的二聚体糖蛋白, 目前已知有5种β亚基, 其分别为βA, βB, βC, βD和βE. 在正常肝脏实质细胞中5种β亚基均有表达, 其中βA和βB亚基的表达是肝脏维持生理功能所必须的, 另外3种β亚基在肝脏中的作用尚不很清楚. 按照亚基结合的方式, 可分为Activin A (βAβA)、Activin B (βBβB)和Activin AB (βAβB). 目前对Activin A的研究比较多. 研究表明, Activin作用不仅限于性腺, 而且在组织细胞生长分化、骨形成、胚胎发育、免疫调节、组织损伤修复及炎症反应过程中均发挥了重要作用[19-21]. 近年研究显示, Activin A与肝脏病变有密切的关系. 在慢性病毒性肝炎患者血清中Activin A比正常对照组患者明显升高[22]; 亦有学者发现肝硬化及肝细胞癌患者血清Activin A水平升高, 且后者升高更为明显[23], 提示发生硬化的肝脏和肝脏肿瘤可能部分有Activin A的参与. 在实验性肝纤维化方面, 研究证实, 不同方式诱导的大鼠肝纤维化都有肝脏Activin A的表达增强[24-26]. 而在急性肝损伤时, 研究亦表明Activin A表达增强, 对HSC分泌纤维具有调节作用[27]. 总之大量研究证明, Activin A是肝脏再生过程中的负向调节因子. 肝细胞产生的Activin A, 通过自分泌和旁分泌方式, 抑制肝细胞DNA合成, 诱导肝细胞凋亡[28-32], 促进HSC和成纤维细胞分泌Ⅰ型胶原[27,33].
凋亡是肝实质和间质细胞死亡的最主要形式, 肝细胞增殖和凋亡失去平衡, 肝脏再生异常, 导致慢性肝炎、肝硬化和肝癌等病变的发生. 目前的研究表明, 细胞凋亡在肝纤维化的形成和发展中发挥着重要的作用, 而肝细胞凋亡更是在肝纤维化的进展过程中具有促进作用[13-14]. Activin A与肝细胞凋亡的关系为我们理解肝纤维化的形成提供了新的思路. 慢性肝损伤过程中, 炎性因子刺激Activin A在肝脏表达增多, 肝细胞凋亡也随之增多, 从而促进形成肝纤维化甚至肝硬化[26]. 本实验模型组造模8 wk后, 大鼠肝纤维化形成, 免疫组化和RT-PCR显示肝脏中Activin A表达明显增强, 肝细胞凋亡也明显增加, 和以上研究结果相一致. 而在GBE干预组, 大鼠肝脏中Activin A表达较模型组减弱, 肝细胞凋亡数量较模型组减少, 大鼠肝纤维化程度也较模型组明显为轻. 这说明, GBE抗大鼠肝纤维化的作用可能与肝组织Activin A表达及肝细胞凋亡有关, GBE干预使肝纤维化大鼠Activin A表达减少从而减少肝细胞凋亡可能是其机制之一.
肝纤维化是一切慢性肝病的重要病理特征, 也是进一步向肝硬化发展的主要中间环节. 肝脏慢性病变如寄生虫感染、病毒感染、免疫源性肝炎、遗传性金属超负荷、毒性作用等均可引起肝纤维化. 我国是乙型病毒性肝炎高发区, 肝炎后肝硬化发病率高; 随着生活条件的改善, 酒精性肝硬化的发病率也逐年增高. 因此对肝纤维化防治的研究引起了越来越多医务工作者的关注, 探讨肝纤维化的发生机制、寻找高效的肝纤维化防治方法已迫在眉睫.
激活素(Activin)是转化生长因子超家族成员, 是近年来发现的一组重要细胞因子, 目前对激活素A(ActivinA)的研究比较多. 近年研究显示, 激活素A与肝脏病变有密切的关系, 是肝脏再生过程中的负向调节因子. 肝细胞产生的激活素A, 通过自分泌和旁分泌方式, 抑制肝细胞DNA合成, 诱导肝细胞凋亡, 促进肝纤维化的形成.
本文探讨激活素A和肝细胞凋亡在银杏叶提取物抗大鼠肝纤维化中的作用, 结构完整, 立题思路清晰, 采用的研究方法可靠、丰富, 具有较高理论水平.
电编: 张敏 编辑:潘伯荣
| 1. | Gertz HJ, Kiefer M. Review about Ginkgo biloba special extract GBE 761 (Ginkgo). Curr Pharm Des. 2004;10:261-264. [PubMed] [DOI] |
| 2. | McKenna DJ, Jones K, Hughes K. Efficacy, safety, and use of ginkgo biloba in clinical and preclinical applications. Altern Ther Health Med. 2001;7:70-86, 88-90. [PubMed] |
| 3. | DeFeudis FV. A brief history of GBE 761 and its therapeutic uses. Pharmacopsychiatry. 2003;36 Suppl 1:S2-7. [PubMed] [DOI] |
| 4. | Smith JV, Luo Y. Studies on molecular mechanisms of Ginkgo biloba extract. Appl Microbiol Biotechnol. 2004;64:465-472. [PubMed] [DOI] |
| 5. | Diamond BJ, Shiflett SC, Feiwel N, Matheis RJ, Noskin O, Richards JA, Schoenberger NE. Ginkgo biloba extract: mechanisms and clinical indications. Arch Phys Med Rehabil. 2000;81:668-678. [PubMed] [DOI] |
| 6. | Zhang C, Zu J, Shi H, Liu J, Qin C. The effect of Ginkgo biloba extract (GBE 761) on hepatic sinusoidal endothelial cells and hepatic microcircu-lation in CCl4 rats. Am J Chin Med. 2004;32:21-31. [PubMed] [DOI] |
| 7. | Topp S, Knoefel WT, Schutte A, Brilloff S, Rogiers X, Gundlach M. Ginkgo biloba (GBE 761) improves microcirculation after warm ischemia of the rat liver. Transplant Proc. 2001;33:979-981. [PubMed] [DOI] |
| 8. | Luo YJ, Yu JP, Shi ZH, Wang L. Ginkgo biloba extract reverses CCl4-induced liver fibrosis in rats. World J Gastroenterol. 2004;10:1037-1042. [PubMed] |
| 11. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 12. | Hoek JB, Pastorino JG. Ethanol, oxidative stress, and cytokine-induced liver cell injury. Alcohol. 2002;27:63-68. [PubMed] [DOI] |
| 13. | Albanis E, Friedman SL. Hepatic fibrosis. Pathoge-nesis and principles of therapy. Clin Liver Dis. 2001;5:315-334. [PubMed] [DOI] |
| 14. | Lamireau T, Desmouliere A, Bioulac-Sage P, Rosenbaum J. Mechanisms of hepatic fibrogenesis. Arch Pediatr. 2002;9:392-405. [PubMed] [DOI] |
| 15. | Kanzler S, Lohse AW, Keil A, Henninger J, Dienes HP, Schirmacher P, Rose-John S, zum Buschenfelde KH, Blessing M. TGF-beta1 in liver fibrosis: an inducible transgenic mouse model to study liver fibrogenesis. Am J Physiol. 1999;276:G1059-1068. [PubMed] |
| 16. | Wang XZ, Zhang LJ, Li D, Huang YH, Chen ZX, Li B. Effects of transmitters and interleukin-10 on rat hepatic fibrosis induced by CCl4. World J Gastroenterol. 2003;9:539-543. [PubMed] [DOI] |
| 17. | Daba MH, Abdel-Aziz AA, Moustafa AM, Al-Majed AA, Al-Shabanah OA, El-Kashef HA. Effects of L-carnitine and ginkgo biloba extract (EG b 761) in experimental bleomycin-induced lung fibrosis. Pharmacol Res. 2002;45:461-467. [PubMed] [DOI] |
| 19. | Woodruff TK. Regulation of cellular and system function by activin. Biochem Pharmacol. 1998;55:953-963. [PubMed] [DOI] |
| 20. | Luisi S, Florio P, Reis FM, Petraglia F. Expression and secretion of activin A: possible physiological and clinical implications. Eur J Endocrinol. 2001;145:225-236. [PubMed] [DOI] |
| 21. | Naumnik B, Borawski J, Mysliwiec M. Activin A-follistatin: new cytokines, new perspectives. Pol Arch Med Wewn. 2003;109:431-435. [PubMed] |
| 22. | Patella S, Phillips DJ, de Kretser DM, Evans LW, Groome NP, Sievert W. Characterization of serum activin-A and follistatin and their relation to virological and histological determinants in chronic viral hepatitis. J Hepatol. 2001;34:576-583. [PubMed] [DOI] |
| 23. | Pirisi M, Fabris C, Luisi S, Santuz M, Toniutto P, Vitulli D, Federico E, Del Forno M, Mattiuzzo M, Branca B. Evaluation of circulating activin-A as a serum marker of hepatocellular carcinoma. Cancer Detect Prev. 2000;24:150-155. [PubMed] |
| 24. | Huang X, Li DG, Wang ZR, Wei HS, Cheng JL, Zhan YT, Zhou X, Xu QF, Li X, Lu HM. Expression changes of activin A in the development of hepatic fibrosis. World J Gastroenterol. 2001;7:37-41. [PubMed] [DOI] |
| 25. | Sugiyama M, Ichida T, Sato T, Ishikawa T, Matsuda Y, Asakura H. Expression of activin A is increased in cirrhotic and fibrotic rat livers. Gastroenterology. 1998;114:550-558. [PubMed] [DOI] |
| 26. | Gold EJ, Francis RJ, Zimmermann A, Mellor SL, Cranfield M, Risbridger GP, Groome NP, Wheatley AM, Fleming JS. Changes in activin and activin receptor subunit expression in rat liver during the development of CCl4-induced cirrhosis. Mol Cell Endocrinol. 2003;201:143-153. [PubMed] [DOI] |
| 27. | Date M, Matsuzaki K, Matsushita M, Tahashi Y, Sakitani K, Inoue K. Differential regulation of activin A for hepatocyte growth and fibronectin synthesis in rat liver injury. J Hepatol. 2000;32:251-260. [PubMed] [DOI] |
| 28. | Yasuda H, Mine T, Shibata H, Eto Y, Hasegawa Y, Takeuchi T, Asano S, Kojima I. Activin A: an autocrine inhibitor of initiation of DNA synthesis in rat hepatocytes. J Clin Invest. 1993;92:1491-1496. [PubMed] [DOI] |
| 29. | Hully JR, Chang L, Schwall RH, Widmer HR, Terrell TG, Gillett NA. Induction of apoptosis in the murine liver with recombinant human activin A. Hepatology. 1994;20:854-862. [PubMed] [DOI] |
| 30. | Kanamaru C, Yasuda H, Fujita T. Involvement of Smad proteins in TGF-beta and activin A-induced apoptosis and growth inhibition of liver cells. Hepatol Res. 2002;23:211-219. [PubMed] [DOI] |
| 31. | Ichikawa T, Zhang YQ, Kogure K, Hasegawa Y, Takagi H, Mori M, Kojima I. Transforming growth factor beta and activin tonically inhibit DNA synthesis in the rat liver. Hepatology. 2001;34:918-925. [PubMed] [DOI] |
| 32. | Gold EJ, Zhang X, Wheatley AM, Mellor SL, Cranfield M, Risbridger GP, Groome NP, Fleming JS. betaA- and betaC-activin, follistatin, activin receptor mRNA and betaC-activin peptide expression during rat liver regeneration. J Mol Endocrinol. 2005;34:505-515. [PubMed] [DOI] |
| 33. | Wada W, Kuwano H, Hasegawa Y, Kojima I. The dependence of transforming growth factor-beta-induced collagen production on autocrine factor activin A in hepatic stellate cells. Endocrinology. 2004;145:2753-2759. [PubMed] [DOI] |