修回日期: 2005-11-21
接受日期: 2005-11-24
在线出版日期: 2006-01-18
目的: 观察胚胎发育早期肝干细胞的形态特征、时空分布及分化, 以探讨肝干细胞的生物学特征.
方法: 运用发育第3-12 wk人胚标本47例(其中3-5 wk各8例; 6-8 wk各5例, 9-12 wk各2例), 石蜡切片, 连续切片, 免疫组化染色, 光镜下观察人胚肝及肝干细胞的发育及其AFP、c-Met和CK19的时空表达.
结果: 发育第3 wk, 肝芽形成, 第4 wk形成肝索, 第5 wk出现原始肝血窦. 第3-5 wk人胚肝芽和肝索细胞排列紧密, 较小, 形态不规则, 核圆形或卵圆形, 核质比例大, 核深染, 胞质颜色较µ, 偏蓝色, 显示出幼稚细胞的形态学特征, 并呈甲胎蛋白(a-Fetoprotein, AFP)、c-Met阳性反应. 第6 wk, 肝索内出现了体积大、核大、µ染的细胞, 呈AFP、c-Met阴性反应. 随胚龄增加, 这类细胞数量增加. 10-12 wk, AFP、c-Met阳性细胞主要分布于汇管区周围. CK19阳性反应在7 wk时开始出现于一些与AFP、c-Met阳性反应的细胞形态类似的肝索细胞中. 10-11 wk时, CK19阳性反应主要位于汇管区附近的肝索细胞、胆管板细胞及胆管上皮细胞, 12 wk时, CK19阳性信号仅见于胆管板和胆管上皮细胞. 此时所有的胆管板细胞及胆管上皮细胞均呈AFP、c-Met和CK19阳性.
结论: 人胚发育3-5 wk肝实质由肝干细胞组成, 其表型为AFP+/c-Met+. 6 wk, 肝干细胞开始向肝细胞系分化, 7 wk向胆管系分化, 10-12 wk, 肝干细胞主要局限于汇管区周围的肝索, 与成年肝中卵圆细胞(成年肝干细胞)的分布一致. AFP+/c-Met/+CK19+细胞可能为胆管祖细胞.
引文著录: 蒋吉英, 赵立民, 张杰, 齐安东, 于树娜. 人胚胎肝干细胞的形态特点. 世界华人消化杂志 2006; 14(2): 220-224
Revised: November 21, 2005
Accepted: November 24, 2005
Published online: January 18, 2006
AIM: To observe the morphological features, temporal-spatial distribution and differentiation of hepatic stem cells in the early stage of human embryonic livers.
METHODS: Paraffin sections were prepared from human embryos of 3 to 12 wk by routine method. Immunohistochemical staining was used to observe the development of human embryonic livers and hepatic stem cells as well as the expression of α-fetoprotein (AFP), c-Met and cytokeratin 19 (CK19) under light microscope.
RESULTS: Liver buds came into being in wk 3, hepatic cords formed in wk 4, and primal hepatic sinusoids were found in wk 5. The hepatic cells of the 3-5 wk displayed the typical features of immature cells: small size, a round or ovoid nuclei with dark color, scant cytoplasm with slight blue and a high ratio of nuclei to cytoplasm. Moreover, they were positive for AFP and c-Met. At 6 wk, a part of hepatocytes, whose numbers increased as the growth of the embryos, became larger with nuclei of slight color, which were negative for AFP and c-Met. At 10-12 wk, the AFP- and c-Met-positive cells were mainly found at the periportal region. The CK19-positive reaction began to appear in some hepatocytes which were similar to the AFP- and c-Met-positive cells at 7 wk. At 10-11 wk, the reaction was confined at the hepatocytes adjacent to the portal region, ductal plate and biliary epithelial cells. At 12 wk, the positive reaction was only found at the ductal plate and biliary epithelial cells. Furthermore, all the cells were positive for AFP, c-Met and CK19 at this time.
CONCLUSION: Hepatocytes of 3-5 wk, phenotyped AFP+/c-Met+, are homogenous and belong to the hepatic stem cells. At 6 wk, the hepatic stem cells begin to differentiate to hepatocyte system, and then to cholangiocyte system in the next week. Like oval cells in the adult liver, the hepatic stem cells mainly locate at the periportal region at 10-12 wk. The cells characterized by AFP+/c-Met+/CK19+ belong to the progenitor cells of biliary epithelial cells.
- Citation: Jiang JY, Zhao LM, Zhang J, Qi AD, Yu SN. Morphological characteristics of human embryonic hepatic stem cells. Shijie Huaren Xiaohua Zazhi 2006; 14(2): 220-224
- URL: https://www.wjgnet.com/1009-3079/full/v14/i2/220.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i2.220
胚胎发育过程中, 器官的发生过程即各器官原基内干细胞增殖、分化、成熟的过程, 故早期胚胎可为器官干细胞的研究提供大量的有用信息. 由于肝干细胞具有自我复制和双向分化潜能, 肝干细胞可望成为严重肝疾患细胞替代疗法以及构成生物人工肝的供体细胞[1-4]. 肝干细胞应用中首先要解决的问题为肝干细胞的识别、鉴定. 但目前研究所观察到的肝干细胞在形态特征、标志物的表达等方面表现出多样性, 对肝干细胞分化时间的报道也不一致, 这对肝干细胞的鉴定和分离带来一定困难[2-4]. 此外, 肝干细胞的研究多以动物为研究对象, 采用细胞离体培养的方法, 对人胚胎肝干细胞的原位研究资料较为缺乏. 我们利用3-12 wk人胚标本, 选择AFP、CK19、c-Met作为标志物, 观察胚胎发育早期肝干细胞的形态特征、时空分布、分化过程以及分化的结果, 以期为肝干细胞的基础研究和临床应用研究提供实验依据.
本研究所用47例标本, 均征得孕妇本人知情同意, 实验过程符合伦理标准. 征得孕妇签字同意后, 收集意外流产, 受精龄为3 mo以内的新鲜人胚胎47例(其中3-5 wk各8例, 6-8 wk各5例, 9-12 wk各2例), 30 min内用4 g/L多聚甲醛固定, 酒精脱水, 二甲苯透明, 石蜡包埋, 制5 mm厚的连续切片, 裱于APES包被的载玻片上. 每10张抽片1张做HE染色. 在显微镜下, 根据胚层形成情况、体节的数目及器官发育状况确定胚龄.
确定胚龄后, 选择3-12 wk的标本切片, 每隔10张抽出1张切片, 行免疫组织化学染色(SABC法), 光镜观察, 拍照. 切片常规脱蜡、水化; 3 mL/L H2O2孵育10 min, 以封闭内源性过氧化物酶的活性; 0.1 g/L胰蛋白酶孵育10 min(37℃); 多克隆抗c-Met抗体(1/200, 博士德公司), 单克隆抗PCNA、AFP和CK19抗体(1/200, 博士德公司), 4℃孵育过夜; 生物素化的二抗孵育37℃, 1 h(1/200, 博士德公司); 过氧化物酶标记的链酶卵白素37℃, 1 h(1/200, 博士德公司); DAB显色; 苏木素复染; 梯度酒精脱水, 二甲苯透明, 中性树胶封片. 以PBS代替一抗作阴性对照.
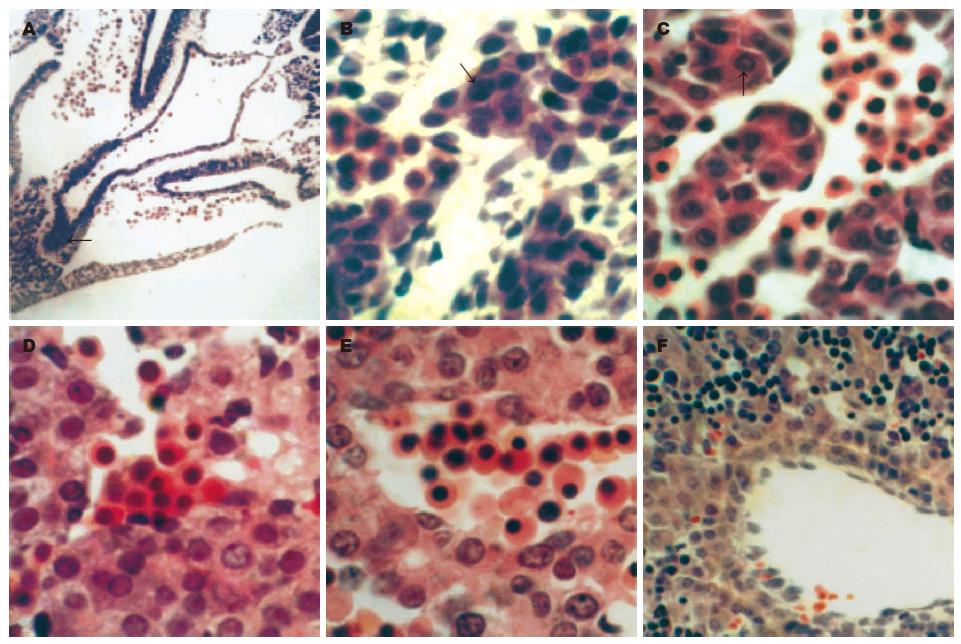
发育3 wk时, 可见前肠腹侧的一薄层与横隔间充质接触的内胚层细胞由立方形变为高柱状, 并向横隔间充质方向聚集形成肝芽(图1A). 构成肝芽的细胞排列紧密, 较小, 细胞形态不规则, 核圆形或卵圆形, 核质比例大, HE染色核深染, 胞质颜色为µ蓝色. 4 wk时, 肝芽的细胞伸入横隔间充质内, 被间充质分割形成肝索. 此时肝索排列稀疏, 肝索之间可见少量的间充质细胞和散在分布的原始血细胞, 构成肝索的细胞形态特点与第3 wk肝芽细胞相同(图1B). 5 wk时, 肝索数量增多, 组成肝索的细胞仍具上述特点, 但细胞数量明显增加. 在肝索间出现原始肝血窦(图1C). 胚胎发育6 wk时, 多数肝索细胞与3-5 wk的肝索细胞具有相似的特征, 但肝索中出现少数与上述细胞明显不同的细胞: 体积大, 多边形, 胞核大、µ染、核仁明显(图1D). 7 wk时, 肝索内和肝索间有大量造血灶, 肝索的形态和排列不规则. 肝索细胞由上述两类细胞组成. 原始胆小管已出现, 由6 wk出现的体积大, 多边形, 胞核大、µ染、核仁明显的肝索细胞围成, 尚未见胆管板(图1E). 10 wk, 中央静脉形成, 肝索沿着中央静脉呈放射状排列, 肝小叶初步形成. 肝索中以胞体大、核µ染的细胞为主. 在较大门静脉分支的附近开始出现胆管板, 胆管板的两层细胞排列紧密, 其间无明显的间隙. 组成胆管板的细胞较肝索细胞小, 圆形, 核卵圆形、核质比例大、核深染. 11-12 wk肝索的细胞特征与10 wk时相似, 但胆管板的数量和长度均增加, 双层的胆管板细胞分开, 形成管腔(图1F). 12 wk肝小叶的数量增多, 出现小叶间动脉、静脉及小叶间胆管, 典型的小叶结构可辨认, 此时肝的结构与成年肝相似.
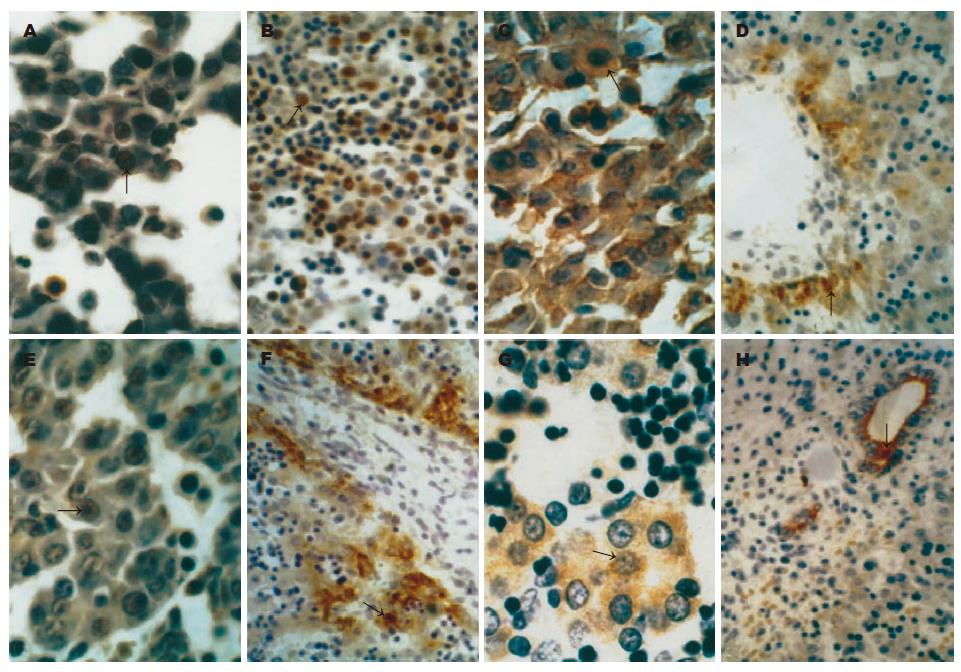
发育3-4 wk时, 肝索的细胞呈PCNA的反应阴性, 5 wk时多数肝索细胞为PCNA阳性, 阳性反应沉淀物分布在细胞核, 偶见呈阳性反应的造血细胞和血管内皮细胞(图2A). 随着胚胎的发育, 阳性的肝索细胞数目减少, 阳性的造血细胞和内皮细胞增多(图2B).
3-5 wk时肝芽和肝索的所有细胞都为AFP和c-Met阳性反应, 阳性反应沉淀物主要分布于细胞核及胞质(图2C, E). 6 wk时多数肝索细胞仍为AFP、c-Met阳性, 只有在6 wk才出现的少数体积较大, 核大, 核仁明显的细胞呈AFP、c-Met阴性反应. 随着胚胎肝的发育, AFP、c-Met阳性细胞的数量逐渐减少, 至10-12 wk时, AFP、c-Met阳性反应主要局限于汇管区附近的肝索细胞以及胆管板的细胞及胆管上皮细胞(图2D, F).
CK19免疫反应在7 wk开始出现, 此时围成原始胆小管的肝索细胞均呈CK19阳性反应(图2G). 8-9 wk时, CK19的免疫反应的分布及阳性细胞的数量与7 wk时相似. 10 wk时, CK19阳性反应主要位于汇管区附近的肝索细胞、胆管板细胞及胆管上皮细胞. CK19阳性细胞的数量较AFP、c-Met阳性细胞少. 12 wk时, CK19阳性信号仅见于胆管板和胆管上皮细胞, 在肝索细胞中无CK19免疫反应(图2H).
肝干细胞来源于前肠内胚层, 受原始心脏中胚层细胞的诱导, 前肠腹侧末段的部分内胚层细胞特化(specification)为肝干细胞[5]. AFP是胚胎发育过程中出现的一个主要的清蛋白, Shiojiri et al[6]发现, AFP mRNA在10.5 d大鼠胚胎前肠腹侧的内胚层细胞中表达, 1 d后形成肝索时出现AFP蛋白的表达, 提示AFP的表达是肝干细胞特化的开始. Suzuki et al[7]观察到c-Met特异地在肝干细胞中表达, 认为是各种动物肝干细胞的标志. 我们观察到, 3-5 wk时, 组成肝索的细胞为AFP、c-Met阳性, 这些细胞紧密排列, 细胞较小, 形态不规则, 核圆形或卵圆形, 核质比例大, 核深染, 胞质颜色较µ, 偏蓝色, 显示出幼稚细胞的形态学特征[8], 并与吴淑兰 et al[9]描述的分化程度较低的暗细胞形态学一致. 在其后的分化过程中, 这种幼稚细胞也一直存在, 只是数量和分布发生了变化(见3.2). 由于3-5 wk时人胚胎肝只有一种具有幼稚细胞特征的细胞类型并为AFP和c-Met阳性, 本文推测3-5 wk人胚肝实质由肝干细胞组成, AFP、c-Met联合使用可以标记肝干细胞. 5 wk此类细胞多数为PCNA阳性的结果提示此阶段肝干细胞正在增殖.
我们观察到, 发育6 wk时, 肝索中出现少量与幼稚细胞不同、而与成熟肝细胞有相似特征的细胞: 体积大, 呈多边形, 胞核大、µ染、核仁明显, 这些细胞为AFP、c-Met免疫反应阴性, 这与吴淑兰描述的分化程度较高的明细胞形态学一致, 提示这些是已经开始分化的细胞. 这种细胞的数量随胚胎龄增大而增加, 而具有幼稚细胞特征的AFP、c-Met阳性细胞数量却相应下降. 这提示, 6 wk时, 肝干细胞开始向肝细胞方向分化, 6-9 wk是肝干细胞向肝细胞系分化的阶段. 已经分化的肝细胞为AFP、c-Met免疫反应阴性. 10-12 wk时, AFP、c-Met阳性的肝干细胞局限于汇管区周围的肝索内, 这与成年肝中肝卵圆细胞(成年肝干细胞)的分布一致[10-14].
本研究还观察到, 发育7 wk时, 原始胆小管形成, 10 wk时, 开始出现胆管板, 11-12 wk, 双层的胆管板细胞分开形成胆管, 提示胆管细胞的分化从7 wk开始, 比肝细胞的分化晚1 wk. CK19是成熟胆管细胞的标志物[14], 但有研究发现, 发育早期的肝干细胞表达CK19[4], 因此有研究者[15,16]将CK19作为筛选肝干细胞标志物. 本研究注意到, 7 wk时, 当原始胆小管出现时, 与AFP、c-Met阳性细胞形态相似的细胞也出现CK19阳性反应, 这表明, 7 wk时的AFP+/c-Met+/CK19+细胞表型与3-6 wk时的肝干细胞(AFP+/c-Met+)不同, 当AFP+/c-Met+的肝干细胞中出现CK19免疫反应时, 即表明肝干细胞已经开始向胆管细胞方向分化. AFP+/c-Met+/CK19+的肝干细胞应视为胆管祖细胞, AFP+/c-Met+表达提示他们来自肝干细胞, 这支持胆管细胞的肝干细胞来源学说[17]. 成熟的胆管细胞只能为CK19所标记. 汇管区附近AFP+/c-Met+/CK19+的细胞是否与AFP+/c-Met+/CK19+的细胞为同一类细胞并代表了成年肝中的肝卵圆细胞, 有待进一步证实.
总之, 发育第3-5 wk人胚胎肝的细胞为未分化的肝干细胞. 若拟研究人胚胎肝干细胞, 此时取材、并利用AFP、c-Met作为筛选标志, 可以筛选到具有双向分化潜能的肝干细胞. 6 wk时肝干细胞开始向肝细胞分化, 7 wk时肝干细胞向胆管系分化. 可以共同使用AFP、c-Met、CK19来标记胆管祖细胞.
由于肝干细胞具有自我复制和双向分化潜能, 故肝干细胞可望成为严重肝疾患细胞替代疗法以及构成生物人工肝的供体细胞, 也因此使其成为当前的一个研究热点. 肝干细胞应用中首先要解决的问题为肝干细胞的识别、鉴定. 成年哺乳动物肝中的肝干细胞的存在部位尚不确定. 在胚胎发育过程中, 个体的每个器官的形成即是该器官原基内干细胞增殖、分化、成熟的过程, 故早期胚胎可为器官干细胞的研究提供大量的有用信息.
目前研究所观察到的肝干细胞在形态特征、标志物的表达等方面表现出多样性, 对肝干细胞分化时间的报道也不一致, 这对肝干细胞的鉴定和分离带来一定困难. 此外, 肝干细胞的研究多以动物为研究对象, 采用细胞离体培养的方法, 对人胚胎肝干细胞的原位研究资料较为缺乏.
本文选择AFP、CK19、c-Met作为标志物, 在不同发育时期的人胚胎肝标本上连续观察胚胎发育早期肝干细胞的形态特征、时空分布及其分化. 结果发现, 3-5wk肝实质由肝干细胞组成, 其表型为AFP+/c-Met+, 这些细胞在6wk开始向肝细胞系分化, 7wk向胆管系分化, 10-12wk, 肝干细胞主要局限于汇管区周围的肝索, 与成年肝中卵圆细胞(成年肝干细胞)的分布一致. AFP+/c-Met+/CK19+细胞可能为胆管祖细胞.
为肝干细胞的基础研究和临床应用研究提供实验依据.
本文立题于生物人工肝的基础研究, 探讨肝干细胞诱导分化的时空分布特征变化, 具有相当的基础研究价值及临床应用前景, 是一篇立题较新颖, 有一定开创性及实用性的研究报道.
编辑: 菅鑫妍 审读: 张海宁 电编: 张敏
| 1. | Malhi H, Irani AN, Gagandeep S, Gupta S. Isolation of human progenitor liver epithelial cells with ex-tensive replication capacity and differentiation into mature hepatocytes. J Cell Sci. 2002;115:2679-2688. [PubMed] |
| 2. | Germain L, Blouin MJ, Marceau N. Biliary epithelial and hepatocytic cell lineage relationships in embry-onic rat liver as determined by the differential expr-ession of cytokeratins, alpha-fetoprotein, albumin, and cell surface-exposed components. Cancer Res. 1988;48:4909-4918. [PubMed] |
| 3. | Petkov PM, Zavadil J, Goetz D, Chu T, Carver R, Rogler CE, Bottinger EP, Shafritz DA, Dabeva MD. Gene expression pattern in hepatic stem/progenitor cells during rat fetal development using comple-mentary DNA microarrays. Hepatology. 2004;39:617-627. [PubMed] |
| 4. | Haruna Y, Saito K, Spaulding S, Nalesnik MA, Gerber MA. Identification of bipotential progenitor cells in human liver development. Hepatology. 1996;23:476-481. [PubMed] |
| 6. | Shiojiri N, Lemire JM, Fausto N. Cell lineages and oval cell progenitors in rat liver development. Cancer Res. 1991;51:2611-2620. [PubMed] |
| 7. | Suzuki A, Zheng YW, Fukao K, Nakauchi H, Taniguchi H. Liver repopulation by c-Met-positive stem/progenitor cells isolated from the developing rat liver. Hepatogastroenterology. 2004;51:423-426. [PubMed] |
| 8. | 张 静波, 宗 书东, 马 文丽. 干细胞. 第1版. 北京: 中国协和医科大学出版社 2003; 5. |
| 10. | Alpini G, Aragona E, Dabeva M, Salvi R, Shafritz DA, Tavoloni N. Distribution of albumin and alpha-fetoprotein mRNAs in normal, hyperplastic, and pr-eneoplastic rat liver. Am J Pathol. 1992;141:623-632. [PubMed] |
| 11. | Sell S. Is there a liver stem cell? Cancer Res. 1990;50:3811-3815. [PubMed] |
| 12. | Theise ND, Saxena R, Portmann BC, Thung SN, Yee H, Chiriboga L, Kumar A, Crawford JM. The canals of Hering and hepatic stem cells in humans. Hepatology. 1999;30:1425-1433. [PubMed] |
| 13. | Paku S, Schnur J, Nagy P, Thorgeirsson SS. Origin and structural evolution of the early proliferating oval cells in rat liver. Am J Pathol. 2001;158:1313-1323. [PubMed] |
| 14. | Jones EA, Clement-Jones M, James OF, Wilson DI. Differences between human and mouse alpha-feto-protein expression during early development. J Anat. 2001;198:555-559. [PubMed] |
| 15. | Germain L, Blouin MJ, Marceau N. Biliary epitheli-al and hepatocytic cell lineage relationships in emb-ryonic rat liver as determined by the differential expression of cytokeratins, alpha-fetoprotein, albu-min, and cell surface-exposed components. Cancer Res. 1988;48:4909-4918. [PubMed] |
| 16. | Strick-Marchand H, Weiss MC. Inducible differen-tiation and morphogenesis of bipotential liver cell lines from wild-type mouse embryos. Hepatology. 2002;36:794-804. [PubMed] |
| 17. | Shiojiri N. Development and differentiation of bile ducts in the mammalian liver. Microsc Res Tech. 1997;39:328-335. [PubMed] |