修回日期: 2005-11-15
接受日期: 2005-11-24
在线出版日期: 2006-01-18
目的: 研究抑癌基因RUNX3在人结肠癌细胞中的表达情况, 探讨5-氮-2'-脱氧胞苷(5-Aza-CdR)对人结肠癌Lovo细胞增殖凋亡及RUNX3表达的影响.
方法: 用特异性甲基转移酶抑制剂5-Aza-CdR 0.4, 4, 40 mmol/L处理人结肠癌细胞株Lovo 3 d, 继续常规培养5 d后, 采用四唑盐(MTT)比色观察细胞经药物处理前后的生长活性, 以半定量RT-PCR检测细胞处理前后抑癌基因RUNX3 mRNA的表达, 应用流式细胞仪进行细胞凋亡率的检测.
结果: 人结肠癌细胞Lovo经处理后, 与对照组比较, 5-Aza-CdR 0.4, 4, 40 mmol/L均能明显抑制肿瘤细胞生长, 随5-Aza-CdR浓度增加, 细胞生长速率下降; 对照组Lovo细胞未见RUNX3 mRNA表达, 经药物处理后的细胞均检出该种mRNA的重新表达, 其mRNA的表达相对量分别为0.46±0.06, 0.71±0.06, 0.84±0.07, 与药物存在剂量依赖性(F = 168.4, P<0.01); 对照组细胞凋亡率为2.92%±0.93%, 5-Aza-CdR 0.4, 4, 40 mmol/L处理后Lovo细胞凋亡率分别为10.95%±2.09%, 17.61%±1.51%, 26.60%±1.89%, 与对照组相比较均有统计学意义(P<0.01), 且凋亡率与5-Aza-CdR剂量呈正相关(F = 145.7, P<0.01)
结论: 在人结肠癌细胞株Lovo中, 基因RUNX3可能因过甲基化而导致转录失活, RUNX3基因重新表达能抑制细胞生长, 并能诱导部分细胞凋亡.
引文著录: 倪志, 刘南植, 李林芳, 张庆, 李秀梅, 洪玮. 5-Aza-CdR 对人结肠癌 Lovo 细胞增殖凋亡及抑癌基因RUNX3 表达的影响. 世界华人消化杂志 2006; 14(2): 184-188
Revised: November 15, 2005
Accepted: November 24, 2005
Published online: January 18, 2006
AIM: To investigate the effects of 5-Aza-2'-deoxycytidine (5-Aza-CdR) on the proliferation and apoptosis of Lovo cells and the expression of tumor suppressor gene RUNX3.
METHODS: Human colonic cancer cell line Lovo was treated with 5-Aza-CdR (0.4, 4, 40 μmol/L), a specific demethylating agent, for 3 d, and then cultured in RPMI 1640 medium for 5 d. The growth of Lovo cells was observed by MTT assay before and after 5-Aza-CdR treatment, respectively. The expression of RUNX3 mRNA was observed by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR). The apoptosis of Love cells was analyzed by flow cytometry.
RESULTS: Lovo cells treated with 5-Aza-CdR displayed a slowed growth in comparison with the control cells, and the growth rate decreased accordingly with the increase of 5-Aza-CdR concentration. RUNX3 mRNA was expressed in Lovo cells after 5-Aza-CdR treatment, but it was undetectable before the treatment. After 0.4, 4, and 40 μmol/L 5-Aza-CdR treatment, the level of RUNX3 mRNA expression was 0.46 ± 0.06, 0.71 ± 0.06, and 0.84 ± 0.07, respectively, and it was significantly correlated with the concentration of 5-Aza-CdR (F = 168.4, P < 0.01). The apoptotic rate of Lovo cells treated with 0.4, 4, and 40 μmol/L 5-Aza-CdR was 10.95% ± 2.09%, 17.61% ± 1.51%, and 26.60% ± 1.89%, respectively, which was markedly higher than that of the controls (2.92% ± 0.93%)(P < 0.01). The apoptosis was also notably correlated with 5-Aza-CdR concentration (F = 145.7, P < 0.01).
CONCLUSION: 5-Aza-CdR can inhibit the proli-feration and partly induce the apoptosis of Lovo cells by inducing the re-expression of RUNX3 gene..
- Citation: Ni Z, Liu NZ, Li LF, Zhang Q, Li XM, Hong W. Effects of 5-Aza-CdR on cell proliferation and apoptosis in colonic cancer cell line Lovo and expression of tumor suppressor gene RUNX3. Shijie Huaren Xiaohua Zazhi 2006; 14(2): 184-188
- URL: https://www.wjgnet.com/1009-3079/full/v14/i2/184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i2.184
肿瘤的发生和发展过程中, 抑癌基因的失活是关键因素之一. 目前研究表明, 抑癌基因失活的主要方式有基因的缺失、突变和启动子区域的过甲基化等[1-4]. 5-氮-2'-脱氧胞苷(5-Aza-CdR)是一种DNA甲基转移酶的抑制剂, 很多体外研究证实, 5-Aza-CdR通过去甲基化作用能使多种CpG岛过甲基化的抑癌基因重新表达, 而恢复抑癌功能[5-8]. RUNX3是一种新发现的抑癌基因, 研究证实对胃癌细胞的生长具有明显的抑制作用, 启动子区域CpG岛的过甲基化可能是其失活的方式[4,9]. 结肠癌中该基因的表达研究尚少. 我们采用5-Aza-CdR对肠癌细胞株进行处理, 检测RUNX3基因表达, 并分析肿瘤细胞的生物学行为改变, 以探讨肠癌的发生机制并寻求新的治疗靶点.
小牛血清, RPMI 1640培养基(Gibco公司); 5-Aza-CdR, MTT, DMSO, RNA酶A(RNase A)及碘化嘧啶(PI)(Sigma公司); RT-PCR试剂盒(大连宝生物公司); Trizol(MRC公司). 目的基因RUNX3及内参照GAPDH的引物均由Primer5.0软件自行设计, 由上海生工公司合成, 引物序列如下: RUNX3上游引物: 5'-CAGCCAAATCTTGCGACTC-3', 下游引物: 5'-ACCA GAAGGACTGCCTAACC-3', 产物片段长度852 bp; GAPDH上游引物: 5'-CCATGTTCGT CATGGGTGTGAACCA-3', 下游引物: 5'-GCCAGTAGAG GCAGGGATGATGTTC-3', 产物片段长度251 bp. 人结肠癌细胞株Lovo为华中科技大学同济医学院附属协和医院惠赠, 用含100 mL/L小牛血清的RPMI 1640培养基培养(37℃, 50 mL/L CO2, 饱和湿度), 隔日换液, 细胞长满培养瓶壁80%-90%后, 按1:2-1:4传代, 取对数生长期细胞进行实验.
将细胞以适宜密度接种, 加入含5-Aza-CdR的RPMI 1640培养基, 使其药物终浓度分别为0.4, 4, 40 mmol/L, 每24 h更换为新鲜药液, 浓度同前, 连续作用3 d后弃去药液, 以含100 mL/L小牛血清的RPMI 1640培养基继续培养5 d. 以未经药物干预的Lovo细胞作为对照组.
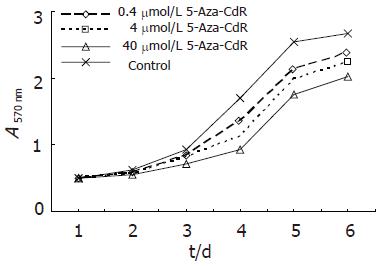
1.2.1 药物作用前后Lovo细胞增殖活性: 上述经药物处理后的细胞及对照组细胞, 以每孔3×103个细胞接种于96孔板, 各组设5个复孔, 共接种6板. 待细胞6 h贴壁后, 及其后每隔24 h取出1板, 每孔加入浓度5 g/L的MTT 20 mL, 置培养箱内孵育4 h后, 小心吸去培养液, 加入150 mL DMSO, 37℃恒温水平摇床振摇15 min, 待晶体充分溶解后, 置全自动酶标仪于570 nm波长处读取吸光度(A), 上述实验均重复3次. 细胞增殖能力以平均吸光度(A)值分析, 以A值为纵坐标, 时间(d)为横坐标, 绘制生长曲线.
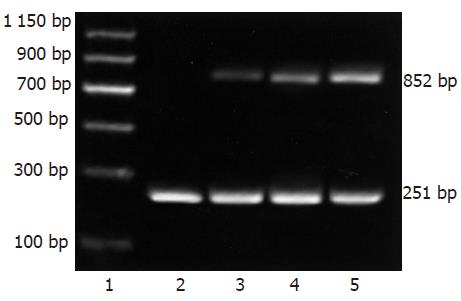
1.2.2 用药后RUNX3: 上述经药物处理后的细胞及对照组细胞, 按Trizol试剂说明书一步法提取总RNA. 通过紫外分光光度计检测RNA的260 nm与280 nm吸光度, 计算出RNA浓度. 1 mg RNA加入逆转录反应体系, 以随机引物Random 9mers为引物进行逆转录反应, 逆转录反应条件参照试剂盒说明. 取2 mg逆转录反应产物, 按试剂盒说明书比例配成25 mL的PCR反应体系. PCR反应条件: 94℃变性4 min, 1个循环; 94℃变性45 s, 57℃退火45 s, 72℃延伸45 s, 共35个循环; 再以72℃延伸7 min. 扩增产物于15 g/L琼脂糖凝胶电泳, 用凝胶成像系统进行半定量分析, RUNX3的相对表达水平 = RUNX3基因的RT-PCR产物电泳条带的密度/GAPDH基因的RT-PCR产物电泳条带的密度.
1.2.3 细胞凋亡的检测: 上述经药物处理后的细胞及对照组细胞均以每孔2×105个接种于六孔板上, 以含100 mL/L小牛血清的RPMI 1640培养基培养4 d. 按常规方法消化收集细胞, 以PBS洗涤2次, 以-20℃预冷的800 g/L乙醇固定, 充分振摇均匀, 置-20℃冰箱保存24 h以上. 检测前离心(1 500 r/min, 10 min), 弃乙醇, 以PBS洗涤2次, 以PBS调节细胞密度至1×109/L, 洗涤后加入由50 mmol/L磷酸钠和25 mmol/L枸橼酸按体积比9:1组成的PC缓冲液(pH 7.8)50 mL, 室温放置15 min, 加PBS 0.5 mL, PI 50 mL(100 mg/L)和RNaseA 10 mL(5 mg/L)于室温、暗处放置染色30 min, 以流式细胞仪(BD公司)进行细胞凋亡率检测.
统计学处理 实验数据用mean±SD表示, 多样本均数比较采用单因素方差分析, 两组均数比较采用t检验, 所有数据均由SPSS 12.0统计软件进行处理, P<0.05为统计学上差异有显著性.
光镜下观察结肠癌细胞Lovo, 于5-Aza-CdR处理前为多角形, 形态不规则; 药物处理3 d后, 可见细胞皱缩, 多角形形态趋于规则. 继续培养5 d后, 可见细胞密度低, 部分细胞体积缩小, 死亡细胞数多. 细胞经3种不同浓度5-Aza-CdR处理后, 细胞的生长速度受到不同程度的抑制, 随着药物浓度的增加抑制作用增强(图1).
RT-PCR检测对照组细胞未见RUNX3基因的mRNA表达, 5-Aza-CdR处理后的细胞RUNX3基因的mRNA重新表达(图2), 分别用浓度0.4, 4, 40 mmol/L的5-Aza-CdR处理细胞后, 细胞RUNX3 mRNA的相对表达量分别为0.46±0.06, 0.71±0.06, 0.84±0.07, 且具有剂量依赖关系(F = 168.4, P<0.01).
经流式细胞仪检测分析, 对照组细胞凋亡率为2.92%±0.93%, 经5-Aza-CdR 0.4, 4, 40 mmol/L处理后在细胞周期G1峰前出现明显的凋亡峰, 细胞凋亡率逐渐增高, 凋亡率分别为10.95%±2.09%, 17.61%±1.51%, 26.60%±1.89%, 与对照组相比较有统计学意义(P<0.01), 细胞凋亡率与5-Aza-CdR浓度水平具有剂量依赖关系(F = 145.7, P<0.01).
结肠癌和其他肿瘤一样, 其发生和发展是一个多基因、多步骤的过程, 癌基因的激活和/或抑癌基因的失活是其分子学基础. 肿瘤学研究表明, DNA甲基化在基因表达调控、细胞增殖、分化、发育及基因组印迹等方面起着重要的作用, 并与肿瘤的发生发展关系密切[10-12]. DNA的过甲基化是引起抑癌基因失活的重要方式. DNA过甲基化并不是基因序列发生改变, 而只是部分碱基对发生甲基化修饰, 这种异常的甲基化模式是可以逆转的[13,14].
RUNX3是一种新发现的定位于1p36.1的抑癌基因, 广泛表达于消化道上皮细胞、间叶细胞、血液细胞及神经细胞等[15-17]. RUNX3是RUNT基因家族的成员之一, RUNT基因家族是由RUNX1、RUNX2、RUNX3等三个成员组成, 其编码蛋白是一组DNA结合转录因子, 在细胞的生长、发育及凋亡过程中起着重要的作用[18-21]. 许多研究发现, RUNX3-/-的胃黏膜上皮细胞的过度增生和凋亡减少与细胞对TGF-β诱导凋亡的敏感性降低有关, TGF-β作为诱导抑制增生因子其诱导凋亡的作用在RUNX3-/-的胃黏膜上皮细胞中完全失活, 结果提示, RUNX3可能是TGF-β信号传导途径的关键作用靶点[4,22]. 进一步研究证实, 在TGF-β信号传导过程中, TGF-β与被激活的Smad形成的复合物由胞质转入胞核内后需在RUNX3蛋白的指导下与核内特异性的靶点相结合, 并增强其结合力, 共同调节相关靶基因的转录. RUNX3表达沉默可导致TGF-β信号途径紊乱, 引起TGF-β信号失活, 进而引发细胞的凋亡障碍, 导致肿瘤的发生[22-24].
本研究结果显示, 人结肠癌细胞株Lovo不表达RUNX3基因的mRNA, 而经过5-Aza-CdR处理后的细胞重新表达RUNX3的mRNA, 提示在结肠癌细胞中RUNX3表达失活可能是由于启动子区域的CpG岛过甲基化所致. 5-Aza-CdR是一种DNA甲基转移酶1(DNMT1)抑制剂, 他是一种脱氧胞苷类似物, 在DNA复制过程中与DNA分子相结合, 并与DNMT1形成一共价复合物, 抑制该酶的甲基转移活性, 生成低甲基化子链, 从而实现去甲基化功能[25-27]. 我们发现, Lovo细胞经过5-Aza-CdR处理后, MTT检测的细胞生长曲线及流式细胞仪检测的细胞凋亡率可以看出细胞的增殖不同程度受到抑制, 细胞凋亡率明显提高. 上述结果提示, 5-Aza-CdR可能使因甲基化失活的RUNX3基因去甲基化而重新表达, 恢复其抑癌功能, 从而导致抑制结肠癌细胞生长并诱导其凋亡的作用. 当然, 若5-Aza-CdR本身存在细胞毒性也可以产生类似作用. 目前研究表明, 有细胞毒性作用的药物其细胞毒效应均存在着时效性, 而未发现抑制肿瘤细胞生长的可遗传性[28]. 在本研究中, 实验所用均是药物作用后并继续培养5 d以上的细胞, 因而提示5-Aza-CdR抑制肿瘤细胞生长、诱导其凋亡并非其本身的药物毒性直接所致, 而是其去甲基化的间接作用. RUNX3的mRNA重新表达后, 随着mRNA表达增强, 结肠癌细胞生长明显减慢, 提示RUNX3可能直接或间接参与调控细胞DNA的复制合成.RUNX3作为一种新发现的抑癌基因, 其表达可通过TGF-β信号途径抑制细胞的过度增殖并诱导凋亡. RUNX3可能成为结肠癌的一个新的生物学标志和基因治疗的靶点, 为结肠癌的诊断和治疗提供一条新的途径. 但有关RUNX3基因的表达调节、RUNX3转录因子的作用机制及是否与其他癌基因和/或抑癌基因存在相互关联作用还不十分清楚, 有待进一步研究.
RUNX3是一种新发现的定位于1p36.1的抑癌基因, 他是RUNT基因家族成员之一. RUNT家族是一组高度保守的基因序列, 他们在细胞的生长发育的过程中起着重要的作用. 近来多项研究发现RUNX3与人类多种消化系肿瘤发生有着密切的相关性.
国内未见结肠癌与RUNX3表达的相关性研究报道, 本文初步探讨了RUNX3在结肠癌细胞Lovo中的表达情况及其可能失活机制, 发现RUNX3可能因过甲基化而导致转录失活, RUNX3基因重新表达能抑制细胞生长, 并能诱导部分细胞凋亡.
RUNX3作为一个新发现的抑癌基因, 在调控细胞的生长发育和细胞凋亡的过程中发挥着重要而复杂的转录调节作用.RUNX3可能成为一个消化系恶性肿瘤的生物学标志和肿瘤基因治疗的靶点, 为消化系恶性肿瘤的诊断和治疗提供了一条新途径.
RUNX3是一种新发现的定位于1p36.1的抑癌基因, 他是RUNT基因家族成员之一. 其编码蛋白是一种DNA结合转录因子, 在细胞的生长、发育及凋亡过程中起着重要的作用.
本文选题新颖, 叙述完整, 结论正确, 有一定的临床意义.
编辑: 潘伯荣 审读: 张海宁 电编: 张敏
| 1. | Zochbauer-Muller S, Fong KM, Virmani AK, Geradts J, Gazdar AF, Minna JD. Aberrant promoter methyla-tion of multiple genes in non-small cell lung cancers. Cancer Res. 2001;61:249-255. [PubMed] |
| 2. | Attri J, Srinivasan R, Majumdar S, Radotra BD, Wig J. Alterations of tumor suppressor gene p16INK4a in pancreatic ductal carcinoma. BMC Gastroenterol. 2005;5:22. [PubMed] |
| 3. | Hustinx SR, Leoni LM, Yeo CJ, Brown PN, Goggins M, Kern SE, Hruban RH, Maitra A. Concordant loss of MTAP and p16/CDKN2A expression in pancrea-tic intraepithelial neoplasia: evidence of homozyg-ous deletion in a noninvasive precursor lesion. Mod Pathol. 2005;18:959-963. [PubMed] |
| 4. | Li QL, Ito K, Sakakura C, Fukamachi H, Inoue K, Chi XZ, Lee KY, Nomura S, Lee CW, Han SB. Causal relationship between the loss of RUNX3 expression and gastric cancer. Cell. 2002;109:113-124. [PubMed] |
| 5. | Nakano T, Tani M, Nishioka M, Kohno T, Otsuka A, Ohwada S, Yokota J. Genetic and epigenetic alterations of the candidate tumor-suppressor gene MYO18B, on chromosome arm 22q, in colorectal cancer. Genes Chromosomes Cancer. 2005;43:162-171. [PubMed] |
| 6. | Kobatake T, Yano M, Toyooka S, Tsukuda K, Dote H, Kikuchi T, Toyota M, Ouchida M, Aoe M, Date H. Aberrant methyla-tion of p57KIP2 gene in lung and breast cancers and malignant mesotheliomas. Oncol Rep. 2004;12:1087-1092. [PubMed] |
| 7. | Fang JY, Lu J, Chen YX, Yang L. Effects of DNA methylation on expression of tumor suppressor genes and proto-oncogene in human colon cancer cell lines. World J Gastroenterol. 2003;9:1976-1980. [PubMed] |
| 8. | Yang B, Guo M, Herman JG, Clark DP. Aberrant promoter methylation profiles of tumor suppressor genes in hepatocellular carcinoma. Am J Pathol. 2003;163:1101-1107. [PubMed] |
| 9. | Waki T, Tamura G, Sato M, Terashima M, Nishizu-ka S, Motoyama T. Promoter methylation status of DAP-kinase and RUNX3 genes in neoplastic and non-neoplastic gastric epithelia. Cancer Sci. 2003;94:360-364. [PubMed] |
| 10. | Ehrlich M. The controversial denouement of verteb-rate DNA methylation research. Biochemistry. 2005;70:568-575. [PubMed] |
| 11. | Pufulete M, Al-Ghnaniem R, Rennie JA, Appleby P, Harris N, Gout S, Emery PW, Sanders TA. Influence of folate status on genomic DNA methylation in colonic mucosa of subjects without colorectal aden-oma or cancer. Br J Cancer. 2005;92:838-842. [PubMed] |
| 12. | Kim TY, Jong HS, Jung Y, Kim TY, Kang GH, Bang YJ. DNA hypermethylation in gastric cancer. Aliment Pharmacol Ther. 2004;20:131-142. [PubMed] |
| 13. | Bae SI, Lee HS, Kim SH, Kim WH. Inactivation of O6-methylguanine-DNA methyltransferase by promoter CpG island hypermethylation in gastric cancers. Br J Cancer. 2002;86:1888-1892. [PubMed] |
| 14. | Esteller M, Corn PG, Baylin SB, Herman JG. A gene hypermethylation profile of human cancer. Cancer Res. 2001;61:3225-3229. [PubMed] |
| 15. | Inoue K, Ozaki S, Shiga T, Ito K, Masuda T, Okado N, Iseda T, Kawaguchi S, Ogawa M, Bae SC. Runx3 controls the axo-nal projection of proprioceptive dorsal root ganglion neurons. Nat Neurosci. 2002;5:946-954. [PubMed] |
| 16. | Woolf E, Xiao C, Fainaru O, Lotem J, Rosen D, Negreanu V, Bernstein Y, Goldenberg D, Brenner O, Berke G. Runx3 and Runx1 are required for CD8 T cell development during thymopoiesis. Proc Natl Acad Sci USA. 2003;100:7731-7736. [PubMed] |
| 17. | Levanon D, Bettoun D, Harris-Cerruti C, Woolf E, Negreanu V, Eilam R, Bernstein Y, Goldenberg D, Xiao C, Fliegauf M. The Runx3 transcription factor regulates development and survival of TrkC dorsal root ganglia neurons. EMBO J. 2002;21:3454-3463. [PubMed] |
| 18. | Bangsow C, Rubins N, Glusman G, Bernstein Y, Negreanu V, Goldenberg D, Lotem J, Ben-Asher E, Lancet D, Levanon D. The RUNX3 gene--sequence, structure and regulated expression. Gene. 2001;279:221-232. [PubMed] |
| 19. | Habtemariam B, Anisimov VM, MacKerell AD Jr. Cooperative binding of DNA and CBFbeta to the Runt domain of the CBFalpha studied via MD simulations. Nucleic Acids Res. 2005;33:4212-4222. [PubMed] |
| 20. | Javed A, Barnes GL, Jasanya BO, Stein JL, Gersten-feld L, Lian JB, Stein GS. runt homology domain transcription factors (Runx, Cbfa, and AML) mediate repression of the bone sialoprotein promoter: eviden-ce for promoter context-dependent activity of Cbfa proteins. Mol Cell Biol. 2001;21:2891-2905. [PubMed] |
| 21. | Telfer JC, Rothenberg EV. Expression and function of a stem cell promoter for the murine CBFalpha2 gene: distinct roles and regulation in natural killer and T cell development. Dev Biol. 2001;229:363-382. [PubMed] |
| 22. | Fainaru O, Woolf E, Lotem J, Yarmus M, Brenner O, Goldenberg D, Negreanu V, Bernstein Y, Levanon D, Jung S. Runx3 regulates mouse TGF-beta-mediated dendritic cell function and its absence results in airway inflammation. EMBO J. 2004;23:969-979. [PubMed] |
| 23. | Gayther SA, Batley SJ, Linger L, Bannister A, Thorpe K, Chin SF, Daigo Y, Russell P, Wilson A, Sowter HM. Mutations truncating the EP300 acetylase in human cancers. Nat Genet. 2000;24:300-303. [PubMed] |
| 24. | Li J, Kleeff J, Guweidhi A, Esposito I, Berberat PO, Giese T, Buchler MW, Friess H. RUNX3 expression in primary and metastatic pancreatic cancer. J Clin Pathol. 2004;57:294-299. [PubMed] |
| 25. | Jackson-Grusby L, Laird PW, Magge SN, Moeller BJ, Jaenisch R. Mutagenicity of 5-aza-2'-deoxycyti-dine is mediated by the mammalian DNA methyltrans-ferase. Proc Natl Acad Sci USA. 1997;94:4681-4685. [PubMed] |
| 26. | Kim SH, Bae SI, Lee HS, Kim WH. Alteration of O6-methylguanine-DNA methyltransferase in colorectal neoplasms in sporadic and familial adenomatous polyposis patients. Mol Carcinog. 2003;37:32-38. [PubMed] |
| 27. | Zhang S, Kong WJ, Wang YJ, Han YC, Zhang D. Inhibitory effect of 5-Aza-2'-deoxycytidine on human nasopharyngeal carcinoma xenograft in nude mice. Aizheng. 2005;24:1201-1205. [PubMed] |
| 28. | Bender CM, Pao MM, Jones PA. Inhibition of DNA methylation by 5-aza-2'-deoxycytidine suppresses the growth of human tumor cell lines. Cancer Res. 1998;58:95-101. [PubMed] |