修回日期: 2006-05-02
接受日期: 2006-05-08
在线出版日期: 2006-07-08
目的: 探讨雷帕霉素抑制JAK/STAT通路对急性肝损伤大鼠肝组织HMGB1表达的影响.
方法: 采用D-Galn/LPS复制急性肝损伤(ALI)模型. 大鼠随机分为正常对照组(n = 30)、ALI组(n = 30)、STAT抑制剂雷帕霉素(RPM)处理组(n = 30). 用Western blot方法测定肝组织HMGB1蛋白, 全自动生化分析仪测定肝功能指标.
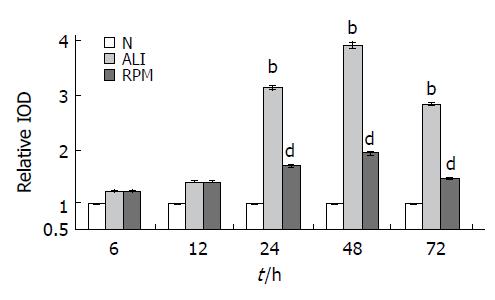
结果: 与正常对照组HMGB1表达水平(1.00±0.02)相比, ALI组24-72 h HMGB1表达显著升高(3.12±0.06, 3.9±0.08, 2.83±0.04, t值分别为16.01, 3.86, 10.46, 均P<0.01), 血清丙氨酸转氨酶(ALT)6和24 h有两个峰值, 且24 h峰值高于6 h. 与ALI组相比, RPM预处理组24-72 h HMGB1蛋白表达均显著抑制(1.67±0.05 vs 3.12±0.06; 1.93±0.06vs 3.9±0.08; 1.47±0.04 vs 2.83±0.04; t值分别为20.11, 41.90, 26.02, 均P<0.01), ALT在24, 48, 72 h也均有不同程度下降(P<0.01). ALT与HMGB1呈正相关(r = 0.741, P<0.01).
结论: 抑制JAK/STAT可明显下调肝组织中HMGB1蛋白表达, 并有助于减轻D-Galn/LPS所致的急性肝损伤.
引文著录: 张芸, 赵中夫, 韩德五, 王锋, 许瑞龄, 刘明社. 雷帕霉素抑制JAK/STAT通路对急性肝损伤大鼠肝组织HMGB1表达的影响. 世界华人消化杂志 2006; 14(19): 1916-1920
Revised: May 2, 2006
Accepted: May 8, 2006
Published online: July 8, 2006
AIM: To investigate the effect of rapamycin (RPM) on the expression of high-mobility group box 1 (HMGB1) in rats with acute liver injury (ALI) by inhibiting Janus kinase/signal transducer and activator of transcription pathway.
METHODS: Wistar rats were randomly divided into normal control group (n = 30), ALI group (n = 30) and RPM treatment group (n = 30). ALI was induced by intraperitoneal administration of D-Galactosamine/lipopolysaccharide (D-Galn/LPS). The animals in each group were sacrificed at different time points to collect the blood and hepatic tissue samples for the detection of alanine aminotransferase (ALT) level and HMGB1 expression, respectively.
RESULTS: In comparison with that in the normal controls (1.00 ± 0.02), HMGB1 expression was significantly increased in liver tissues 24, 48 and 72 h after ALI (3.12 ± 0.06, 3.9 ± 0.08, 2.83 ± 0.04, respectively, t = 16.01, 3.86, 10.46, all P < 0.01), and serum ALT levels were markedly elevated. The expression of HMGB1 in liver tissues was dramatically inhibited 24, 48 and 72 h after RPM treatment as compared with that in ALI group (1.67 ± 0.05 vs 3.12 ± 0.06; 1.93 ± 0.06 vs 3.9 ± 0.08; 1.47 ± 0.04 vs 2.83 ± 0.04; t = 20.11, 41.90, 26.02, all P < 0.01). In addition, serum ALT levels were also markedly reduced during 24-72 h after RPM treatment (P < 0.01). HMGB1 expression was positively correlated with ALT level (r = 0.741, P < 0.01).
CONCLUSION: The activation of JAK/STAT pathway may be involved in the up-regulation of HMGB1 expression in ALI. RPM treatment can markedly down-regulates HMGB1 expression and attenuates ALI.
- Citation: Zhang Y, Zhao ZF, Han DW, Wang F, Xu RL, Liu MS. Rapamycin-induced inhibition of Janus kinase/signal transducer and activator of transcription pathway affects expression of high-mobility group box 1 in rats with acute liver injury. Shijie Huaren Xiaohua Zazhi 2006; 14(19): 1916-1920
- URL: https://www.wjgnet.com/1009-3079/full/v14/i19/1916.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i19.1916
高迁移率族蛋白B1(HMGB1)细胞外释放可作为炎症介质参与炎症反应和组织损伤过程[1-4]. 研究表明, 虽然HMGB1与多种细胞膜上的RAGE受体有较高的亲和力[5], 但也可以通过TLR2, TLR4等受体通路参与对炎症因子转录和表达[6-7]. Li et al[8]与Wang et al[9]发现, 在严重烧伤、烫伤后并发金黄色葡萄球菌感染和腹腔感染所致的大鼠肝脏等器官损伤时, HMGB1可以在转录水平上上调. 并证明了Janus激酶/信号转导和转录激活因子(JAK/STAT)通路与肝组织HMGB1 mRNA 上调有关. Tsung et al[10]在研究肝组织缺血/再灌注时发现肝组织HMGB1表达增强, 但原发性肝损伤动物HMGB1蛋白表达水平及JAK/STAT通路的作用尚不清楚. 我们观察D-Galn/LPS介导的大鼠急性肝损伤时, HMGB1在蛋白表达水平的变化以及JAK/STAT抑制剂--雷帕霉素(RPM)对HMGB1表达和肝损伤的影响.
雌雄各半的清洁级Wistar大鼠90只, 180-220 g(山西医科大学动物实验中心提供), 随机分为3组: (1)急性肝损伤组(ALI组, n = 30): 动物在禁食12 h后同时ip 700 mg/kg D-氨基半乳糖(重庆医科大学生物化学工程学院)和5 μg/kg内毒素(Sigma公司); (2)STAT3抑制剂--雷帕霉素(天津新美科技开发有限公司)干预组(RPM组, n = 30): 于建模前1 h sc雷帕霉素溶液0.6 mg/kg (1 mL); (3)正常组(N组, n = 30): 在相应建模时间点ip等量生理盐水. 各组动物分别于3, 6, 12, 24, 48, 72 h随机取5只动物, 10 g/L的戊巴比妥钠麻醉后, 腹主动脉采血, 加入抑肽酶1 mU/L, 离心将血清分装保存-70 ℃待检测, 并留取肝组织. 一部分肝组织用40 g/L甲醛固定做HE染色, 另一部分冻存在-70 ℃用于肝组织HMGB1的检测.
1.2.1 肝组织HMGB1含量检测: Western blot检测按参考文献[11]操作, 称取各时间点的肝组织100 mg, 于全细胞裂解液中匀浆, 超声处理提取肝组织中的总蛋白, 并测定蛋白浓度, 每个样品取50 mg蛋白以2×上样缓冲液煮沸5 min. 将样品以120 g/L的聚丙烯酰胺凝胶电泳, 并电转移至硝酸纤维素膜上. 50 g/L脱脂奶粉封闭过夜后, 加入1:1000稀释的小鼠抗人HMGB1 mAb(英国Abcam公司), 4 ℃过夜, TBS洗膜后, 加入1:1000稀释的碱性磷酸酶标记的山羊抗小鼠抗体(美国Sigma公司), 室温孵育2 h, TBS洗膜后, BCIP/NBT显色. Mr 30 000处显色条带强弱, 用Image-Pro Plus 5.0凝胶成像分析系统半定量分析, 以显色条带总光密度值(integrated optical density, IOD)表示HMGB1含量.
1.2.2 肝组织病理检查和血浆ALT测定: 使用7170自动生化分析仪测定各实验组血清丙氨酸转氨酶(ALT)水平. 将组织于40 g/L甲醛固定, 石蜡包埋, 5 μm切片, HE染色, 光镜下观察组织形态学变化.
统计学处理 采用SPSS 13.0软件包分析, 所有实验数据均采用mean±SD表示, P<0.05为差异有显著性.
正常动物肝组织HE染色显示肝小叶结构完整, 无肝细胞变性坏死. ALI组: 6 h后有炎细胞浸润和小片状坏死; 24 h后有大片状肝细胞坏死和肝窦内大量充血, 肝细胞边界模糊; 48 h后肝细胞坏死更加明显, 弥漫性炎细胞浸润; 72 h后肝组织发生大块状坏死, 纤维网状支架塌陷. RPM组: 48 h肝细胞发生明显的气球样变, 弥漫性炎细胞浸润; 72 h肝组织病变也比相应ALI组减轻.
正常组各时间点的ALT值无显著性差别. ALI组大鼠ALT在3 h开始升高, 6和24 h出现2个高峰, 24 h出现的峰值明显高于6 h的峰值(P<0.05, P<0.01), 直到72 h ALT水平仍处于高水平. RPM组大鼠ALT在3-24 h之间总的变化趋势与ALI组一致, 但24-72 h ALT水平显著下降, 明显低于ALI组(P<0.01, 表1).
Western blot检测结果成像分析, 因正常大鼠肝组织中可检测到一定量的HMGB1, 所以检测样本HMGB1蛋白相对表达量按如下公式计算: HMGB1蛋白相对表达量 = 各时间点HMGB1带的IOD值/正常组HMGB1带IOD值. ALI组大鼠肝组织HMGB1水平在建模后6, 12 h与正常组比较差异无显著性(P>0.05); 与RPM组比较也无统计学差异(P>0.05). 建模24 h后, ALI组大鼠肝组织HMGB1表达量明显升高(3.12±0.06), 至48, 72 h仍维持较高水平(3.9±0.08, 2.83±0.04), 显著高于正常水平(P<0.01). 而RPM组大鼠肝组织的HMGB1含量24, 48, 72 h明显低于ALI组(1.67±0.05, 1.93±0.06, 1.47±0.04, P<0.01, 图1). 对6只72 h正常组以及ALI组和RPM组各时间点的动物标本的ALT和HMGB1相对含量进行相关性分析(图2). 结果表明, ALT与HMGB1呈正相关(r = 0.741,P<0.01).
既往认为, 早期炎症因子是引起机体失控性炎症反应、组织损伤的关键介质, 但早期炎症因子在体内持续时间很短, 因此人们推测在这些细胞因子下游可能还存在其他细胞因子参与炎症反应. 近期研究表明, 细胞外的HMGB1是内毒素血症和脓毒症时的一种晚期炎症因子[12-13], 也是细胞受损、细胞死亡过程中诱导免疫应答的关键信号[14]. HMGB1特异性抗体或拮抗物对内毒素血症和脓毒症动物具有明显的保护作用[15-17]. 然而, HMGB1是否在急性肝损伤中起作用尚不清楚. 我们的研究发现, 在Galn/LPS诱导的急性肝损伤时, 肝组织中HMGB1蛋白表达明显增强, 并且与肝损伤程度一致, 提示HMGB1在Galn/LPS所致的急性肝损伤病理生理过程中发挥作用. 实验结果还表明, 预先给实验动物sc STAT3抑制剂--雷帕霉素(RPM), 可以明显抑制实验动物在24, 48, 72 h HMGB1蛋白的表达(P<0.01), 并相应的减轻肝组织损伤, 明显降低血清ALT水平(P<0.01). ALT与HMGB1的相关性分析表明两者呈正相关(r = 0.741, P<0.01). 进一步证明, HMGB1作为炎症级联反应(inflammatory cascade)的下游细胞因子在介导进一步肝损伤中的作用.
JAK/STAT信号通路激活不仅广泛参与细胞应激、生长、分化、凋亡等多种生物学过程, 而且参与了多种重要致炎/抗炎因子的信号转导及调控过程. JAK有4个成员, STAT主要有7个成员, 其中STAT3与炎症因子IFN-γ, IL-1, IL-6, IL-10, IL-4关系密切[18-20]. 而HMGB1又与TNF-α, IFN-γ等早期细胞因子可以相互诱生[21-22]. RPM是一种大环内酯类抗生素和免疫抑制剂, 其结构与FK-506相似, 能通过阻断STAT3 727位丝氨酸的磷酸化, 从而抑制STAT3活化和核转位, 进一步下调细胞因子的诱生及病理生理效应[23]. 因此, 本实验中应用的RPM至少可能通过以下途径发挥对Galn/LPS诱导的大鼠急性肝损伤的保护作用: (1)通过抑制JAK/STAT通路, 下调HMGB1蛋白的过度表达[24], 从而减轻其毒性和致炎作用; (2)通过抑制STAT3的活化, 降低TNF-α, IFN-γ, IL-1, IL-6等炎症因子的合成与释放[25], 从而减轻肝组织炎症反应和损伤, 其进一步的机制尚不清楚.
HMGB1作为一种晚期炎症介质具有与TNF-α等重要炎症介质同等重要的促炎作用[26-28]. 但值得指出的是, HMGB1与早期促炎细胞因子相比具有出现晚, 且持续时间长的特点. 因此, HMGB1拮抗物以及抑制其表达和释放药物能扩大抗炎治疗的窗口期, 为有效阻断炎症级联反应(inflammatory cascade)和有效缓解炎症反应提供了靶点和时机. 另外, HMGB1可以通过两种途径释放到细胞外. 肝组织中存在大量可表达HMGB1的巨噬细胞、内皮细胞、中性粒细胞等, 在急性肝损伤时, 既可以由坏死的肝细胞释放HMGB1, 也可以由激活的炎细胞等释放. Galn/LPS介导的急性肝损伤实验动物肝组织HMGB1蛋白表达增加, 是以炎细胞激活主动分泌增加为主, 还是有坏死细胞被动释放为主有待进一步研究.
近年的研究发现,内毒素和细胞因子等刺激巨噬细胞时, HMGB1这种能对DNA重组、修复、复制和基因转录起重要作用的核内结构蛋白会被释放到胞外, 介导炎症反应. JAK/STAT通路是多种细胞因子发挥作用的重要信号通路. HMGB1是否通过JAK/STAT通路参与急性肝损伤病理过程目前尚不完全清楚.
目前研究已证实HMGB1是一种重要的晚期细胞因子, HMGB1与炎症关系密切, 有可能成为炎症病情预测的重要指标及临床治疗的重要靶点. 炎症时, 抑制HMGB1的表达可减轻组织的炎症反应, 提高动物的生存率. 因此有关调节HMGB1表达的信号通路及阻断药物是国内外学者关注的热点.
本实验研究了HMGB1在急性肝损伤模型(ALI)肝组织中的动态变化, 并用JAK/STAT抑制剂雷帕霉素减少了ALI动物肝组织HMGB1的表达, 减轻了肝损伤. 说明HMGB1参与了ALI的病理生理过程, 而且HMGB1表达可通过JAK/STAT信号通路进行调节.
HMGB1是一种晚期炎症介质, 他在炎症中具有出现晚, 持续时间长的特点. 以HMGB1为靶点的抗肝损伤治疗扩大了治疗窗口期; 阻断JAK/STAT通路的药物研究为抗炎治疗提供新的思路.
JAK/STAT: Janus激酶/信号转导和转录激活因子, 是近年发现的在细胞因子信号转导中起重要作用的信号通路. 目前已发现的JAK激酶家族成员有4个, STAT家族成员有6个. 与其他已发现的信号通路相比, 该通路所涉及的激酶较少, 环节简单, 且普遍存在于各型细胞内, 他参与了机体许多病理和生理反应过程.
本文采用JAK/STAT抑制剂-雷帕霉素(RPM)抑制JAK/STAT通路对急性肝损伤大鼠肝组织HMGB1表达, 选题热门、新颖, 具有创新性, 有一定的学术和实际应用价值.
电编: 张敏 编辑:潘伯荣
| 1. | Sun NK, Chao CC. The cytokine activity of HMGB1--extracellular escape of the nuclear protein. Chang Gung Med J. 2005;28:673-682. [PubMed] |
| 2. | Kim JY, Park JS, Strassheim D, Douglas I, Diaz del Valle F, Asehnoune K, Mitra S, Kwak SH, Yamada S, Maruyama I. HMGB1 contributes to the development of acute lung injury after hemorrhage. Am J Physiol Lung Cell Mol Physiol. 2005;288:L958-965. [PubMed] [DOI] |
| 3. | Ueno H, Matsuda T, Hashimoto S, Amaya F, Kitamura Y, Tanaka M, Kobayashi A, Maruyama I, Yamada S, Hasegawa N. Contributions of high mobility group box protein in experimental and clinical acute lung injury. Am J Respir Crit Care Med. 2004;170:1310-1316. [PubMed] [DOI] |
| 4. | Li W, Sama AE, Wang H. Role of HMGB1 in cardiovascular diseases. Curr Opin Pharmacol. 2006;6:130-135. [PubMed] [DOI] |
| 5. | Kokkola R, Andersson A, Mullins G, Ostberg T, Treutiger CJ, Arnold B, Nawroth P, Andersson U, Harris RA, Harris HE. RAGE is the major receptor for the proinflammatory activity of HMGB1 in rodent macrophages. Scand J Immunol. 2005;61:1-9. [PubMed] [DOI] |
| 6. | Park JS, Gamboni-Robertson F, He Q, Svetkauskaite D, Kim JY, Strassheim D, Sohn JW, Yamada S, Maruyama I, Banerjee A. High mobility group box 1 protein interacts with multiple Toll-like receptors. Am J Physiol Cell Physiol. 2006;290:C917-924. [PubMed] [DOI] |
| 7. | Park JS, Svetkauskaite D, He Q, Kim JY, Strassheim D, Ishizaka A, Abraham E. Involvement of toll-like receptors 2 and 4 in cellular activation by high mobility group box 1 protein. J Biol Chem. 2004;279:7370-7377. [PubMed] [DOI] |
| 8. | Li HY, Yao YM, Yao S, Dong N, Yu Y, Sheng ZY. Potential role of JAK/STAT in regulating Toll-like receptor 2 gene expression in rats with postburn Staphylococcus aureus sepsis. Zhongguo Weizhongbing Jijiu Yixue. 2003;15:139-142. [PubMed] |
| 9. | Wang SB, Yao YM, Dong N, Yu Y, Tao GC. Role of Janus kinase/signal transducer and activator of transcription pathway in mediating mRNA expression of high mobility group box1 protein in the liver in septic rats. Zhongguo Weizhongbing Jijiu Yixue. 2003;15:147-149. [PubMed] |
| 10. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] [DOI] |
| 11. | Zi X, Grasso AW, Kung HJ, Agarwal R. A flavonoid antioxidant, silymarin, inhibits activation of erbB1 signaling and induces cyclin-dependent kinase inhibitors, G1 arrest, and anticarcinogenic effects in human prostate carcinoma DU145 cells. Cancer Res. 1998;58:1920-1929. [PubMed] |
| 12. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] [DOI] |
| 13. | Sunden-Cullberg J, Norrby-Teglund A, Rouhiainen A, Rauvala H, Herman G, Tracey KJ, Lee ML, Andersson J, Tokics L, Treutiger CJ. Persistent elevation of high mobility group box-1 protein (HMGB1) in patients with severe sepsis and septic shock. Crit Care Med. 2005;33:564-573. [PubMed] [DOI] |
| 14. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] [DOI] |
| 15. | Mantell LL, Parrish WR, Ulloa L. Hmgb-1 as a therapeutic target for infectious and inflammatory disorders. Shock. 2006;25:4-11. [PubMed] [DOI] |
| 16. | Kokkola R, Li J, Sundberg E, Aveberger AC, Palmblad K, Yang H, Tracey KJ, Andersson U, Harris HE. Successful treatment of collagen-induced arthritis in mice and rats by targeting extracellular high mobility group box chromosomal protein 1 activity. Arthritis Rheum. 2003;48:2052-2058. [PubMed] [DOI] |
| 17. | Ulloa L, Ochani M, Yang H, Tanovic M, Halperin D, Yang R, Czura CJ, Fink MP, Tracey KJ. Ethyl pyruvate prevents lethality in mice with established lethal sepsis and systemic inflammation. Proc Natl Acad Sci USA. 2002;99:12351-12356. [PubMed] [DOI] |
| 18. | Hebenstreit D, Horejs-Hoeck J, Duschl A. JAK/STAT-dependent gene regulation by cytokines. Drug News Perspect. 2005;18:243-249. [PubMed] [DOI] |
| 19. | Kisseleva T, Bhattacharya S, Braunstein J, Schindler CW. Signaling through the JAK/STAT pathway, recent advances and future challenges. Gene. 2002;285:1-24. [PubMed] [DOI] |
| 20. | Cooney RN. Suppressors of cytokine signaling (SOCS): inhibitors of the JAK/STAT pathway. Shock. 2002;17:83-90. [PubMed] [DOI] |
| 21. | Rendon-Mitchell B, Ochani M, Li J, Han J, Wang H, Yang H, Susarla S, Czura C, Mitchell RA, Chen G. IFN-γamma induces high mobility group box 1 protein release partly through a TNF-dependent mechanism. J Immunol. 2003;170:3890-3897. [PubMed] [DOI] |
| 22. | Czura CJ, Yang H, Tracey KJ. High mobility group box-1 as a therapeutic target downstream of tumor necrosis factor. J Infect Dis. 2003;187 Suppl 2:S391-396. [PubMed] [DOI] |
| 23. | Yokogami K, Wakisaka S, Avruch J, Reeves SA. Serine phosphorylation and maximal activation of STAT3 during CNTF signaling is mediated by the rapamycin target mTOR. Curr Biol. 2000;10:47-50. [PubMed] [DOI] |
| 24. | Liu H, Yao YM, Dong YQ, Yu Y, Sheng ZY. The role of Janus kinase-signal transducer and transcription activator pathway in the regulation of synthesis and release of lipopolysaccharide-induced high mobility group box-1 protein. Zhonghua Shaoshang Zazhi. 2005;21:414-417. [PubMed] |
| 25. | Liu H, Yao YM, Yu Y, Sheng ZY. Effect of inhibitors of signal transducer and activator of transcription-1/3 on expression of tumor necrosis factor-alpha induced by high mobility group box-1 protein inflammatory response in rat peritoneal macrophages. Zhonghua Waike Zazhi. 2006;44:193-197. [PubMed] |
| 26. | Park JS, Arcaroli J, Yum HK, Yang H, Wang H, Yang KY, Choe KH, Strassheim D, Pitts TM, Tracey KJ. Activation of gene expression in human neutrophils by high mobility group box 1 protein. Am J Physiol Cell Physiol. 2003;284:C870-879. [PubMed] [DOI] |