修回日期: 2006-05-12
接受日期: 2006-05-17
在线出版日期: 2006-07-08
目的: 研究Tec在大鼠组织中分布特异性, 以及在大鼠肝细胞中Tec可能参与的信号途径.
方法: 从大鼠心、肝、脾、肺、脑、胸腺和肌肉组织中提取RNA, 用Northern blot方法检测Tec在大鼠中的组织分布, 在WBF-344细胞中共转染Tec-pSRα真核表达载体与荧光素酶报道基因, 再用HGF刺激细胞, 用微量发光检测仪检测发光值.
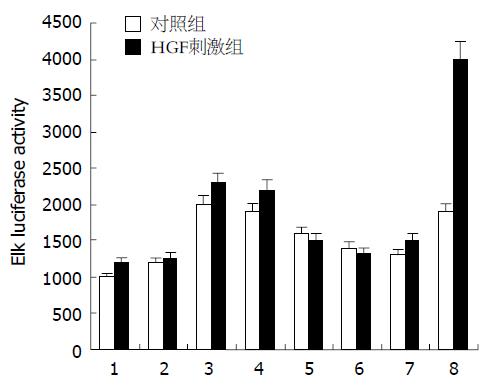
结果: Tec在大鼠肝脏与肾脏组织中特异性高表达, 在肝干细胞中对HGF介导下的Elk信号分子活化的报告质粒中荧光素酶的表达有明显增强(2-3倍)作用.
结论: Tec在大鼠肝脏高表达, Tec可能参与HGF介导Erk途径, 可能与肝细胞增殖的信号调控有关.
引文著录: 钟明贵, 李菲菲, 郑红, 倪芳, 余科科, 汪思应. Tec酪氨酸蛋白激酶的大鼠组织分布及参与的信号途径. 世界华人消化杂志 2006; 14(19): 1874-1877
Revised: May 12, 2006
Accepted: May 17, 2006
Published online: July 8, 2006
AIM: To detect the tissue distribution of Tec tyrosine kinase in rats, and to investigate the possible signal transduction pathways in which Tec is involved.
METHODS: The total RNA was extracted from the tissues of rat heart, liver, spleen, lung, brain, thymus gland and muscle. Northern blot was used to detect the expression of Tec RNA. Reporting gene plasmids and Tec expression vector were co-transfected into WBF-344 cells, and post-transfection cells were stimulated by hepatic growth factor (HGF). Then cells were lysed and the luciferace activity was measured.
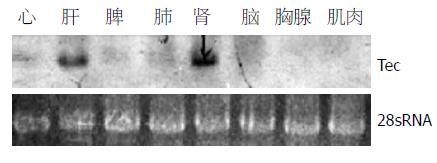
RESULTS: Northern blot suggested that Tec tyrosine kinase was highly expressed in the tissues of rat liver and kidney. Report gene assay showed the Elk luciferase activity was increased about 2-3 folds in comparison with that of the controls, while other signaling pathways had no obviously changes.
CONCLUSION: Tec tyrosine kinase is involved in Erk/mitogen-activated protein kinase signal pathway mediated by HGF. Tec probably plays an important role in the proliferation of liver cells.
- Citation: Zhong MG, Li FF, Zheng H, Ni F, Yu KK, Wang SY. Tissue distribution and signal transduction of Tec tyrosine kinase in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(19): 1874-1877
- URL: https://www.wjgnet.com/1009-3079/full/v14/i19/1874.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i19.1874
Tec (tyrosine kinase expressed in hepatocellular carcinoma, Tec)是一种重要的非受体型酪氨酸激酶, 小鼠Tec最早由Mano et al[1]从肝癌组织中克隆. 前期的研究认为Tec有肝组织与造血组织分布特异性, 主要与Epo, EGF, IL-6, GM-CSF等细胞因子介导的信号转导途径密切相关, 参与调控造血细胞尤其是淋巴细胞的增殖与分化[2-3]. 我们在寻找肝再生相关基因时, 发现了大鼠Tec的序列, 并在GenBank注册(AF285881)[4]. 为进一步探讨Tec与肝细胞生长的关系, 我们进一步在大鼠中检测Tec的组织分布; 再通过荧光素酶报告基因系统, 在肝干细胞WB F-344中瞬时转染Tec真核表达载体及不同信号途径报道载体, 以探讨Tec在何种信号途径活化过程中起作用, 以初步了解Tec参与肝细胞生长的分子机制.
鼠重组肝细胞生长因子(HGF)购于Sigma (Saint Louis, MO, USA). TrizolTM试剂盒购于Promega. DMEM、胰酶为Gibco公司产品, 胎牛血清为Life Technologies公司产品, 荧光素酶报道系统PathDetect in vivo reporting system购于Stratagene (La Jolla, CA, USA), 包括C-Jun, Elk1, CREB, CHOP 4个系统, Reporting lysis buffer购于Sigma, 微量荧光检测仪. Wistar大鼠购于军事医学科学院, 肝干细胞WB F-344, 为中国医学科学院药理所韩锐教授赠送. 培养条件: 高糖DMEM, 100 mL/L胎牛血清(fetal bovine serum, FBS), 37 ℃, 50 mL/L CO2孵箱培养.
各组织总RNA提取使用TrizolTM试剂盒. 取各组织, 剪碎后研磨、过滤、收集细胞. 1 mL Trizol裂解1×107个细胞, 然后加入氯仿200 mL抽提1次, 12 000 g离心15 min, 取上清, 用无水乙醇0.5 mL沉淀, 750 mL/L乙醇洗2次, 干燥后用DEPC处理的无菌去离子水溶解RNA. 紫外分光光度仪测定其浓度, -20 ℃保存. 总RNA 30 µg进行10 mL/L甲醛变性凝胶电泳, 转膜, 膜在65 ℃预杂交1 h, 再加入32P标记的探针杂交过夜. 50 ℃, 0.5×SSC, 5 mL/L SDS洗膜2次, 压X光片, 于-70 ℃放射自显影后洗片.
取对数生长期的WB F-344细胞接种于24孔板(8×104/孔), 待贴壁后按表1不同组分转染WB F-344细胞, 转染后12 h用PBS洗3遍, 再继续用含10 mL/L FBS的DMEM培养12 h后其中一组用HGF (20 g/L)(Promega公司)刺激8-10 h, 对照组不加刺激. 转染过的细胞用PBS洗3遍, 加入1×Reporting Lysis Buffer 100 μL/孔, -80 ℃ 20 min, 37 ℃ 10 min, 60 μL, 4 ℃, 12 000 g离心3 min, 取上清20 μL于反应杯中, 加Luciferase(荧光素酶)反应底物100 μL, 10 s内检测荧光强度以反应Luciferase的活性(Promega试剂盒). 每组3复孔, 实验重复3次.
| A | B | C | D | E | |
| pcDNA-Tec | 428 | 428 | 428 | ||
| pcDNA3.1 | 428 | 428 | |||
| Luciferase reporter vector | 4 | 428 | 428 | 428 | |
| ElK1 or c-Jun or | 21 | 21 | 21 | 21 | |
| CREB or CHOP | |||||
| Dbd | 21 | ||||
| MEK1 or MEKK or PKA or MEK3 | 21 | ||||
| PMD-18 T vector | 407 |
从大鼠心、肝、脾、肺、脑、胸腺和肌肉中提取总RNA, Northern杂交. 结果清楚的显示(与小鼠不同[5]), 在大鼠中Tec不仅在肝脏中高表达, 而且在肾脏中也高表达(图1).
HGF与其细胞表面的受体c-Met结合后, 引起细胞内一系列蛋白酪氨酸磷酸化, 激活多种细胞内信号转导途径, 包括MAPK、PI3K和NF-κB途径等. 为了解Tec是否参与了HGF介导下的某种途径, 我们应用PathDetect in vivo Reporting System, 用代表4条主要信号途径的报道激活质粒pFA-CREB, pFA-ELK, pFA-CHOP, pFA-c-Jun进行普查(图1, 对照组结果未列出), 这些质粒都能编码一种融合蛋白, 该蛋白由酵母GAL4 DNA结合区域和自身激活区域组成, 把他们和Tec以及报道质粒pFR-luc共转入WB F-344中, 假如Tec在HGF刺激下能激活某条途径, 就能与相应的激活质粒相作用, 从而引起pFR-luc激活而转录表达荧光素酶. 我们发现Tec在HGF刺激下能使Elk报道质粒的活性增强2-3倍, 而对另3条途径作用不明显. 空载体对照对4条途径都无明显改变. 重复对Elk的激活作用, 该途径阳性对照质粒pFA-MEK1, 与pFA-Elk, pFR-luc共转能激活该途径, 以其为内对照, 了解转染效率(图2).
Tec酪氨酸蛋白激酶最早从肝组织中发现, 但随后的研究主要认为他与肝再生关系不明确, 因而集中在调控淋巴细胞增殖分化上, 至今关于Tec激酶与肝组织生理病理过程相关的报道很少. 我们在过去的研究中, 发现了2/3肝部分切除后1 h, Tec mRNA再生呈现瞬间表达增加, 其表达水平较其基础水平增高25倍, 4 h后即基本恢复正常; 我们随后筛取胚胎大鼠肝cDNA文库, 获取了大鼠Tec的全长cDNA克隆, 在GenBank注册(AF285881); 在原代培养的大鼠肝细胞体系中, EGF可以迅速诱导Tec基因表达, 且不被蛋白合成抑制剂阻断. 这些结果表明Tec是一种与肝再生调控密切相关的早期反应基因, 他可能参与肝再生的早期信号启动[6]. 尽管Mano et al[1-3]首先报道Tec在肝等组织中表达, 可能与肝细胞增殖、肝癌发生有关, 但在2/3肝切除后72 h, Tec的表达未见明显变化, 因而认为该酪氨酸蛋白激酶可能与肝细胞增殖无关, 其原因可能是与他们选择术后Tec的检测时间有关(没有选择术后2 h以内检测). 随后关于该基因的功能研究主要集中在造血系统[7]. 研究表明Tec与多种蛋白能直接或间接结合, 在造血系统中发挥了多种重要作用: 如在T细胞中参与调节有丝分裂[8]; 诱导Bcl-xL表达、抑制FAS凋亡蛋白从而调节细胞凋亡[9]; 调节Ras家族小G蛋白Rho[10]. 总之, 通过与多种蛋白质的相互作用, Tec参与对血细胞尤其是B淋巴细胞和T淋巴细胞的生长和分化的信号调控[11]. 而本室的研究却提示Tec为肝再生早期相关基因.
肝细胞增殖受很多分子参与精确调控, 目前几乎不了解Tec如何参与肝细胞的信号调控. 我们的另一些研究表明在HGF的诱导或肝大部分切除的刺激下, Tec与Stat3发生同时活化, 提示Tec可能与HGF介导的某些信号途径相关[12]. HGF是一种多功能的细胞活性因子, 他与胚胎的发育、细胞分化增殖、细胞移动、抗凋亡等过程密切相关, 是目前公认的最重要的肝再生启动因子之一. 因此, 我们采用了Stratagene公司PathDetect Trans-reporting Systems(信号途径检测报告基因系统, 包括c-Jun, Elk1, CREB, CHOP 4个系统), 对Tec参与的细胞信号途径进行了初步检测. Tec真核表达载体瞬时转染肝干细胞WB F-344后, 在HGF的诱导下, 使得MAPK(mitogen-activated protein kinase)途径中重要的信号分子Elk活化水平明显升高. 提示Tec很可能参与了HGF介导的Ras-MAPK-ERK1/2信号转导途径. HGF与其细胞表面的受体c-Met结合后, 引起细胞内一系列蛋白酪氨酸磷酸化, 激活多种细胞内信号转导途径, 包括MAPK、PI3K和NF-κB途径等[13]. 其中MAPK途径是与细胞有丝分裂活动关系最密切的一条重要途径, 其中包括3条通路: ERK pathway, p38 pathway与JNK pathway. MAPK的激活可能对决定细胞的命运起重要作用[14], 最终导致细胞分裂增殖、分化及离散等变化.
目前很多研究表明HGF介导下的MAPK途径能明显提高肝细胞增殖和分化的能力, 一些实验还表明造血系统可能是肝干细胞的肝外来源, 典型的造血细胞标志, 包括Thy-1, c-kit和CD34, 均表达在肝卵园细胞的表面[15-17]. 因此我们有理由猜想, 犹如Tec在造血组织中的重要作用一样, Tec可能通过参与Ras-MAPK-ERK1/2途径而最终对肝细胞的增殖和分化起重要的调节作用, 但其精确调控机制有待我们继续深入的研究.
Tec是1990年 Mano et al在研究肝癌时, 从小鼠肝脏的cDNA文库中用v-fps激酶结构域作为探针, 在肝癌组织中筛选到的、起重要作用的一种酪氨酸蛋白激酶基因. Tec基因主要在肝脏与造血组织中表达, 尤其在人类肝细胞肝癌(HCC)中表达异常高, 这是首次报道与肝细胞增殖有关的特异酪氨酸蛋白激酶. 通过与多种蛋白质的相互作用, Tec参与对血细胞尤其是B淋巴细胞和T淋巴细胞的生长和分化的信号调控. 大鼠Tec是本文课题组在2001年首先发现的. 他们利用表达差异显示分析(RDA)技术研究大鼠2/3肝切除后1 h再生肝选择性基因表达时, 发现一株Tec同源序列存在于差减产物中, RNA狭缝杂交证实为差异表达基因. 这提示Tec是一种与肝再生调控密切相关的早期反应基因, 他可能参与肝再生的早期信号启动.
Tec在造血组织和肝组织高表达. 目前, 很多研究已证实他在造血细胞中发挥了多种重要作用, 尤其是B淋巴细胞和T淋巴细胞的生长和分化起了重要作用. 国内外学者的研究主要集中在Tec在造血细胞中的生物学功能方面, 目前研究的热点和重点主要是其参与的信号转导途径及其相互作用的蛋白质的筛选.
尽管Mano et al首先报道Tec在肝等组织中表达, 可能与肝细胞增殖、肝癌发生有关, 但在2/3肝切除后, Tec的表达未见明显变化, 因而认为该酪氨酸蛋白激酶可能与肝细胞增殖无关. 其原因可能是与他们选择术后Tec的检测时间有关(没有选择术后2 h以内检测). 而本文研究是围绕Tec在肝组织中的功能开展的, 发现了在肝大部分切除后1 h其表达水平上调, 并且在肝细胞中参与了HGF信号途径, 体现了一定创新性.
本文属于基础研究, 旨在探讨肝组织中Tec的生物学功能, 将来可能对肝再生和肝细胞增殖的机制起到一定补充作用.
本文创新性较强, 基本阐明了Tec在大鼠体内的分布和可能的信号途径, 起点较高. 不足之处是对Tec信号通路的研究较为单薄.
电编: 张敏 编辑:潘伯荣
| 1. | Mano H, Ishikawa F, Nishida J, Hirai H, Takaku F. A novel protein-tyrosine kinase, tec, is preferentially expressed in liver. Oncogene. 1990;5:1781-1786. [PubMed] |
| 2. | Mano H. Tec family of protein-tyrosine kinases: an overview of their structure and function. Cytokine Growth Factor Rev. 1999;10:267-280. [PubMed] [DOI] |
| 3. | Mano H, Yamashita Y, Sato K, Yazaki Y, Hirai H. Tec protein-tyrosine kinase is involved in interleu-kin-3 signaling pathway. Blood. 1995;85:343-350. [PubMed] |
| 4. | Xu W, Wang S, Wang G, Wei H, He F, Yang X. Identification and characterization of differentially expressed genes in the early response phase during liver regeneration. Biochem Biophys Res Commun. 2000;278:318-325. [PubMed] [DOI] |
| 5. | Sato K, Mano H, Ariyama T, Inazawa J, Yazaki Y, Hirai H. Molecular cloning and analysis of the human Tec protein-tyrosine kinase. Leukemia. 1994;8:1663-1672. [PubMed] |
| 6. | 汪 思应, 王 阁, 许 望翔, 魏 汉东, 杨 晓明. TEC酪氨酸激酶基因是一种与肝再生调控相关的早期反应基因. 中国生物化学与分子生物学报. 2001;17:325-328. |
| 7. | Lucas JA, Miller AT, Atherly LO, Berg LJ. The role of Tec family kinases in T cell development and function. Immunol Rev. 2003;191:119-138. [PubMed] [DOI] |
| 8. | Mayer BJ, Hirai H, Sakai R. Evidence that SH2 domains promote processive phosphorylation by protein-tyrosine kinases. Curr Biol. 1995;5:296-305. [PubMed] [DOI] |
| 9. | Yokohari K, Yamashita Y, Okada S, Ohya K, Oda S, Hatano M, Mano H, Hirasawa H, Tokuhisa T. Isoform-dependent interaction of BRDG1 with Tec kinase. Biochem Biophys Res Commun. 2001;289:414-420. [PubMed] [DOI] |
| 10. | Altman A, Kaminski S, Busuttil V, Droin N, Hu J, Tadevosyan Y, Hipskind RA, Villalba M. Positive feedback regulation of PLCgamma1/Ca(2+) signaling by PKCtheta in restimulated T cells via a Tec kinase-dependent pathway. Eur J Immunol. 2004;34:2001-2011. [PubMed] [DOI] |
| 11. | Pillai S, Moran ST. Tec kinase pathways in lympho-cyte development and transformation. Biochim Biophys Acta. 2002;1602:162-167. [PubMed] |
| 13. | Gohda E. Function and regulation of production of hepatocyte growth factor (HGF). Nippon Yakurigaku Zasshi. 2002;119:287-294, 309. [PubMed] [DOI] |
| 14. | Yang GH, Jarvis BB, Chung YJ, Pestka JJ. Apoptosis induction by the satratoxins and other trichothecene mycotoxins: relationship to ERK, p38 MAPK, and SAPK/JNK activation. Toxicol Appl Pharmacol. 2000;164:149-160. [PubMed] [DOI] |
| 15. | Matsusaka S, Tsujimura T, Toyosaka A, Nakasho K, Sugihara A, Okamoto E, Uematsu K, Terada N. Role of c-kit receptor tyrosine kinase in development of oval cells in the rat 2-acetylaminofluorene/partial hepatectomy model. Hepatology. 1999;29:670-676. [PubMed] [DOI] |
| 16. | Omori N, Omori M, Evarts RP, Teramoto T, Miller MJ, Hoang TN, Thorgeirsson SS. Partial cloning of rat CD34 cDNA and expression during stem cell-dependent liver regeneration in the adult rat. Hepatology. 1997;26:720-727. [PubMed] [DOI] |
| 17. | Petersen BE, Goff JP, Greenberger JS, Michalopoulos GK. Hepatic oval cells express the hematopoietic stem cell marker Thy-1 in the rat. Hepatology. 1998;27:433-445. [PubMed] [DOI] |