修回日期: 2006-04-25
接受日期: 2006-05-11
在线出版日期: 2006-06-18
目的: 探讨苦参碱对大鼠原位肝移植中供肝冷缺血再灌注损伤的保护作用及其机制.
方法: 应用延长保存的大鼠原位肝移植模型, 大鼠224只随机分为对照组、低剂量(40 mg/kg)、高剂量苦参碱治疗组(80 mg/kg)和假手术组, 将供肝在4℃林格液中保存5 h后植入受体, 分别观察移植术后1 wk生存率, 并且检测移植术后1, 2, 4, 24 h血ALT, TNF-α, 内毒素(ET), 透明质酸(HA), 一氧化氮(NO)及肝组织丙二醛(MDA), 超氧化物歧化酶(SOD), 细胞间黏附分子-1(ICAM-1)的含量, 并观察移植肝脏病理形态学的改变.
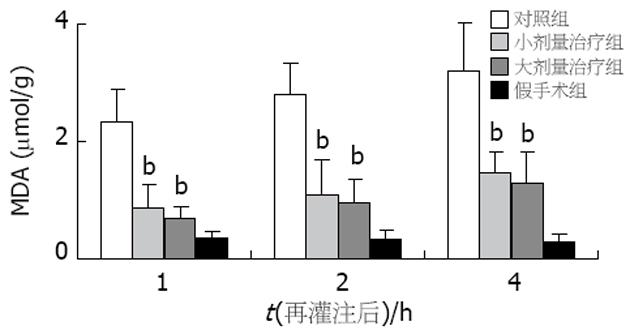
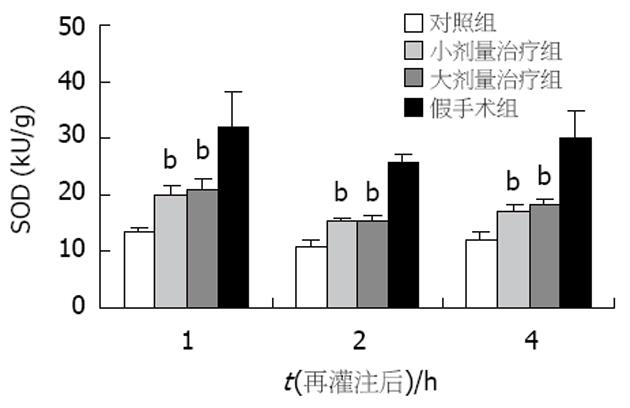
结果: 与对照组比较, 苦参碱低剂量、高剂量治疗组术后1 wk生存率显著增加(75%, 75% vs 0, P<0.01), 肝功能改善, 血清HA (277.62±29.06, 406.84±95.04 μg/L vs 1109.42±110.28 μg/L, P<0.01)和肝组织ICAM-1表达均显著减少, 血清NO含量增加(53.1±5.1, 54.2±4.9 μmol/L vs 30.2±2.3 μmol/L, P<0.01), TNF-a(1.69±0.22, 1.29±0.33 U/L vs 5.96±0.59 U/L, P<0.01)、ET (0.343±0.111, 0.302±0.059 kEU/L vs 0.643±0.110 kEU/L, P<0.01)以及肝组织MDA (0.87±0.41, 0.69±0.22 μmol/g vs 2.35±0.54 μmol/g, P<0.01)水平均明显降低, 肝组织SOD (19.89±1.84, 21.04±1.86 kU/g vs 13.39±0.85 kU/g, P<0.01)水平均明显升高, 肝细胞和肝窦内皮细胞形态也发生改善.
结论: 苦参碱可以通过减轻再灌注后内毒素血症, 抑制库氏细胞激活及释放TNF-α, ICAM-1等炎症性细胞因子, 清除氧自由基, 促进NO合成等途径, 减轻肝细胞及肝窦内皮细胞的损伤.
引文著录: 朱新华, 仇毓东, 史敏科, 丁义涛. 苦参碱对大鼠原位肝移植冷缺血再灌注损伤的保护作用. 世界华人消化杂志 2006; 14(17): 1675-1680
Revised: April 25, 2006
Accepted: May 11, 2006
Published online: June 18, 2006
AIM: To investigate the protective effect of matrine on the cold ischemia and reperfusion (I/R) injury during orthotopic liver transplantation (OLT) and its mechanism in rats.
METHODS: Two hundred and twenty-four syngeneic SD rats were randomly divided into control, matrine, and pseudo-treatment group. The rats in matrine group were treated with low (40 mg/kg) and high dose (80 mg/kg) of matrine respectively. After the donor liver was preserved in Ringer's (LR) solution for 5 h, the orthotopic implantation was performed. The serum and tissue samples were collected for analysis 1, 2, 4 and 24 h after reperfusion of the portal vein, and the one-week survival rate was observed in each group.
RESULTS: In comparison with those in the control group, the levels of ALT decreased significantly in low- and high-dose treatment groups at different times post-transplantation, and their one-week survival rates also increased markedly (75%, 75% vs 0, P < 0.01). Matrine treatment decrease the expression of tissue intercellular adhesion molecule-1 (ICAM-1), serum hyaluronic acid (HA) and the adhesion of inflammatory cells to sinusoidal endothelial cells (SEC), and increased the production of nitric oxide (53.1 ± 5.1, 54.2 ± 4.9 μmol/L vs 30.2 ± 2.3 μmol/L, P < 0.01), resulting in suppression of microcirculation injury caused by hepatic reperfusion. The level of endotoxin (ET) was decreased significantly in low- and high-dose treatment groups (0.343 ± 0.111, 0.302 ± 0.059 kEU/L vs 0.643 ± 0.110 kEU/L, P < 0.01), and matrine markedly inhibited the activation of Kupffer cells and the release of tumor necrosis factor-α (1.69 ± 0.22, 1.29 ± 0.33 U/L vs 5.96 ± 0.59 U/L, P < 0.01), and the content of hepatic malondialdehyde (0.87 ± 0.41, 0.69 ± 0.22 μmol/g vs 2.35 ± 0.54 μmol/g, P < 0.01) were notably decreased. Meanwhile, the activity of superoxide dismutase was elevated notably (19.89 ± 1.84, 21.04 ± 1.86 kU/g vs 13.39 ± 0.85 kU/g, P < 0.01). Matrine treatment markedly ameliorated the focal necrosis of hepatocytes, inflammatory cell aggregation, and detachment of SEC. No significant difference was observed between the treated groups.
CONCLUSION: Matrine can prevent hepatic cells and SEC from cold ischemia and reperfusion injury during orthotopic liver transplantation in rats, and the mechanism is associated with the inhibition of Kupffer cell activation and the release of inflammatory cytokines.
- Citation: Zhu XH, Qiu YD, Shi MK, Ding YT. Effects of matrine on cold ischemia and reperfusion injury during orthotopic liver transplantation in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(17): 1675-1680
- URL: https://www.wjgnet.com/1009-3079/full/v14/i17/1675.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i17.1675
在原位肝移植过程中, 供肝冷保存和门静脉阻断是不可避免的, 研究减轻移植肝脏的再灌注损伤具有重要意义. 供肝冷保存再灌注损伤是一个由多因素参与的复杂的病理过程, 其中肝窦内皮细胞形态和功能的改变可引起肝内微循环障碍, 最终可导致移植肝脏原发性无功能[1-3], 近年研究表明库氏细胞激活释放TNF-α等炎性损伤因子在供肝冷保存再灌注损伤中也发挥着重要作用[4-6]. 苦参碱为中药苦参中提取的有效成分, 其基本结构为苦参次碱-15酮, 具有抗炎、抗氧化、免疫抑制、保肝等作用[7], 临床已广泛用于慢性肝病的治疗. 我们采用大鼠原位肝移植模型, 研究苦参碱对供肝冷缺血再灌注损伤的保护作用, 并对其作用机制进行探讨.
♂健康SD大鼠224只(购自南京军区总医院动物中心), 体质量200±10 g, 随机分为对照组、低剂量治疗组、高剂量治疗组和假手术组. 假手术组有大鼠32只, 其余3组各有大鼠32对. 大鼠原位肝移植模型参照改良Kamada法[8]进行. 各组供肝取出后均置于4℃林格液中保存5 h再植入受体. 受体门静脉阻断时间16-18 min. 低剂量治疗组受体术前0.5 h ip苦参碱(购自广州明兴制药厂)40 mg/kg; 高剂量治疗组术前0.5 h ip苦参碱80 mg/kg; 对照组同法注入生理盐水1 mL; 假手术组方法同肝移植受体的肝脏游离, 只是不作肝切除, 目的是进行正常对照, 以排除手术因素或肝动脉结扎对实验的影响. 各组大鼠于再灌注后1, 2, 4和24 h分别取6只经下腔静脉取血4 mL, 离心(4℃, 3000 r/min) 10 min后, 取上清置于-70℃冰箱保存待测. 同时分别取肝中叶组织适量快速置于液氮中保存待测.
各组分别取8只受体大鼠进行饲养, 观察1 wk存活率. 取各组大鼠再灌注后4和24 h血清, 采用全自动生化分析仪测定ALT.
1.2.1 血清学测定: 分别取各组大鼠再灌注后1, 2, 4和24 h血清, 采用以L929细胞为靶细胞的结晶紫法进行测定, 以kU/L表示. 取各组大鼠再灌注后1和2 h血样采用鲎试剂法测定血浆内毒素(内毒素定量测定试剂盒购自上海医学检测中心). 取各组大鼠再灌注后1, 2和4 h血清, 采用透明质酸放射免疫分析测定盒(购于上海海洋医学生物技术中心)测定血清透明质酸浓度. 取各组大鼠再灌注后1和2 h血清, 采用硝酸还原酶法一氧化氮测定试剂盒(购自南京建成生物工程研究所)测定血清NO2-/ NO3-含量.
1.2.2 肝组织检查: 取各组大鼠再灌注后1, 2和4 h肝组织标本1 g, 制成匀浆后, 采用考马斯亮蓝法进行蛋白定量, 分别采用丙二醛法、黄嘌呤氧化酶法测定MDA, SOD含量(测定试剂盒购自南京建成生物工程研究所). 再灌注后1, 2和4 h分别处死大鼠后取肝中叶组织, OCT胶包埋后, 液氮冻存. 冰冻切片6 μm, 室温放置30 min后, 入4℃丙酮固定10 min, PBS洗, 5 min×3, 30 mL/L过氧化氢孵育5-10 min后, PBS洗, 5 min×2, 下接常规辣根过氧化物酶法免疫组化染色操作步骤. 一抗采用mouse-anti-rat CD54 (ICAM-1)mAb, MCA773(购自英国Serotec公司), 稀释度为1∶50. 再灌注后4 h处死大鼠, 各取前叶肝组织经40 g/L中性甲醛固定、石蜡包埋后切成4 μm薄片, HE染色, 光镜下观察肝脏组织的病理形态学变化. 再灌注后4 h处死大鼠, 各取前叶1-2 mm见方肝组织放入4℃ 20 g/L戊二醛液中固定, 经锇酸后固定, 乙醇脱水, 环氧树脂Epon 618包埋, 用AO-E型超薄切片机超薄切片, 铅铀双染, 在JEM-1200EX型透射电镜下观察.
统计学处理 所有数据以mean±SD表示, 采用SAS软件方差分析Student-Newman-Keuls法进行统计分析.
大鼠原位肝移植手术成功率约为95%, 但对照组8只大鼠都于术后48 h内死亡, 尸体解剖可见腹腔内大量腹水和渗血, 肝脏明显肿大, 且色泽不均, 镜下供肝呈明显的局灶样坏死. 而两苦参碱治疗组大鼠术后的1 wk存活率均达到75%.
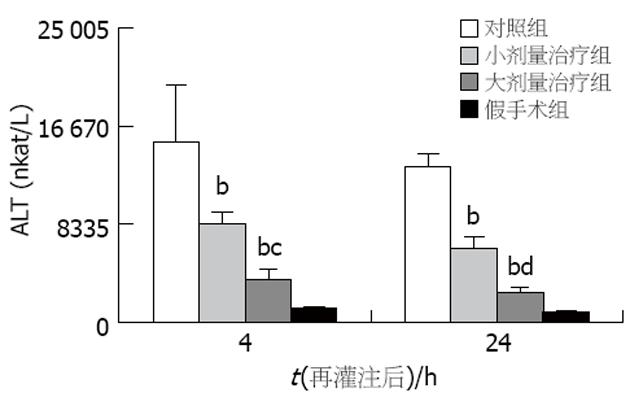
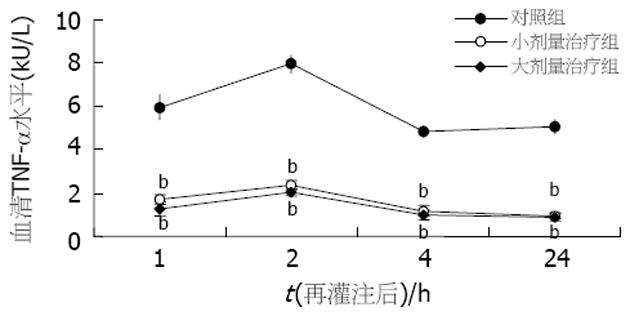
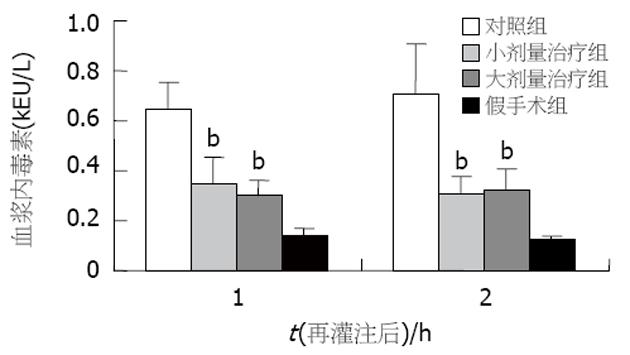
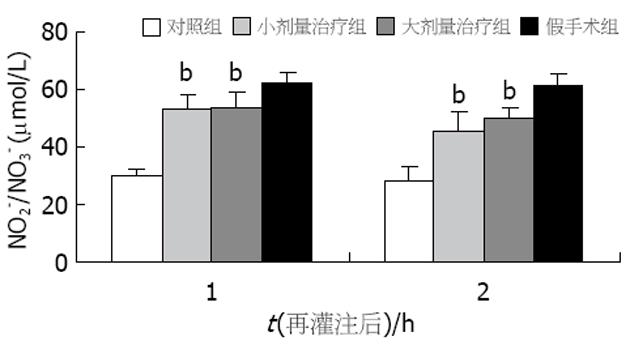
与假手术组比较, 治疗组和对照组移植术后ALT值均升高. 两治疗组术后4和24 h的ALT值均显著低于对照组(P<0.01, 图1), 且两治疗组间术后4和24 h的ALT值也有显著差异(分别为P<0.05和P<0.01). 假手术组血清中未检测出TNF-α活性, 而对照组血清TNF-α活性迅速上升, 再灌注后2 h达到高峰(7.94±0.42 kU/L), 4 h后迅速下降(4.83±0.27 kU/L), 到再灌注后24 h一直维持低水平(5.04±0.33 kU/L). 另两治疗组术后TNF-α活性也在再灌注后2 h达到高峰(图2), 且与对照组相比各时间点的TNF-α活性均有显著降低(P<0.01), 而两治疗组间比较无显著差异. 假手术组术后血中内毒素水平较低(0.137±0.029 kEU/L), 对照组术后1, 2 h内毒素水平分别为0.643±0.110 kEU/L和0.704±0.203 kEU/L(图3). 两治疗组术后1, 2 h内毒素水平均较对照组显著降低(P<0.01), 而两治疗组间比较无显著差异. 与假手术组比较, 治疗组和对照组移植术后各时间点HA值均升高, 且术后HA的高峰均出现在术后2 h. 两治疗组术后各时间点HA值均显著低于对照组(P<0.01), 且两治疗组间术后各时间点HA值也有显著差异(分别为P<0.05和P<0.01, 图4). 与假手术组比较, 治疗组和对照组移植术后各时间点NO2-/NO3-值均降低. 两治疗组术后NO2-/NO3-值均显著低于对照组(P<0.01, 图5), 两治疗组间术后NO2-/NO3-值无显著差异.
与对照组比较, 两治疗组术后各时间点的MDA含量均显著降低(P<0.01, 图6), 而两治疗组间的MDA水平无显著差异. 与对照组比较, 两治疗组术后各时间点的SOD水平均显著升高(P<0.01, 图7), 而两治疗组间的SOD水平无显著差异. 对照组术后1 h即可在肝窦内皮细胞表面、部分肝细胞及肝血窦内出现ICAM-1的表达, 至术后2和4 h更可见ICAM-1的强表达. 两治疗组术后各时间点在类似部位也出现了ICAM-1的表达, 但其表达均明显减弱, 且两组间表达程度未见明显差异. 假手术组肝组织结构基本正常, 对照组可见肝细胞灶性坏死, 伴大量中性粒细胞及单核细胞浸润, 肝窦内皮细胞受损, 与Disse间隙脱离, 枯否氏细胞增生明显. 小剂量治疗组可见少数肝细胞呈空泡变性, 无肝细胞坏死, 炎性细胞浸润明显减少, 枯否氏细胞大致正常. 大剂量治疗组形态学改变与小剂量治疗组相似.
假手术组: 大多数肝细胞、SEC形态和结构基本正常, 未见明显肿胀及凋亡细胞. 对照组: 肝细胞核皱缩, 染色质浓集, 线粒体肿胀, 嵴结构不清, 粗面内质网扩大成指状. SEC明显肿胀, 核膜不规整, 可见核固缩、聚集、着边的凋亡细胞, 线粒体水肿、部分空泡化, 粗面内质网扩张, 可见髓鞘样结构. 内皮细胞向血窦腔内突出, 并可脱落入肝血窦腔内. 血窦腔内可见大量中性粒细胞、淋巴细胞等浸润. 库氏细胞高度活跃, 细胞突起增多, 胞质增宽, 胞质内可见许多吞噬溶酶体、透明的空泡和颗粒, 细胞核形态不规则. 小剂量治疗组: 肝细胞核圆居中, 线粒体和粗面内质网结构清晰. SEC核膜稍显不规整, 伸展部变薄, 但覆盖完整. 内皮细胞轻度水肿, 溶酶体增多, 粗面内质网无扩张, 吞饮小泡丰富, SEC损伤明显减轻. 血窦腔内炎性细胞浸润的程度和范围也明显轻于对照组. 枯否氏细胞呈圆形, 突起减少, 细胞核规则, 胞质内容物减少. 大剂量治疗组: SEC损伤仍存在, 其与肝细胞、枯否氏细胞的超微结构改变与小剂量治疗组类似.
冷缺血再灌注损伤是缺血再灌注损伤的特殊类型, 在现代临床肝移植中越来越显出其重要性. 以往研究表明在肝脏的再灌注期, 枯否氏细胞大量激活, 释放一系列的炎性损伤因子, 导致肝窦内皮细胞损伤及肝功能受损[1,9-10]. 在冷保存期间导致再灌注损伤的因素已经存在, 而在再灌注期通过某种途径激活相关损伤因子, 导致肝脏损伤[11-12]. 我们将苦参碱作用于再灌注期, 以期能打断这种途径, 保护肝组织免受再灌注损伤. 大鼠肝脏在4℃平衡液中保存的安全时限为2-4 h[13], 为探讨苦参碱对供肝冷缺血再灌注损伤是否有保护性作用, 我们采用将供肝于移植术前置于4℃平衡液中保存5 h, 再移植入受体的大鼠原位肝移植模型, 观察苦参碱对大鼠移植术后1 wk生存率及肝细胞形态及功能的影响. 实验结果表明, 苦参碱对移植肝脏有明显的保护作用, 能显著的改善大鼠肝功能和移植术后1 wk存活率. 在本实验中, 对照组大鼠均于术后48 h内死于肝功能衰竭, 1 wk生存率为0%, 而两治疗组大鼠的1 wk存活率均达到75%. 对照组大鼠死后尸体解剖可见腹腔内有大量腹水和渗血, 肝脏明显肿胀, 且颜色深浅不一, 镜下肝脏呈明显的局灶样坏死, 符合其死于移植术后原发性移植肝无功能的表现. 另外, 治疗组的肝功能指标ALT有明显的改善, 并且对再灌注后4 h肝组织光镜和电镜检查也显示治疗组的肝脏枯否氏细胞激活及炎性细胞浸润明显减少, 肝细胞及肝窦内皮细胞损伤程度明显减轻. 随着苦参碱剂量的增加, 其对肝细胞和肝窦内皮细胞的保护作用没有明显增强, 这与Zhang et al[14]研究结果相一致, 并且实验过程中并未发现大剂量运用苦参碱的毒性.
肝移植缺血再灌注中, 枯否氏细胞被激活后可产生TNF等炎性细胞因子, 同时释放出大量的氧自由基, 从而在肝脏再灌注损伤中发挥重要作用[5-6,15]. 我们的研究结果表明, 对照组移植术后内毒素血症明显, 枯否氏细胞呈现激活状态, 并且TNF-α随之显著升高, 伴随着肝细胞及肝窦内皮细胞明显受损. 与之相比, 两苦参碱治疗组的血浆内毒素水平明显降低, 伴随着血清TNF-α活性及肝组织中TNF-α含量的显著减少, 并且枯否氏细胞增生活跃程度及炎性细胞浸润也明显减轻. 同时, 苦参碱能增强机体清除氧自由基和抗脂质氧化的能力.
肝血窦内皮细胞损伤及顺应性改变可致肝血窦阻塞, 再灌注障碍, 从而使肝组织细胞仍处于缺血状态, 损伤进一步加重发展[16-17]. 因此, 在肝移植缺血再灌注损伤过程中, 保护内皮细胞和保护肝细胞同样重要[18-20], 这对于防止移植肝脏微循环障碍, 术后发生"无复流"等现象, 最终导致原发性移植肝无功能具有重要临床意义[3,21-23]. 结果表明, 治疗组术后各时间点反映肝窦内皮细胞功能和活力的指标-血HA浓度及肝脏ICAM-1的表达均较对照组明显下降, NO含量显著增加, 肝窦腔内淤血及炎性细胞浸润明显减轻, 并且SEC损伤的超微结构改变也有相应改善. 随着苦参碱剂量的增加, 通过对血HA浓度分析其对SEC的保护作用反而有所降低, 但实验过程中并未发现大剂量运用苦参碱的副作用.
苦参碱具有抗炎、抗氧化、免疫抑制、保肝等作用[7], 苦参碱可以通过减轻再灌注后内毒素血症, 抑制枯否氏细胞激活及释放TNF-α, IL-1, IL-6, ICAM-1等炎症性细胞因子, 清除氧自由基, 促进NO合成等途径, 减少粒细胞与SEC的黏附, 从而减轻肝细胞及SEC的损伤, 改善移植肝脏微循环, 减轻供肝冷保存再灌注损伤. 苦参碱作为药物的单体成分, 其化学结构、药代动力学、药效学及药理作用机制明确, 副作用很小, 并已制备出多种剂型供临床选用, 临床应用前景较广泛.
如何防治供肝冷保存再灌注损伤一直是肝移植领域的研究热点, 而临床广泛应用的苦参碱药理学结构明确, 具有抗炎、抗氧化、免疫抑制、保肝等作用, 本文作者在前期的研究中已明确其对供肝的冷保存再灌注损伤具有保护作用, 本文进一步对其分子生物学作用机制进行探讨.
供肝冷保存再灌注损伤及防治一直是肝移植领域的研究难点, 其中肝窦内皮细胞损伤及微循环障碍机制正成为研究热点. 苦参碱免疫抑制、抗炎抗氧化等药理学作用在移植领域的应用正日益受到人们的关注.
本研究在国内首次将苦参碱应用于防治供肝冷保存再灌注损伤的基础研究, 并且对分子生物学作用机制进行深入探讨.
苦参碱作为药物的单体成分, 其化学结构、药代动力学、药效学及药理作用机制明确, 副作用很小, 并已制备出多种剂型供临床选用, 临床应用前景较广泛.
本文行文规范, 研究对象为当前的热点, 采用传统中药治疗肝移植后缺血再灌注, 对于中药现代化和深入挖掘中药的分子生物学作用机制进行了有益的探索, 是一篇较好的实验论文.
电编: 张敏 编辑:潘伯荣
| 1. | Huet PM, Nagaoka MR, Desbiens G, Tarrab E, Brault A, Bralet MP, Bilodeau M. Sinusoidal endothelial cell and hepatocyte death following cold ischemia-warm reperfusion of the rat liver. Hepatology. 2004;39:1110-111. [PubMed] [DOI] |
| 2. | Emadali A, Nguyen DT, Rochon C, Tzimas GN, Metrakos PP, Chevet E. Distinct endoplasmic reticu-lum stress responses are triggered during human liver transplantation. J Pathol. 2005;207:111-118. [PubMed] [DOI] |
| 3. | Kupiec-Weglinski JW, Busuttil RW. Ischemia and reperfusion injury in liver transplantation. Transplant Proc. 2005;37:1653-1656. [PubMed] [DOI] |
| 4. | Shimizu H, Miyazaki M, Ito H, Nakagawa K, Ambiru S, Kato A, Nukui Y, Nozawa S, Nakajima N. Mechanism of cold ischemia-reperfusion-induced graft injury after orthotopic liver transplantation in rats. Hepatogastroenterology. 2001;48:216-219. [PubMed] |
| 5. | Peng Y, Gong JP, Liu CA, Li XH, Gan L, Li SB. Expression of toll-like receptor 4 and MD-2 gene and protein in Kupffer cells after ischemia-reperfu-sion in rat liver graft. World J Gastroenterol. 2004;10:2890-2893. [PubMed] [DOI] |
| 6. | Rentsch M, Puellmann K, Sirek S, Iesalnieks I, Kienle K, Mueller T, Bolder U, Geissler E, Jauch KW, Beham A. Benefit of Kupffer cell modulation with glycine versus Kupffer cell depletion after liver transplantation in the rat: effects on postischemic reperfusion injury, apoptotic cell death graft regeneration and survival. Transpl Int. 2005;18:1079-1089. [PubMed] [DOI] |
| 9. | Puhl G, Schaser KD, Pust D, Kohler K, Vollmar B, Menger MD, Neuhaus P, Settmacher U. Initial hepatic microcirculation correlates with early graft function in human orthotopic liver transplantation. Liver Transpl. 2005;11:555-563. [PubMed] [DOI] |
| 10. | Mueller TH, Kienle K, Beham A, Geissler EK, Jauch KW, Rentsch M. Caspase 3 inhibition improves survival and reduces early graft injury after ischemia and reperfusion in rat liver transplanta-tion. Transplantation. 2004;78:1267-1273. [PubMed] [DOI] |
| 11. | Gu XP, Qiu YD, Xu FT, Jiang Y, Ding YT. In vivo suppressive effect of nuclear factor-kappaB inhibitor on neutrophilic inflammation of grafts after orthotopic liver transplantation in rats. World J Gastroenterol. 2004;10:3654-3658. [PubMed] [DOI] |
| 12. | Kudo A, Kashiwagi S, Kajimura M, Yoshimura Y, Uchida K, Arii S, Suematsu M. Kupffer cells alter organic anion transport through multidrug resistance protein 2 in the post-cold ischemic rat liver. Hepatology. 2004;39:1099-1109. [PubMed] [DOI] |
| 13. | Sumimoto R, Jamieson NV, Wake K, Kamada N. 24-hour rat liver preservation using UW solution and some simplified variants. Transplantation. 1989;48:1-5. [PubMed] [DOI] |
| 14. | Zhang JP, Zhang M, Jin C, Zhou B, Xie WF, Guo C, Zhang C, Qian DH. Matrine inhibits production and actions of fibrogenic cytokines released by mouse peritoneal macrophages. Acta Pharmacol Sin. 2001;22:765-768. [PubMed] |
| 15. | Vajdova K, Heinrich S, Tian Y, Graf R, Clavien PA. Ischemic preconditioning and intermittent clamping improve murine hepatic microcirculation and Kupffer cell function after ischemic injury. Liver Transpl. 2004;10:520-528. [PubMed] [DOI] |
| 16. | Li XL, Man K, Ng KT, Sun CK, Lo CM, Fan ST. The influence of phosphatidylinositol 3-kinase/Akt pathway on the ischemic injury during rat liver graft preservation. Am J Transplant. 2005;5:1264-1275. [PubMed] [DOI] |
| 17. | Chung KY, Jeong GY, Choi KB, Sung SH, Kim YS. Prevention of primary nonfunction after canine liver allotransplantation: the effect of gadolinium chloride. Transplant Proc. 2004;36:1928-1930. [PubMed] [DOI] |
| 18. | Que X, Debonera F, Xie J, Furth EE, Aldeguer X, Gelman AE, Olthoff KM. Pattern of ischemia reperfusion injury in a mouse orthotopic liver transplant model. J Surg Res. 2004;116:262-268. [PubMed] [DOI] |
| 19. | Gong JP, Tu B, Wang W, Peng Y, Li SB, Yan LN. Protective effect of nitric oxide induced by ischemic preconditioning on reperfusion injury of rat liver graft. World J Gastroenterol. 2004;10:73-76. [PubMed] |
| 20. | Lanteri R, Greco R, Licitra E, Di Benedetto F, Li Destri G, Di Cataldo A. Ischemia and hepatic reper-fusion: is it possible to reduce hepatic alterations? Microsurgery. 2003;23:458-460. [PubMed] [DOI] |
| 21. | Miyagawa Y, Imamura H, Soeda J, Matsunaga K, Mochida S, Fujiwara K, Matsuyama Y, Kawasaki S. Fate of hepatocyte and sinusoidal lining cell function and kinetics after extended cold preser-vation and transplantation of the rat liver. Liver Transpl. 2002;8:370-381. [PubMed] [DOI] |
| 22. | Hines IN, Harada H, Wolf R, Grisham MB. Superoxide and post-ischemic liver injury: potential therapeutic target for liver transplantation. Curr Med Chem. 2003;10:2661-2667. [PubMed] [DOI] |
| 23. | Jaeschke H. Molecular mechanisms of hepatic ischemia-reperfusion injury and preconditioning. Am J Physiol Gastrointest Liver Physiol. 2003;284:G15-26. [PubMed] [DOI] |