修回日期: 2006-02-21
接受日期: 2006-03-07
在线出版日期: 2006-06-08
目的: 检测Survivin反义寡核苷酸(ASODN)在人肝癌耐药细胞株裸鼠皮下移植瘤中的表达情况.
方法: 将30只裸鼠建立人肝癌耐药细胞系SMMC-7721/ADM皮下移植瘤模型, 随机分成6组: 空白对照组(A)、脂质体转染对照组(B)、正义链对照组(C)、200(D)、400(E)和600 mg/L(F)反义链组(ASODN组), 用不同的转染液注射后2, 4, 8, 12, 16, 20 d, 用逆转录聚合酶链反应技术(RT-PCR)和Western blot蛋白免疫印迹法检测治疗后各组肿瘤组织中Survivin mRNA和蛋白表达的变化.
结果: 注射后20 d, ASODN组肿瘤细胞生长明显抑制, 空白对照组、脂质体转染对照组和正义链对照组裸鼠的mRNA和蛋白表达无明显差异, 而ASODN组mRNA和蛋白表达随着时间和浓度的增加, Survivin表达减弱, E, F组与其余个组(A, B, C, D)相比有显著差异(mRNA: 0.33±0.04, 0.28±0.03 vs 0.82±0.02, 0.78±0.05, 0.72±0.04, 0.57±0.03, P<0.05; 蛋白: 34.9±3.89, 21.2±3.65 vs 72.14±6.53, 69.31±5.34, 68.29±4.98, 53.8±5.23, P<0.05).
结论: Survivin反义寡核苷酸能够下调Survivin mRNA和蛋白的表达, 抑制裸鼠皮下移植瘤的生长.
引文著录: 高鹏, 张刚庆, 颜政, 方驰华. Survivin反义寡核苷酸抑制肝癌移植瘤生长的作用. 世界华人消化杂志 2006; 14(16): 1627-1630
Revised: February 21, 2006
Accepted: March 7, 2006
Published online: June 8, 2006
AIM: To explore the effects of liposomes Survivin antisense oligonucleotides (ASODN) on the growth of human hepatic carcinoma transplanted subcutaneously in nude mice.
METHODS: Human hepatic carcinoma transplanted subcutaneously was established in nude mice. Then the animals were randomly divided into 6 groups: control group (A), liposome group (B), sense oligonucleotide (SODN) group (C), 200 (D), 400 (E) and 600 mg/L (F) ASODN group. After treatment with the corresponding methods for 2, 4, 8, 12, 16, 20 d, the expression of Survivin mRNA and protein detected by reverse transcription-polymerase chain reaction and Western blot, respectively.
RESULTS: The growth of the tumors was significantly inhibited in all ASODN groups as compared with that in the control, liposome and SODN group after treatment for 20 d. The number of apoptotic cells in ASODN group increased and Survivin expression became weakened. The expression of Survivin was significantly lower in group E and F than those in group A, B, C, and D (mRNA: 0.33 ± 0.04, 0.28 ± 0.03 vs 0.82 ± 0.02, 0.78 ± 0.05, 0.72 ± 0.04, 0.57 ± 0.03, P < 0.05; protein: 34.9 ± 3.89, 21.2 ± 3.65 vs 72.14 ± 6.53, 69.31 ± 5.34, 68.29 ± 4.98, 53.8 ± 5.23, P < 0.05).
CONCLUSION: Survivin ASODN can inhibit the growth of human hepatic carcinoma in nude mice by inducing cell apoptosis and decreasing Survivin expression.
- Citation: Gao P, Zhang GQ, Yan Z, Fang CH. Inhibitory effect of Survivin antisense oligonucleotide on growth of human hepatic carcinoma transplanted subcutaneously. Shijie Huaren Xiaohua Zazhi 2006; 14(16): 1627-1630
- URL: https://www.wjgnet.com/1009-3079/full/v14/i16/1627.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i16.1627
Survivin是近年来发现的凋亡抑制蛋白(inhibitor of apoptosis proteins, IAP)家族的一个新成员, 他可以通过有丝分裂促进细胞增殖、抑制细胞凋亡. 研究表明, Survivin在肝癌等肿瘤细胞中表达较高, 应用Survivin反义寡核苷酸在体外可明显抑制肝癌细胞的生长. 已有研究表明肝癌细胞的耐药性与Survivin基因的抗凋亡作用密切相关[1-2]. 我们通过应用Survivin反义寡核苷酸作用人肝癌耐药细胞裸鼠移植瘤, 观察治疗后各组肿瘤组织中Survivin mRNA和蛋白表达的变化及其对移植瘤生长的影响.
人肝癌耐药细胞株SMMC-7721/ADM由南方医科大学药理教研室饶进军教授提供; 阳离子脂质体(LipofectamineTM2000)购自Invitrogen公司; 羊抗人Survivin多克隆抗体为SantaCruz(美国)公司产品; 辣根过氧化物酶标记的兔抗羊IgG购自北京中山生物工程公司; ECL显色试剂盒购自武汉亚法生物工程公司; Trizol购于Gibco公司; RT-PCR一步法试剂盒为TaKaRa公司产品; Western blot试剂盒购于博士德公司. 4-6周龄BALB/C裸小鼠, 体质量19.2±1.3 g, 由南方医科大学实验动物中心提供, 饲养于SPF级无菌饲养室, 用高压灭菌的饮用水和饲料定期喂养. Survivin正、反义寡核苷酸的设计、合成: 根据Survivin的基因序列(GenBank Accession Number U75285), 应用Primer5.0软件设计互补于Survivin mRNA的232-251序列的20个碱基组成的ASODN链: 5'-CCCAGCCTTCCAGCTCCTTG-3', 同时合成正义链: 5'- CGCAGTAGCTGCGCTGATTG-3', 两条序列每端5个磷酸基采用硫代修饰. 在GenBank中证实反义寡核苷酸(ASODN)及正义寡核苷酸(SODN)与任何已知哺乳动物基因无匹配. ASODN 5'端以绿色荧光蛋白标记, 由上海生工公司合成.
水浴复苏人肝癌耐药细胞株SMMC-7721/ADM后接种于30 mL培养瓶, 在37 ℃, 50 mL/L CO2培养箱中用含100 mL/L小牛血清的RPMI 1640培养液常规培养, 胰蛋白酶消化细胞并计数, 制成3.5×108/L的细胞悬液备用. 将对数生长期的人肝癌细胞SMMC-7721/ADM制成单细胞悬液, 浓度调整为3.5×108/L, 分别取0.2 mL接种于每只裸鼠背部靠左后肢处, 建立裸小鼠人肝癌模型. 接种后每天观察注射点有无破溃红肿, 以皮下结节直径超过0.5 cm为成瘤标准. 将30只成瘤后的裸小鼠随机分成6组: A组: 空白对照组; B组: 脂质体转染对照组; C组: 脂质体SODN对照组; D组: 200 mg/L ASODN; E组: 400 mg/L ASODN; F组: 600 mg/L ASODN. 各组均于成瘤后2 d向瘤体内直接注射相应的脂质体、脂质体与正义寡核苷酸、不同浓度的反义寡核苷酸制成的转染复合物0.2 mL, 观察裸小鼠皮下移植瘤生长情况及裸小鼠体质量变化. 注射前室温下先将脂质体溶于转染液中静置45 min, 然后与相应的寡核苷酸混合包裹静置15 min. 第20天将裸小鼠处死, 将处死后的裸小鼠部分肿瘤组织用40 g/L多聚甲醛固定, 标本经石蜡包埋后连续4 mm切片, HE染色, 光镜下观察人肝癌移植瘤细胞形态变化. 免疫组织化学检查方法检测Survivin的表达: 一抗为羊抗人Survivin多克隆抗体, 工作浓度1:1000; 二抗为辣根过氧化物酶标记兔抗羊IgG, 工作浓度1:4000, 按试剂盒说明进行操作.
1.2.1 Western blot检测移植瘤细胞Survivin蛋白表达: 第20天将裸小鼠处死后, 取50 mg肿瘤组织匀浆后离心, 取上清液移植瘤细胞1×106个. 加入预冷至4 ℃的50 mL裂解缓冲液. 用40 mg/孔上样, 120 g/L十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离, 通过电转移法将蛋白质从SDS-PAGE凝胶转移至硝酸纤维素膜后在含50 g/L脱脂奶粉的TTBS中37 ℃封闭90 min, 加入一抗(1:1000羊抗人生存素抗体)4 ℃孵育过夜, TTBS漂洗后(10 min×3次), 加入二抗(辣根过氧化物酶标记的1:4000兔抗羊IgG), 37 ℃作用40 min, TTBS充分漂洗(10 min×3次), 洗膜后加入增强化学发光底物ECL试剂. X线片暗室曝光, 常规显影、定影. 图像以Bio Rad图像分析系统分析, 用蛋白条带的平均光强度值表示生存素蛋白表达的相对强度.
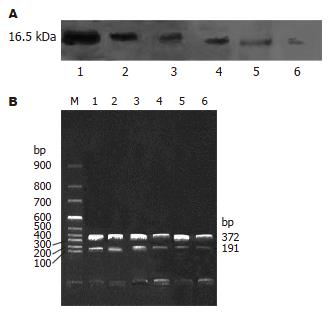
1.2.2 RT-PCR法检测移植瘤细胞生存素mRNA表达: 裸鼠处死后, 取50 mg肿瘤组织, 匀浆离心后取移植瘤细胞1×106个. 提取总RNA, 紫外分光光度计检验纯度并定量. 设GAPDH为内参照, 对样品模板用量标准化, Survivin和GAPDH分管扩增, 引物由上海生工公司合成. 设计Survivin上游引物序列为5'CACCGCATCTCTACATTCAA3', 下游引物序列为5'CACTTTCTTCGCAGTTTCCT3', 扩增片段长度为191 bp; 内对照基因GADPH, 上游引物序列为5'CTCAGACACCATGGGGAAGGTGA3', 下游引物序列为5'ATGACTTGAGGCTGTTGTCATA3', 扩增片段长度为372 bp. 采用一步法RT-PCR检测Survivin mRNA的表达, 50 ℃ 30 min完成反转录, 94 ℃预变性2 min后进入PCR循环, 94 ℃变性30 s, 60 ℃复性30 s, 72 ℃延伸1.5 min, 共30个循环. PCR产物8 mL在琼脂糖凝胶上电泳, 经凝胶图像分析仪分析结果, 以Survivin和GAPDH的比值作为Survivin mRNA的相对含量.
统计学处理 各组实验数据以mean±SD表示, 采用SPSS 10.0统计软件进行分析, 多个样本间比较行单因素方差分析.
各组裸小鼠接种人肝癌耐药细胞系SMMC-7721/ADM单细胞悬液后均存活并有肿瘤形成, 接种点无红肿破溃表现, 成瘤时间为13.5±2.1 d, 移植瘤体积为72.5±6.7 mm3. 移植瘤HE染色后, 光镜下见各对照组人肝癌移植瘤细胞密集成群, 细胞多为多边形, 核大深染. 而各ASODN实验组可见肿瘤细胞较少, 分布稀疏, 有变性的液化坏死灶, 癌细胞皱缩变圆, 胞核固缩, 核深染. 免疫组化染色后见对照组Survivin蛋白主要位于肝癌细胞质, 表达较强, 呈棕黄色颗粒, 癌周组织无表达. 而ASODN实验组则明显可见Survivin蛋白表达降低, 数量减少, 颜色变淡.
Western blot显示Survivin蛋白在移植瘤细胞中有高度表达(图1A). A, B, C和D组之间Survivin蛋白表达无明显差异(P>0.05). E和F组蛋白表达较A, B, C和D组显著降低(P<0.05, 表1).
| 分组 | Survivin mRNA | Survivin蛋白 |
| A | 0.82±0.02 | 72.14±6.53 |
| B | 0.78±0.05 | 69.31±5.34 |
| C | 0.72±0.04 | 68.29±4.98 |
| D | 0.57±0.03 | 53.8±5.23 |
| E | 0.33±0.04 | 34.9±3.89 |
| F | 0.28±0.03 | 21.2±3.65 |
Survivin基因由Ambrosini et al[3]于1995年发现并克隆, 定位于人染色体17q25, 其编码含142个氨基酸、相对分子质量为16.5 kDa的蛋白质. 他表达于细胞周期的G2/M期, 作用于细胞有丝分裂的纺锤体, 是细胞内凋亡抑制蛋白家族的一个新成员. 已经证明, 绝大多数的恶性肿瘤都高表达Survivin, 而在正常分化成熟的组织中几乎不表达. Survivin基因在多数肿瘤组织中呈高表达, 且与组织分化平衡有关, 即具有肿瘤选择性的特点[4-6]. Ikeguchi et al[7]对Survivin在肝癌中的表达及相关性进行了分析, 发现Survivin基因与肝癌的形成和发展有着较大关系, 他在正常肝组织基本不表达, 而在肝癌中却表达较高, 他不但是早期发现肝癌的一个较好的标志物, 也是判断预后的较佳指标. 因此Survivin可能是一个理想的肝癌基因治疗靶点. 应用反义核酸技术治疗肿瘤是根据碱基互补机制, 用人工合成的特定DNA或RNA片段ASODN分子与进入细胞质的mRNA上的特定位点相结合, 形成DNA-RNA复合物, 抑制mRNA与核糖体结合, 同时激活RNA降解酶H, 降解mRNA, 从而抑制或封闭基因的表达, 干扰致病蛋白质的产生[8]. 采用Survivin ASODN进行抗癌治疗具有广谱性和副作用小的特点[9-11]. 我们采用反义技术, 针对Survivin基因合成一段长20个碱基的ASODN, 采用硫代磷酸修饰、脂质体包裹来增强其稳定性和抗酶解能力. 将其直接注射于人肝癌耐药细胞裸鼠皮下移植瘤内, 发现对照组裸鼠皮下移植瘤无明显抑制, 肿瘤呈持续性增长; 而脂质体ASODN则能明显地抑制移植瘤的生长, 肿瘤呈进行性缩小, 提示Survivin ASODN在体内实验中可以有效的抑制移植瘤的生长, 并且具有明显的时效性和剂量依赖性. 而HE染色及免疫组化结果则显示, ASODN组液化坏死灶增多, 凋亡细胞增加, Survivin表达减少、减弱. 这提示Survivin ASODN对肝癌移植瘤的生长抑制作用可能是通过解除Survivin对癌细胞的凋亡抑制作用, 使增殖细胞减少, 坏死细胞增多, 移植瘤体积缩小所致. 研究中发现, Survivin ASODN确实能够有效地封闭移植瘤Survivin基因的表达, 而SODN、脂质体组均对Survivin表达无影响. 这说明三种浓度的ASODN可以通过降低Survivin蛋白及mRNA的表达, 诱导细胞凋亡来阻止肝癌细胞的生长.
总之, Survivin反义寡核苷酸能够通过诱导人肝癌裸鼠皮下移植瘤细胞凋亡, 下调Survivin mRNA和蛋白的表达, 抑制裸鼠皮下移植瘤的生长. 以Survivin为靶基因, 利用反义技术治疗肿瘤可望成为一种有效的基因治疗方法.
手术切除是肝癌治疗的首选方法, 而化疗仍为其主要方法. 对化疗药物产生耐药性是肝癌治疗的一大难题, 也是综合治疗效果欠佳的重要原因. Survivin是近年发现的一种抑制细胞凋亡分子家族成员, 仅特异性地表达于肿瘤组织, Survivin基因治疗具有良好的靶向性、特异性及安全性. Survivin反义寡核苷酸具有抑制癌基因表达异常或诱导肿瘤细胞凋亡的作用, 可以促进肿瘤细胞凋亡并抑制其增殖, 而对正常组织几乎没有不良影响; Survivin还可以通过直接抑制凋亡信号转导过程中最下游的效应分子Caspase-3的活性而阻断凋亡的发生过程, 并降低肿瘤细胞对许多化疗药物的敏感性.
本研究通过动物模型, 对survivin反义寡核苷酸(ASODN)作用耐药肝癌细胞, 及对耐药肝癌细胞化疗的影响方面进行探讨, 为提高肝癌的治疗效果及化疗药物的敏感性寻找新的靶点及思路.
通过动物实验验证Survivin反义寡核苷酸可有效的抑制人耐药肝癌细胞SMMC-7721/ADM裸鼠皮下肿瘤的生长, 促进诱导肿瘤细胞的凋亡, 而对正常细胞无明显影响, 具有良好的靶向性、特异性及安全性. 可以成为抗肿瘤治疗的新的靶点.
反义技术(anti-sense technology): 是根据碱基互补原理, 用人工合成或生物合成的特定的互补DNA或RNA片段及其化学修饰产物结合目的基因或mRNA上特定的序列(靶核酸), 阻断从基因到蛋白的信息流, 以达到阻断或抑制基因的转录或翻译的技术.
已有研究显示Survivin基因在肝癌中高表达, 可能是早期诊断与预后判断的指标之一. 本文为体外实验研究, 利用反义技术, 观察了对人肝癌耐药细胞裸鼠皮下移植瘤的抑制作用、机制为诱导癌细胞凋亡, 下调Survivin mRNA和蛋白的表达, 为基因靶向治疗提供了实验依据, 是有一定意义.
电编: 张敏 编辑:潘伯荣
| 1. | Sui L, Dong Y, Watanabe Y, Yamaguchi F, Sugimoto K, Tokuda M. Alteration and clinical relevance of PTEN expression and its correlation with survivin expression in epithelial ovarian tumors. Oncol Rep. 2006;15:773-778. [PubMed] [DOI] |
| 2. | Sui L, Dong Y, Ohno M, Watanabe Y, Sugimoto K, Tokuda M. Survivin expression and its correlation with cell proliferation and prognosis in epithelial ovarian tumors. Int J Oncol. 2002;21:315-320. [PubMed] [DOI] |
| 3. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 4. | Mori A, Wada H, Nishimura Y, Okamoto T, Takemoto Y, Kakishita E. Expression of the antia-poptosis gene survivin in human leukemia. Int J Hematol. 2002;75:161-165. [PubMed] [DOI] |
| 5. | Das A, Tan WL, Teo J, Smith DR. Expression of survivin in primary glioblastomas. J Cancer Res Clin Oncol. 2002;128:302-306. [PubMed] [DOI] |
| 6. | Adida C, Haioun C, Gaulard P, Lepage E, Morel P, Briere J, Dombret H, Reyes F, Diebold J, Gissel-brecht C. Prognostic significance of survivin expression in diffuse large B-cell lymphomas. Blood. 2000;96:1921-1925. [PubMed] |
| 7. | Ikeguchi M, Ueda T, Sakatani T, Hirooka Y, Kaibara N. Expression of survivin messenger RNA correlates with poor prognosis in patients with hepatocellular carcinoma. Diagn Mol Pathol. 2002;11:33-40. [PubMed] [DOI] |
| 8. | Green DW, Roh H, Pippin J, Drebin JA. Antisense oligonucleotides: an evolving technology for the modulation of gene expression in human disease. J Am Coll Surg. 2000;191:93-105. [PubMed] [DOI] |
| 9. | Nakamura M, Tsuji N, Asanuma K, Kobayashi D, Yagihashi A, Hirata K, Torigoe T, Sato N, Watanabe N. Survivin as a predictor of cis-diamminedichloro-platinum sensitivity in gastric cancer patients. Cancer Sci. 2004;95:44-51. [PubMed] [DOI] |
| 10. | Griffith TS, Kemp TJ. The topoisomerase I inhibitor topotecan increases the sensitivity of prostate tumor cells to TRAIL/Apo-2L-induced apoptosis. Cancer Chemother Pharmacol. 2003;52:175-184. [PubMed] [DOI] |
| 11. | Wang JX, Zheng S. Caspase-3 and survivin expression in pediatric neuroblastoma and their roles in apoptosis. Chin Med J (Engl). 2004;117:1821-1824. [PubMed] |