修回日期: 2006-05-11
接受日期: 2006-05-24
在线出版日期: 2006-06-08
目的: 从"肿瘤异质化"角度出发, 通过多种基因编码蛋白(Bcl-2/Bax, Cath-D和VEGF)在肠型胃癌和弥漫型胃癌中的表达,探讨二型胃癌不同生物学特性的分子学基础.
方法: 采用免疫组化SP法检测Bcl-2/Bax, cathepsin-D (Cath-D)和VEGF在胃癌及正常胃组织的表达.
结果: Bcl-2/Bax, Cath-D和VEGF阳性表达率在胃癌组织中与癌旁正常胃黏膜组织中比较(分别为44.59% vs 27.30%; 58.11%vs 71.62%; 77.00% vs 21.60%; 71.62% vs 14.86%)均有显著性差异(P<0.05), 弥漫型胃癌中Bcl-2和Cath-D阳性细胞指数明显高于肠型胃癌(分别为29.14±24.70 vs 19.80±27.37和52.59±33.76 vs 29.21±39.67), 而Bax阳性细胞指数(分别为32.56±35.55 vs 47.74±27.43)明显低于肠型胃癌, 差异均有显著性(P<0.05), VEGF阳性细胞表达指数在不同胃癌浸润深度组间比较(早期胃癌7.13±15.81 vs 肌层浸润62.77±44.37 vs 浆膜浸润40.82±42.70)及有无淋巴结转移组间比较(42.05±42.61 vs 34.15±42.52)有显著性差异 (P<0.05).
结论: Bcl-2/Bax, Cath-D和VEGF分别参与了胃癌的发生, 浸润进展和转移. 二型胃癌在组织学发生相同的基础上由于在胃癌演进过程中有不同附加基因参与(Bcl-2/Bax和Cath-D), 使弥漫型胃癌获得了与肠型胃癌有所不同的亚克隆过程, 因而表现为生物学特性的异质化.
引文著录: 刘易欣, 赵春歌, 赵秀兰, 潘彦珞. 细胞凋亡基因、肿瘤侵袭相关蛋白酶及血管内皮生长因子在胃癌分型中的表达和意义. 世界华人消化杂志 2006; 14(16): 1571-1577
Revised: May 11, 2006
Accepted: May 24, 2006
Published online: June 8, 2006
AIM: To explore distinctive biological behavior in the intestinal-type gastric carcinoma and diffuse-type gastric carcinoma, according to the expression of Bcl-2, Bax, Cath-D and vascular epithelial growth factor (VEGF).
METHODS: Immunohistochemistry SP method was performed to detect the expression of Bcl-2, Bax, Cath-D and VEGF in 36 cases of intestinal-type gastric carcinoma, 38 cases of diffuse-type gastric carcinoma, and their corresponding normal gastric tissues.
RESULTS: The expression of Bcl-2, Bax, Cath-D and VEGF were significantly higher in gastric carcinoma than those in the normal controls (44.59% vs 27.30%; 58.11% vs 71.62%; 77.00% vs 21.60%; 71.62% vs 14.86%; all P < 0.05). The positive expression of Bcl-2 and Cath-D were markedly higher in diffuse-type gastric carcinoma than those in intestinal-type one (29.14 ± 24.70 vs 19.80 ± 27.37; 52.59 ± 33.76 vs 29.21 ± 39.67; both P < 0.05), while the expression of Bax was notably lower in the former (32.56 ± 35.55 vs 47.74 ± 27.43, P < 0.05). The positive rate of VEGF expression was closely correlated with the invasion depth (7.13 ± 15.81, 62.77 ± 44.37, and 40.82 ± 42.70 for mucosal or sub-mucosal invasion, muscular invasion, and serosa invasion, respectively) and lymph node metastasis (metastasis vs non-metastasis: 42.05 ± 42.61 vs 34.15 ± 42.52) of gastric carcinoma.
CONCLUSION: Bcl-2, Bax, Cath-D and VEGF are involved in the development and metastasis of gastric cancer. Due to the involvement of different genes, the intestinal-type or diffuse-type gastric carcinoma shows a distinctive biological behavior.
- Citation: Liu YX, Zhao CG, Zhao XL, Pan YL. Expression and significances of apoptosis gene, invasion-associated proteases and vascular epithelial growth factor in Lauren's classification of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(16): 1571-1577
- URL: https://www.wjgnet.com/1009-3079/full/v14/i16/1571.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i16.1571
胃癌是我国最常见的消化道肿瘤, 其死亡率居各种恶性肿瘤之首. 1965年, Lauren et al[1]通过对1344例胃癌进行组织学和组织化学研究后, 将其分为肠型胃癌和弥漫型胃癌二型, 并认为这两型胃癌无论从组织发生学、病理形态学还是生物学行为上都截然不同. 肠型胃癌主要发生自胃腺颈部和胃小凹底部的干细胞, 经过腺上皮细胞非典型增生、不完全大肠化生→原位癌→浸润性胃癌这样一个形态学连续谱系, 而对弥漫型胃癌(主要是印戒细胞癌)的癌变普系研究甚少. 1997年潘彦珞et al[2]的研究证实, 球样异型增生细胞是印戒细胞癌的癌前病变, 该细胞也来自胃腺颈部的干细胞, 开始于胃小凹底部, 其实质也是一种不完全大肠化生的细胞. 另外, 我们近期研究结果也发现, 在致瘤背景上, 二型胃癌均有幽门螺杆菌(H. pylori)感染, 并且H. pylori感染率无显著差异, 说明弥漫型胃癌的致瘤背景、组织发生与肠型胃癌是一样的. 那么这两型胃癌为什么在生物学行为上有如此大的差别? 近年来, 随着细胞生物学和分子生物学在肿瘤发生学中的深入研究, 认为"肿瘤的演进"这一生物学现象的出现与肿瘤的异质化有关. 我们以此为切入点, 运用免疫组织化学的方法, 通过检测细胞凋亡基因蛋白(Bcl-2/Bax)、肿瘤侵袭相关蛋白酶(Cath-D)及血管内皮生长因子(VEGF)在二型胃癌中的表达情况, 并对癌基因型和形态学表型进行对比分析, 探讨胃癌细胞发生过程中细胞凋亡、侵袭能力、生长速度等方面形成的有所不同的亚克隆过程, 并为临床针对不同组织学类型胃癌的分子靶向治疗寻找理论依据.
收集2002-01/2003-12天津医科大学总医院病理科首发胃癌手术切除标本共74例, 每例均包括癌及癌旁正常胃组织, 全部病例均经复读后确认. 其中男55例, 女19例, 男女之比为2.89:1, 平均年龄60.9 (32-82)岁. 按照Lauren's分型法: 肠型胃癌36例(均为乳头状或高、中分化管状腺癌), 弥漫型胃癌38例(均为印戒细胞癌). 术后病理证实: 侵及黏膜及黏膜下层9例, 侵及肌层10例, 侵及浆膜及浆膜外55例; 有淋巴结转移46例, 无淋巴结转移28例. 全部标本均经40 g/L福尔马林固定, 石蜡包埋, 作4 mm厚连续切片, 以备染色用.
1.2.1 免疫组织化学检测: 免疫组织化学检测上述各种基因编码蛋白的表达, 所用一抗见表1. 染色采用SP法, 枸橼酸缓冲液(pH 6.0)微波抗原修复l0-15 min. 全部抗体及SP试剂盒均购自北京中杉金桥生物技术有限公司.
| 抗体 | 一抗属性 | 来源 | 克隆系 | 稀释度 | 预处理 | 阳性对照 |
| Bcl-2 | 兔 | Santa Cruz | 单克隆 | 1:100 | 微波热修复10 min | 扁桃体 |
| Bax | 鼠 | Santa Cruz | 单克隆 | 1:100 | 微波热修复10 min | 乳腺癌 |
| Cath-D | 鼠 | Santa Cruz | 单克隆 | 1:100 | 微波热修复10 min | 结肠癌 |
| VEGF | 鼠 | Santa Cruz | 单克隆 | 1:50 | 微波热修复15 min | 结肠癌 |
1.2.2 染色对照和结果判定: 用已知阳性组织切片作阳性对照, 以PBS替代一抗作阴性对照. 免疫组化染色Bcl-2, Bax, Cath-D和VEGF阳性细胞着色呈棕黄色颗粒状. Bcl-2, Bax蛋白阳性物质定位于细胞质及胞核上; VEGF阳性物质定位于细胞膜和胞质; 而Cath-D主要位于胞质内. 每例标本切片依次从左至右随机计数, 每个高倍视野(×400)中每100个肿瘤细胞中的阳性细胞数. (每例>5个视野), 然后取其均值作为该例细胞指数(%).
统计学处理 用SPSS 12.0统计软件包分析. 各种基因编码蛋白在正常胃和胃癌组织的表达结果比较用χ2检验; 各种基因编码蛋白表达与肿瘤浸润深度、淋巴结转移及二型胃癌的关系, 用秩和检验.
Bcl-2蛋白在癌旁正常胃黏膜中呈低表达, 阳性率仅为27.03%, 阳性细胞主要位于胃小凹底部的上皮细胞增生区, 染色强度弱呈淡黄色, 胃癌组织中阳性表达率为44.59%, 明显高于癌旁正常胃黏膜(P<0.05, 表2), 染色强呈深棕色. Bax蛋白与其相反, 在癌旁正常胃黏膜中阳性表达率为71.62%, 胃癌组织中明显降低, 仅为58.11%, 与正常胃黏膜差异有显著性(P<0.05, 表2).
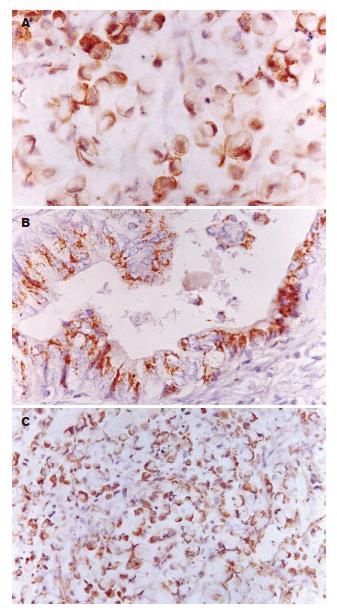
Bcl-2和Bax蛋白表达与胃癌分型有关. Bcl-2阳性细胞指数在弥漫型胃癌组为29.14%, 明显高于肠型胃癌组(19.80%), 二者差异有显著性(P<0.05). 阳性物质着色在印戒细胞癌中普遍强于肠型胃癌, 呈深棕色. 当癌细胞浸润至黏膜下层后出现细胞核内着色, 随着其在胃壁浸润加深, 细胞核内表达数量增多(图1A-B); Bax在弥漫型胃癌组中阳性表达指数为32.56%, 明显低于肠型胃癌组(47.74%, P<0.05, 表3).
| 临床病理参数 | n | Bcl-2 | Bax | Cath-D | VEGF | ||||
| 阳性表达指数(%) | P 值 | 阳性表达指数(%) | P 值 | 阳性表达指数(%) | P 值 | 阳性表达指数(%) | P 值 | ||
| 组织学类型 | |||||||||
| 肠型 | 36 | 19.80±27.37 | 0.031a | 47.74±27.43 | 0.001a | 29.21±39.67 | 0.013a | 28.96±38.55 | 0.132 |
| 弥漫型 | 38 | 29.14±24.70 | 32.56±35.55 | 52.59±33.76 | 50.24±44.39 | ||||
| 浸润程度 | |||||||||
| 黏膜及其下层 | 9 | 21.12±30.35 | 0.046 | 41.90±36.95 | 0.829 | 40.51±41.23 | 0.546 | 7.13±15.81 | 0.016a |
| 肌层 | 10 | 8.77±16.20 | 40.01±32.67 | 53.94±40.93 | 62.77±44.37 | ||||
| 浆膜及外层 | 55 | 27.30±26.40 | 39.64±32.12 | 38.36±37.76 | 40.82±42.70 | ||||
| 淋巴结转移 | |||||||||
| 无 | 28 | 21.25±28.26 | 0.339 | 41.96±33.65 | 0.580 | 39.64±41.89 | 0.645 | 34.15±42.52 | 0.012a |
| 有 | 46 | 26.22±25.25 | 38.31±31.59 | 41.75±36.39 | 42.05±42.61 | ||||
Bcl-2蛋白表达与胃癌浸润深度密切相关, 即癌细胞侵及肌层者明显低于黏膜及黏膜下层者, 同时也低于浆膜层者, 与淋巴结转移无关. Bax则与胃癌的浸润深度和有无淋巴结的转移均无关(表3).
胃癌的发生是一个多因素共同作用的复杂过程, 目前认为细胞的凋亡抑制作用在肿瘤的发生、发展过程中要比细胞过度增殖更为重要, 随着对细胞凋亡的深入研究, 发现bcl-2基因家族是在细胞凋亡信号传导途径中影响和调控细胞凋亡的一类非常关键的基因, 根据其在调控细胞凋亡中的不同作用, bcl-2基因家族分为两大类, 即抗凋亡基因(包括bcl-2, bcl-x1, bcl-w等)和促凋亡基因(bax, bak, bok等), 其中bcl-2和bax是bcl-2基因家族中最具代表性的一对作用相反凋亡基因. bcl-2与肿瘤细胞凋亡密切相关, 转染bcl-2能抑制许多因素诱导的多种肿瘤细胞的凋亡. bax基因编码产物Bax蛋白的氨基酸序列45%与Bcl-2蛋白同源. 体内Bax不仅自身可形成二聚体诱导细胞凋亡[3], 21 kDa的Bax蛋白还能与Bcl-2, Bcl-x1形成异源二聚体, 阻止细胞凋亡的发生, 是细胞凋亡调控中非常重要的环节.
文献[7]报道, 正常组织中Bcl-2分布比较局限, 主要见于早期胚胎组织、成熟淋巴细胞、增生活跃的上皮细胞等部位. 本研究发现正常胃黏膜Bcl-2仅在胃小凹底部的上皮细胞增殖区有少量阳性物质沉积, 此处阳性表达对抑制干细胞凋亡, 维持干细胞增殖能力并使其分化成熟, 维持正常胃黏膜上皮细胞群凋亡与增生的平衡均有重要生理意义. Hall et al[4]通过原位末端标记发现, 胃腺颈部细胞很少凋亡, 也支持这种设想.
我们研究了74例胃癌和癌旁正常胃黏膜中Bcl-2和Bax蛋白表达, 发现胃黏膜从正常细胞到发生恶性转化过程中的确存在细胞凋亡基因的异常, 表现为胃癌细胞抗凋亡基因蛋白Bcl-2的过度表达和促凋亡基因Bax表达的明显减少, Bcl-2表达指数与癌细胞在胃壁中浸润深度有一定关系, 结果与Muller和徐佶 et al的研究相吻合[5-6], 文献报道Bcl-2本身并无促进细胞发生恶性转化的作用, 但在无生长因子或神经营养因子存在条件下, 通过抑制细胞凋亡, 延长细胞存活时间, 从而增加细胞染色体畸变和病毒感染机会, 增加细胞恶变的概率. 另外bcl-2能协同促癌基因ras和c-myc的作用, 使细胞发生恶性转化[7]. Bax基因蛋白表达的减少或缺失, 使正常细胞程序性死亡, 黏膜更新受阻, 最终导致胃黏膜上皮细胞发生恶变. 以上提示胃癌发生、发展过程中细胞凋亡基因发挥了重要作用, 同时亦证实肿瘤发生不只是因细胞生长、增殖过快引起, 而且与细胞凋亡减少有关.
本研究结果还显示, 胃癌组织中Bcl-2和Bax蛋白表达与Lauren's分型有关, 即Bcl-2阳性细胞指数在弥漫胃癌组明显高于肠型胃癌组, 且阳性物质着色浓度高, 而明显低于肠型胃癌组, 表明bcl-2基因家族与胃癌分化程度密切相关. 关于凋亡基因在不同分化程度肿瘤细胞中的表达国外文献报道不尽一致. 本研究与日本学者Saegusa et al[8]的结果相符, 细胞对凋亡信号的反应性主要取决于bcl-2基因家族中凋亡诱导基因和凋亡抑制基因的相对表达水平, 即bcl-2与bax的比例. 当细胞内Bcl-2超表达时, 他与Bax形成异源二聚体增多, 使细胞凋亡减弱或被抑制, 使肿瘤细胞生长快, 浸润性强; 当细胞内Bax过表达时, 则以Bax同源二聚体为主, 形成离子通道, 使线粒体膜的通透性改变; 或Bax取代凋亡蛋白酶活化因子与Bcl-2同源二聚体结合, 通过活化半胱氨酸天冬氨酸蛋白酶而促进细胞凋亡, 导致肿瘤相对生长缓慢, 浸润性低. Kasagi et al[9]研究了不同分化程度的胃癌细胞的凋亡指数, 发现高分化胃癌的凋亡指数明显高于低分化胃癌, 显示分化差的胃癌对细胞凋亡存在逃避机制. 本研究提示不同类型胃癌在从正常胃黏膜上皮向恶性转化的过程中虽然均有bcl-2基因家族突变, 但在胃癌细胞演进过程中, 由于不同种类的凋亡调节基因突变程度的不同或由于肿瘤细胞对凋亡信号的反应不同, 使他们获得了不同的生物学特征, 因而弥漫型胃癌分化程度低, 恶性度高, 与肠型胃癌存在"肿瘤的异质化".
编码产物Bcl-2蛋白是一种跨膜蛋白, 分子量约为26 kDa, 定位于内质网和线粒体外膜上[10]. bcl-2基因家族的作用点在线粒体膜上, 因此正常胃黏膜上皮细胞和大部分胃癌细胞呈胞质染色阳性, 但在印戒细胞癌中, 癌细胞浸至黏膜下层后出现胞核着色, 并随着浸润深度的增加, 核内着色阳性细胞数也增加, Bcl-2基因蛋白这种异常信号传导通路对肿瘤细胞的恶性增殖、去分化有何重要意义尚待进一步探讨.
侵袭和转移是恶性肿瘤特有的两种性质, 也是影响预后的重要因素, 因此探讨肿瘤的侵袭和转移机制是研究的热点. Cath-D是定位于染色体11p15基因编码上的一种可被雌激素诱导的溶酶体蛋白酶, 一方面通过蛋白水解作用或通过激活组织蛋白酶B, 进而激活尿激酶型纤溶酶原活化因子(PA)降解细胞外基质(ECM)、基膜和结缔组织, 促进肿瘤的侵袭和转移; 另一方面, Cath-D还有促进有丝分裂的作用, 并与癌基因c-erb-B2扩增有关, 从而促进肿瘤细胞增殖和生长.
关于Cath-D与胃癌和Lauren's分型的关系研究较少. 本文应用免疫组化方法对Cath-D在胃癌原发灶中的表达与胃癌生物学行为的关系进行了研究, 结果表明Cath-D在胃癌组织中尤其在癌巢边缘的癌细胞中表达明显强于癌旁正常胃黏膜组织和肿瘤中央区, 证实胃黏膜在癌变过程中细胞发生了Cath-D基因的突变. 由于癌细胞Cath-D基因蛋白表达的异常刺激了肿瘤细胞的生长、ECM和结缔组织的溶解, 使肿瘤细胞获得了向周围组织浸润转移的能力, 癌灶边缘的癌细胞表现出更明显的恶性生物学行为. Garcia et al[11]用Cath-D基因进行细胞转染, 表明这种蛋白表达增强, 转染细胞发生肝转移的时间提前, 发生率也增高, 提示Cath-D与胃癌的发生、发展有关. 此外本研究结果还显示Cath-D阳性表达指数与胃癌的Lauren's分型密切相关, 即弥漫型胃癌Cath-D表达明显高于肠型胃癌(P<0.05), 说明在胃癌演进过程中, 由于印戒细胞具有更多更强的Cath-D基因突变, 使弥漫型胃癌"肿瘤的异质化"比肠型胃癌呈现出更强的侵袭力、恶性度高、易转移等生物学行为. McGuire et al[12]研究发现Cath-D基因过表达或高水平的乳腺癌患者其总生存期较短, 因此检测胃癌组织中Cath-D表达可作为监测胃癌复发、预后判定及指导治疗有价值的分子生物学指标.
本研究还发现肿瘤间质细胞亦有Cath-D表达, 关于肿瘤间质细胞, 尤其炎细胞中Cath-D阳性表达在肿瘤细胞侵袭、转移过程中的意义目前看法不同. 传统观点认为, 肿瘤间质中炎细胞, 尤其是免疫细胞具有抗肿瘤的作用. 但有人认为肿瘤间质细胞表达组织蛋白酶同样可以破坏正常组织结构, 协助肿瘤细胞发生浸润和转移. Gaci et al[13]在乳腺癌的研究中证实, 间质细胞Cath-D阳性表达与乳腺癌侵袭、转移有关. 我们在胃癌研究中尚未发现这种关系. 因此, 肿瘤间质细胞在肿瘤形成和浸润转移中扮演什么角色, 值得进一步深入探讨.
还有研究表明[12], 在酸性环境下雌激素可诱导组织蛋白酶D的分泌. 因此, Cath-D在雌激素阳性的乳腺癌进展中发挥重要作用. 但本实验结果并未发现Cath-D表达与患者性别之间有明显相关性, 提示肿瘤细胞Cath-D分泌机制较为复杂, 可能与多种生长因子的调控有关.
肿瘤的新生血管生成是肿瘤生长和转移的形态学基础, 目前已分离和纯化的新生血管生长因子较多, VEGF是其中作用最强、特异性最高的一种. VEGF是一种糖基化分泌性多肽, 分子量为43 kDa, 可特异作用于血管内皮细胞上的VEGF受体, 刺激其有丝分裂和增殖, 改变内皮细胞基因的活化方式, 诱导内皮细胞表达蛋白网的水解酶、间质胶原酶和细胞因子. 这些酶和细胞因子共同促使血浆纤维蛋白外渗, 导致纤维素在肿瘤间质中沉积, 促进巨噬细胞、纤维母细胞等细胞生长, 从而在原位诱导新生血管生成. 缺氧、低血糖细胞因子等是VEGF的外部调控因素.
本研究结果显示VEGF在胃癌组织中的阳性表达率和阳性物质的浓度均明显高于癌旁正常胃黏膜, 同时在肿瘤间质中的部分血管内皮细胞及少数纤维细胞也表达VEGF, 结果与文献报道一致[14]. VEGF在恶性肿瘤内普遍呈过表达的主要原因是在肿瘤生长过程中, 由于瘤细胞增殖迅速, 造成肿瘤循环系统处于相对缺氧状态, 激活了VEGF基因, 刺激肿瘤细胞和肿瘤间质大量分泌血管生长因子, 从而在原位诱导新生血管的生成, 使肿瘤细胞在充分获得营养供应的条件下得以呈指数方式迅速生长. 最近研究发现在人淋巴瘤的转移瘤中观察到VEGF表达与细胞凋亡呈反比关系, 说明VEGF还具有直接促进肿瘤细胞生成, 阻止凋亡的作用[15]. 本研究发现VEGF阳性表达指数与胃癌的进展和转移有密切的关系, 即癌细胞在胃壁浸润越深者或有淋巴结转移者, 肿瘤中VEGF表达越明显, 且染色强度高的癌细胞多位于癌肿浸润的边缘. 文献报道, 胃癌浸润前缘中的肿瘤微血管密度较肿瘤内部高. 说明肿瘤在向外浸润性生长过程中与新生血管化同步进行. 同时由于新生血管本身结构上的缺陷, 如稳定性差、通透性高, 均有利于肿瘤细胞穿过血管壁进入循环系统, 为癌细胞的转移提供条件. 因而肿瘤周边的癌细胞可能更具有侵袭性. 从生存曲线分析, VEGF阳性表达者预后明显差于VEGF阴性表达者[16]. 综上得出VEGF参与了胃癌的发生与发展, 可作为判断预后的指标. 文献研究表明应用VEGF抗体或调控VEGF的受体, KDR能明显抑制实验性肿瘤的生长和转移[17], 提示VEGF可作为肿瘤生物治疗的理想靶点. 另外本研究发现VEGF的表达与Lauren's分型无关, 说明VEGF不是影响胃癌分化的主要因素, 与"肿瘤的异质化"无关.
总之, 本研究证实了Bcl-2, Bax, Cath-D和 VEGF分别参与了胃癌的发生、浸润进展和转移. 胃癌的发生、发展是一个多基因参与、调控的多步骤过程, 弥漫型与肠型胃癌在组织学发生相同的基础上由于在胃癌演进过程中有不同附加基因参与(Bcl-2, Bax和Cath-D), 使二型胃癌有不同的亚克隆过程, 因而表现为生物学特性的异质化. 研究结果为临床对不同组织学类型的分子靶向治疗提供了理论依据.
肠型胃癌和弥漫性胃癌同起源于胃小凹的干细胞, 但其形态学特征及生物学行为截然不同, 有关影响其演进及异质化的分子调控机制尚不清楚.
肿瘤侵袭相关蛋白酶(Cath-D)是恶性肿瘤发生侵袭破坏及转移的重要物质基础, 封闭阻遏该蛋白酶基因的表达可望影响其生物学行为.
Carcia et al的研究表明Cathepsin-D 过表达与乳腺癌的转移高度相关.
本文通过检测Bcl-2/Bax, Cath-D和VEGF在不同分型胃癌及癌旁组织中的表达情况探讨胃癌恶性转化过程中的一系列相关分子事件, 发现弥漫型胃癌Cath-D的阳性表达指数显著高于肠型胃癌.
Cath-D是胃癌、乳腺癌等高度恶性病理组织学类型的重要表达产物, 有关其抗体及基因沉默技术的体内、外实验研究将可作为未来分子靶向治疗的一个新的方向.
1 弥漫型胃癌: 指不形成腺腔结构弥漫散在生长的低分化腺癌及印戒细胞癌.
2 肠型胃癌: 指发生在胃的具有管状结构的高-中分化腺癌.
本文设计科学, 结果合理, 讨论也尚有条理, 有可读性, 为胃癌的病理学研究及基因治疗提供了充足的有意义的信息, 能较好反应我国胃肠病学基础研究的先进水平.
电编: 张敏 编辑:张海宁
| 1. | Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49. [PubMed] |
| 3. | Vogelbaum MA, Tong JX, Higashikubo R, Gutmann DH, Rich KM. Transfection of C6 glioma cells with the bax gene and increased sensitivity to treatment with cytosine arabinoside. J Neurosurg. 1998;88:99-105. [PubMed] [DOI] |
| 4. | Hall PA, Coates PJ, Ansari B, Hopwood D. Regula-tion of cell number in the mammalian gastrointes-tinal tract: the importance of apoptosis. J Cell Sci. 1994;107:3569-3577. |
| 5. | Muller W, Schneiders A, Hommel G, Gabbert HE. Prognostic value of bcl-2 expression in gastric cancer. Anticancer Res. 1998;18:4699-4704. [PubMed] |
| 7. | Xu J, Xu Z, Jiang Y, Qian X, Huang Y. Cryptorchi-dism induces mouse testicular germ cell apoptosis and changes in bcl-2 and bax protein expression. J Environ Pathol Toxicol Oncol. 2000;19:25-33. [PubMed] |
| 8. | Saegusa M, Takano Y, Wakabayashi T, Okayasu I. Apoptosis in gastric carcinomas and its association with cell proliferation and differentiation. Jpn J Cancer Res. 1995;86:743-748. [PubMed] [DOI] |
| 9. | Kasagi N, Gomyo Y, Shirai H, Tsujitani S, Ito H. Apoptotic cell death in human gastric carcinoma: analysis by terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling. Jpn J Cancer Res. 1994;85:939-945. [PubMed] [DOI] |
| 10. | Chalbos D, Westley B, May F, Alibert C, Rochefort H. Cloning of cDNA sequences of a progestin-regulated mRNA from MCF7 human breast cancer cells. Nucleic Acids Res. 1986;14:965-982. [PubMed] [DOI] |
| 11. | Garcia M, Derocq D, Pujol P, Rochefort H. Overex-pression of transfected cathepsin D in transformed cells increases their malignant phenotype and metastatic potency. Oncogene. 1990;5:1809-1814. [PubMed] |
| 12. | McGuire WL, Tandon AK, Allred DC, Chamness GC, Ravdin PM, Clark GM. Prognosis and treatment decisions in patients with breast cancer without axillary node involvement. Cancer. 1992;70:1775-1781. [PubMed] [DOI] |
| 13. | Gaci Z, Bouin-Pineau MH, Gaci M, Daban A, Ingrand P, Metaye T. Prognostic impact of cathepsin D and c-erbB-2 oncoprotein in a subgroup of node-negative breast cancer patients with low histological grade tumors. Int J Oncol. 2001;18:793-800. [PubMed] [DOI] |
| 14. | Brown LF, Berse B, Jackman RW, Tognazzi K, Guidi AJ, Dvorak HF, Senger DR, Connolly JL, Schnitt SJ. Expression of vascular permeability factor (vascular endothelial growth factor) and its receptors in breast cancer. Hum Pathol. 1995;26:86-91. [PubMed] [DOI] |
| 15. | Harmey JH, Bouchier-Hayes D. Vascular endothelial growth factor (VEGF), a survival factor for tumour cells: implications for anti-angiogenic therapy. Bioessays. 2002;24:280-283. [PubMed] [DOI] |
| 16. | Maeda K, Chung YS, Ogawa Y, Takatsuka S, Kang SM, Ogawa M, Sawada T, Sowa M. Prognostic value of vascular endothelial growth factor expression in gastric carcinoma. Cancer. 1996;77:858-863. [PubMed] [DOI] |
| 17. | Melnyk O, Shuman MA, Kim KJ. Vascular endothelial growth factor promotes tumor dissemi-nation by a mechanism distinct from its effect on primary tumor growth. Cancer Res. 1996;56:921-924. [PubMed] |