修回日期: 2006-04-06
接受日期: 2006-04-13
在线出版日期: 2006-06-08
目的: 研究人抗HBsAg-Fab重组体在小鼠体内的表达分泌.
方法: 将所构建的pXXUF1-HBs-Fab质粒以 5、10、20和40 mg的剂量分别利用尾静脉液压法转染C57BL/6小鼠, 建立实验1-4组; 同时设立pXXUF1质粒转染对照组和空白组. 转染3 d后采集血清和肝、肾、脾等组织标本, 运用RT-PCR, ELISA和免疫组织化学染色等方法从基因和蛋白水平分析基因工程抗体人抗HBsAg-Fab在体内的表达能力.
结果: 尾静脉液压注射pXXUF1-HBs-Fab组小鼠血清中证实了人源性Fab蛋白的分泌性表达, 各实验组血清中表达量分别为201.3±13.7、213.1±13.5、513.6±12.8和954.1± 12.7 mg/L, 并具有与HBsAg特异性结合的活性, 蛋白表达与注射质粒剂量有正相关(r = 0.912, P<0.01); 对照组和空白组血清中则未测到目的蛋白. 实验组肝、肾、脾组织RT-PCR检测可见肝组织中有Fd重链及k轻链的mRNA表达; 免疫组织化学检测显示肝细胞胞质中有棕黄色阳性颗粒, 且部分肾小球毛细血管腔内壁和肾脏集合管壁可见附着的Fab蛋白, 肾实质细胞及脾脏均未见Fd重链及k轻链的mRNA和目的蛋白表达; 对照组和空白组均未检测到目的蛋白.
结论: pXXUF1-HBs-Fab成功于小鼠肝脏分泌表达人抗HBsAg-Fab重组体, 其表达水平与质粒DNA注射剂量存在正相关关系, 并可通过肾小球滤过代谢.
引文著录: 唐莉, 曾志贵, 潘桃, 袁劲, 陈必成, 陈忠华, 陈知水. 抗HBsAg-Fab重组体在小鼠肝脏的表达. 世界华人消化杂志 2006; 14(16): 1554-1560
Revised: April 6, 2006
Accepted: April 13, 2006
Published online: June 8, 2006
AIM: To evaluate the expression of recombinant and soluble human anti-HBsAg Fab in murine liver.
METHODS: The 5-40 μg recombinant plasmid pXXUF1-HBs-Fab was transfected by hydrodynamics-based administration via tail vein into C57BL/6 mice within 5 s. Meanwhile the empty plasmid transfection group and non-transfection group were established. The serum and tissue samples from liver, kidney and spleen of these mice were collected 3 d after transfection. The expression of genetically engineered Fab antibody in vivo was identified by reverse transcription-polymerase chain reaction (RT-PCR), enzyme-linked immunosorbent assay (ELISA) and immunohistochemistry both at mRNA and protein level.
RESULTS: After transfection with different doses (5, 10, 20 and 40 μg) of pXXUF1-HBs-Fab, the plasma expression of anti-HBsAg Fab was 201.3 ± 13.7, 213.1 ± 13.5, 513.6 ± 12.8 and 954.1 ± 12.7 μg/L, respectively, with specific binding activities to HBsAg protein. There was a postive correlation between the expression of the protein and plasmid dose(r = 0.912, P < 0.01). Meanwhile, the mRNA of Fd and κ chain were detected in liver tissues by RT-PCR. Immunohistochemistry showed brown positive granules in the cytoplasm of liver cells and Fab protein cohered on the inner walls of glomerular capillary lumen and collectors, but the parenchyma cells of the kidney and spleen had no expression of Fd, κ chain and the target protein. The expression of target protein was not observed in both empty plasmid transfection and non-transfection group.
CONCLUSION: The recombinant and soluble human anti-HBsAg Fab can be successfully expressed in mice, and the expression level is increased with the increase of plasmid dose. The above study also shows the Fab protein can be filtrated through glomerular.
- Citation: Tang L, Zeng ZG, Pan T, Yuan J, Chen BC, Chen ZH, Chen ZS. Expression of recombination human anti-HBsAg Fab in murine liver. Shijie Huaren Xiaohua Zazhi 2006; 14(16): 1554-1560
- URL: https://www.wjgnet.com/1009-3079/full/v14/i16/1554.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i16.1554
我国肝移植受者多以乙肝相关终末期肝病患者[1-3], 这些患者移植后极易发生乙肝病毒(HBV)的复发感染, 无预防者肝移植后HBV再感染率可达67%-80%, 而复发后生存率明显下降, 3年生存率仅44%, 5年生存率为17%[4-7]. 运用基因治疗方法在受者体内表达小分子抗HBsAg抗体预防HBV复发感染的研究对提高我国肝移植患者生存率和生存质量具有重要意义. 在前期研究中,我们已将来源于人源性噬菌体抗体库筛选后的抗HBsAg抗体的重链Fd段和k轻链基因构建于重组腺相关病毒穿梭质粒上, 即pXXUF1-HBs-Fab. 质粒介导外源基因在体内的表达是研究基因功能和基因治疗的主要手段. 我们采用尾静脉液压法建立pXXUF1-HBs-Fab体内转染模型, 探索小分子抗体基因在小鼠体内的表达情况.
含有抗人HBsAg 抗体重链Fd段、k轻链基因和IRES序列的重组腺相关病毒穿梭质粒pXXUF1-HBs-Fab为本研究所构建; pXXUF1质粒由美国匹兹堡大学肖啸教授惠赠; 清洁级健康C57BL/6(H-2b/b)♂小鼠, 6-8 wk龄, 20-22 g, 由本所动物中心提供; 质粒去内毒素抽提试剂盒(Qiagen); HRP-羊抗人Fab抗体及鼠抗人Fab抗体购(Sigma); 含HBsAg抗原的ELISA板(上海实业科华生物技术公司); SP免疫组化试剂盒(北京中山生物技术公司); Trizol RNA分离试剂盒(Gibco); 逆转录酶M-MLV及oligi dT (Progema); 高保真DNA聚合酶、dNTP和琼脂糖(Fermentas); PCR Marker(华美). PCR引物合成(上海英骏): F1: 5'>AGT GGC AGT GCT GGA AAC<3'; F2: 5'>GCA GAT GTA GGT CTG GGT G<3'; K1: 5'>GCC GGA CCA GTC AGG ACA T<3'; K2: 5'>CCG ATT GGA GGG CGT TAT<3'; GADPH 5'端引物: 5'>ACG GAT TTG GTC GTA TTG GG <3'; GADPH 3'端引物: 5'>TGA TTT TGG AGG GAT CTC GC<3'.
吸取已构建的重组质粒pXXUF1-HBs-Fab和pXXUF1保种菌液各200 mL分别至100 mL含100 mg/L氨苄青霉素的LB液体培养基中, 37 ℃剧烈振摇. 将菌悬液收集于离心管中, 4 ℃离心15 min, 弃培养液, 使细菌沉淀尽可能干燥. 按Qiagen去内毒素超纯质粒抽提试剂盒说明书对pXXUF1-HBs-Fab和pXXUF1进行大量制备, ddH2O溶解沉淀. 紫外分光光度计测定质粒DNA的浓度及纯度. 分别将5-40 mg纯化pXXUF1-HBs-Fab和20 mg pXXUF1质粒溶解于1.6 mL的生理盐水中, 通过C57BL/6小鼠尾静脉快速(5 s内)注射完全部液体. 实验分组: 设立实验1组(注射pXXUF1-HBs-Fab 5 mg+生理盐水)、实验2组(注射pXXUF1-HBs-Fab 10 mg+生理盐水)、实验3组(注射pXXUF1-HBs-Fab 20 mg+生理盐水)、实验4组(注射pXXUF1-HBs-Fab 40 mg+生理盐水)、对照组(pXXUF1+生理盐水)和空白组(生理盐水)每组10只. 注射3天后, 采集血清和肝、肾和脾组织.
1.2.1 ELISA检测: 经小鼠眼眶采血1 mL, 放置2 h后经2000 r/min离心5 min取血清. 以HBsAg包被ELISA板, 加入各组小鼠血清及标准人抗HBsAg-Fab蛋白孵育1 h; 再加入1:8000稀释的HRP-羊抗人Fab 100 mL孵育1 h, TMB显色, 于450 nm及630 nm双波长检测.
1.2.2 RT-PCR: 采用Trizol试剂提取C57BL/6小鼠肝脏、肾脏和脾脏组织的总RNA, 以Oligo dT为引物逆转录合成单链cDNA. 并F1和F2, K1和K2为引物扩增抗HBs抗体Fd重链及k轻链基因. RNA提取和RT-PCR方法详见试剂盒使用说明书. PCR反应条件: 94 ℃预变性5 min, 循环参数为; 94 ℃变性40 s, 55 ℃退火60 s, 72 ℃延伸60 s, 35个循环, 72 ℃延伸10 min, 同时扩增管家基因GADPH. 产物经琼脂糖凝胶电泳后鉴定.
1.2.3 免疫组化检测: 取40 g/L多聚甲醛灌注小鼠肝脏至发白, 剪取1 cm3大小组织固定; 肾脏及脾脏剪下后肝素盐水冲洗, 一并放入40 g/L多聚甲醛固定. 石蜡包埋, 标本均作厚度4 mm的连续切片4张, 分别进行HE和免疫组化染色. 鼠肝单克隆抗人Fab抗体的工作浓度1:40. 组化染色参照SP 试剂盒说明书进行. PBS代替一抗作阴性对照. 显微镜下观察并照相. 染色结果判定: 光镜下Fab蛋白以棕黄色颗粒为阳性, 无着色为阴性,并将着色浅淡的弱阳性也归为阴性.
统计学处理 使用SPSS 11.5软件进行统计分析. 所有实验数据均以均数±标准差表示, 各组间差异的两两比较采用t检验, 注射剂量与蛋白表达量间进行一元线性相关分析, P<0.05时具有显著统计学意义.
Qiagen去内毒素超纯质粒抽提试剂盒制备的重组质粒pXXUF1-HBs-Fab和pXXUF1浓度分别达到850 mg/L和800 mg/L. 尾静脉高压注射后, 各组小鼠均出现一过性心衰, 约30 min后恢复正常, 成活率达100%.
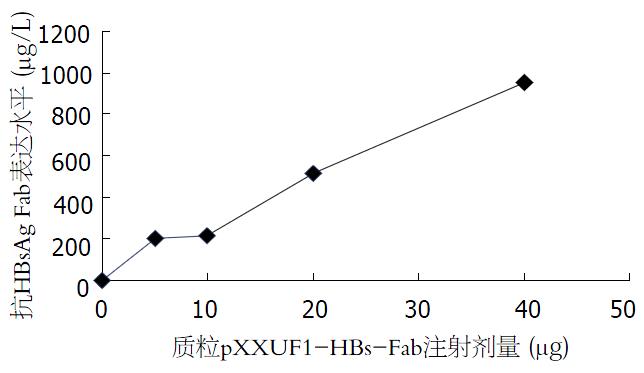
实验组C57BL/6小鼠注射5 mg, 10 mg, 20 mg和40 mg质粒后血清平均A值分别为1.78±0.17、1.814±0.165、2.341±0.131和2.712±0.13; 根据标准曲线计算, 血清中小分子Fab抗体表达量分别为201.3±13.7 mg/L、213.1±13.5 mg/L、513.6±12.8 mg/L和954.1±12.7 mg/L. 对照组和空白组C57BL/6小鼠血清中则未测到人抗HBsAg小分子Fab抗体. 证实转染pXXUF1-HBs-Fab的小鼠可以分泌性表达人源性Fab蛋白, 并具有与HBsAg特异性结合的活性; 在40 mg pXXUF1-HBs-Fab质粒注射时抗HBsAg Fab表达最高, 但5 mg和10 mg无明显的差别, 其他剂量组的表达差异均显著(表1). 不同pXXUF1-HBs-Fab注射剂量对人抗HBsAg Fab表达水平的影响见(图1), 蛋白表达与注射质粒剂量有正相关(r= 0.912, P<0.01).
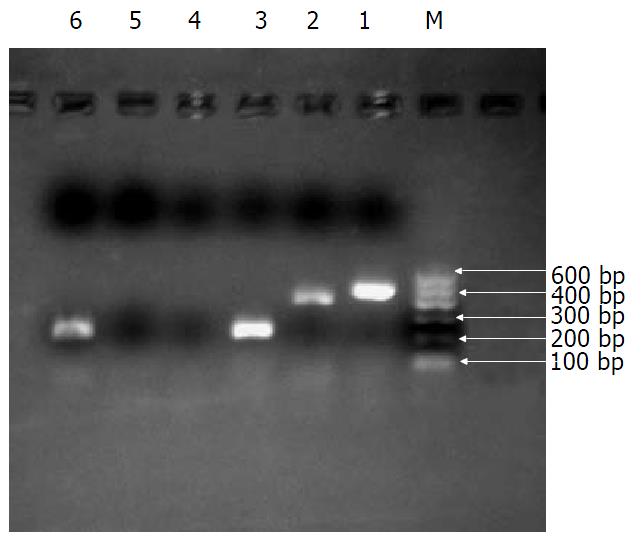
分别以各组小鼠的肝脏、肾脏和脾脏组织提取的总RNA为模板, 进行RT-PCR. 在实验组小鼠的肝脏组织中均可检测到人抗HBsAg抗体Fd重链及k轻链的mRNA表达, 而肾脏和脾脏组织未检测; 对照组和空白组小鼠的肝脏、肾脏和脾脏组织中均未检测到Fd重链及k轻链的表达. 图2显示的是实验3组和对照组肝脏组织的RT-PCR产物凝胶电泳结果, 可见实验组和对照组均有内参GADPH的扩增产物, 表示逆转录过程和PCR过程均成功; 实验组可见长约468 bp和402 bp的重链Fd段和k轻链基因条带, 而未转染组无带.
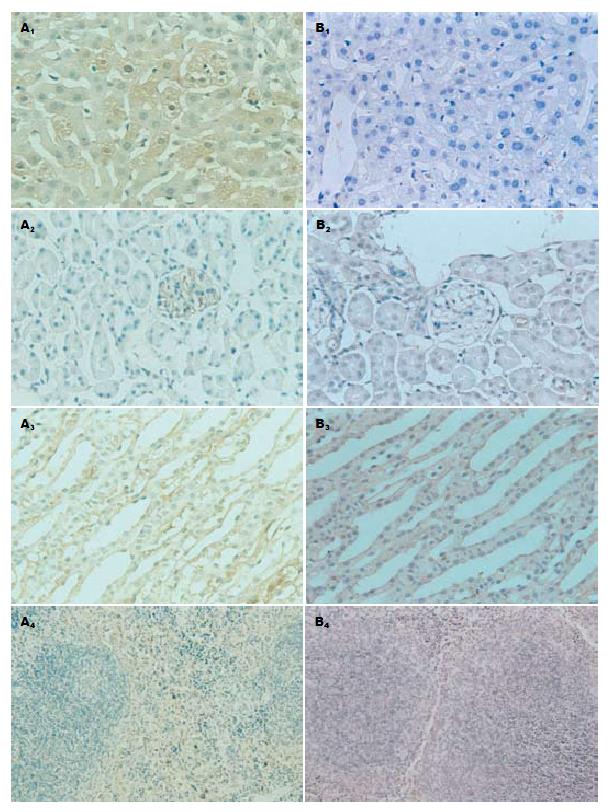
体内转染C57BL/6实验组小鼠肝细胞胞质内可见棕黄色阳性颗粒, 而对照组肝细胞未见人小分子Fab抗体的表达; 实验组小鼠部分肾小球毛细血管腔内壁也可见和肾脏集合管壁可见附着的棕黄色颗粒, 其他肾实质细胞未见表达, 对照组肾组织未见Fab蛋白表达; 脾脏免疫组化显示实验组与对照组无明显差异. 图3显示了实验3组与对照组各组织的免疫组化结果.在实验组的不同剂量组肝脏均可见阳性转染细胞, 而随着pXXUF1-HBs-Fab注射剂量的增加脾脏和肾脏未见实质细胞有的人抗HBsAg Fab阳性表达.
基因工程抗体技术将重组DNA技术和遗传学及免疫球蛋白结构功能方面的知识相结合, 对抗体分子进行有目的的改造, 从而创建新的有价值的抗体分子. 目前通过基因工程手段获得的工程抗体分子和抗体片段正在被越来越多的用于科学研究和临床疾病的诊治[8-10], HBsAb的人鼠嵌合抗体、全人源化抗体片段如Fab和scFv在国内均已开展研究, 但大多处于抗体库构建、大肠杆菌表达、酵母菌表达或植物细胞表达等水平, 尚无用于临床基因治疗的研究[11-13]. 抗体分子为真核蛋白, 其体内形成过程涉及胞内分隔作用以及转运酶、折叠酶及异构酶等蛋白的相互作用和翻译后的糖基化、磷酸化、羟基化等多种修饰作用, 这与原核细胞大不相同. 哺乳动物细胞表达体系的最大优点是: 有关抗体分子合成、加工和分泌的信号都能被哺乳动物细胞准确而有效的识别. 并且哺乳动物细胞内质网中有完善的重折叠机制, 可以对抗体分子进行糖基化, 故常作为宿主细胞用于表达真核基因. 已有报导表明抗体基因可以在非淋巴细胞类宿主表达, 如COS, CHO和骨髓瘤细胞[14-17]. 另外不同文献报道, 抗体信号肽或者第一框架区中一个氨基酸的改变即可降低抗体的表达, 同样轻链可变区中仅一个氨基酸的改变即可阻断抗体的分泌[18]. 由此看来, 抗体可变区中氨基酸序列对抗体的表达量具有重要的影响, 因为个别氨基酸的改变可能会影响了可变区结构域的折叠. 为了研究我们构建的pXXUF1-HBs-Fab能否在哺乳动物非淋巴细胞中表达, 并能正确折叠具有结合抗原的能力, 我们采用尾静脉液压法对C57BL/6小鼠进行转染, 验证该重组载体在哺乳动物体内表达人源性抗HBsAg-Fab的能力. 我们已将anti-HBsAg轻链和重链Fd的表达序列插入同一质粒, 并位于内部核糖体进入位点(internal ribosome entry sites, IRES)[19-21]的两端, 不仅省去了二次转染的步骤, 而且保证了重链Fd和轻链cDNA的等量表达, 有利于其在真核细胞胞质中正确结合成Fab片段.
尾静脉液压法自1999年报道以来, 由于其介导基因转染的高效性和以肝脏为主要靶器官等特点, 已被广泛用于基因功能研究[22-27]. 我们以anti-HBsAg Fab为报告基因, 建立尾静脉液压注射系统, 进一步研究pXXUF1-HBs-Fab在哺乳动物体内表达的能力, 同时还初步验证了该方法介导的目的基因在小鼠体内转染分布情况. 实验组小鼠免疫组化结果显示anti-HBsAg Fab基因可通过尾静脉大容量快速注射法高效转染肝细胞, 这一结果与文献报导一致. 理论上pXXUF1-HBs-Fab通过尾静脉进入体内后, 会通过血液循环到达全身, 但由于这种尾静脉高压注射方法将DNA大部分压入肝脏, 所有其他部分DNA含量很少[28]. 我们研究各组小鼠的肝脏、肾脏和脾脏组织RT-PCR结果显示实验组小鼠的肝脏组织中可检测到人抗HBsAg抗体Fd重链及k轻链的mRNA表达; 而肾脏和脾脏组织未检测到目的蛋白的表达, 且与注射质粒剂量无关. Zhang et al[29]分析这种转染可能是由于大体积DNA溶液快速注射到小鼠体内后在心脏发生阻塞, 溶液返回来后通过肝静脉进入肝脏所致, 但可能原因不止于此. Budker et al[30]推测质粒的吸收是通过受体介导非特异吸收的途径进入细胞的, 质粒与细胞表面的接触时间可能会大大提高DNA的转染效率. 我们考虑肝脏外其他组织在转染初期可能有质粒DNA流经, 但未能进入组织细胞, 故不能检测到细胞内有抗HBsAg Fab的mRNA及蛋白合成表达. 小鼠肾脏的免疫组化结果显示pXXUF1-HBs-Fab转染组小鼠部分肾小球毛细血管腔内壁和肾脏集合管壁可见附着的Fab抗体, 但未见肾实质细胞内有anti-HBsAg Fab的表达. 这一现象说明Fab蛋白的分子质量较小, 可通过肾小球过滤而从血液中清除. 从不同的角度来看这一现象既是Fab蛋白的优点又是缺点. 一方面其半衰期短, 可以结合抗原很快从血中清除; 但另一方面有可能影响其局部有效浓度. 但对Fab蛋白功能的具体影响还需进一步研究. 实验还进一步研究了质粒DNA注射剂量与目的蛋白表达水平的关系, 其中注射5 mg和10 mg质粒后小分子抗体Fab的表达量无显著差异, 但于20 mg和40 mg注射组之间差异显著, 随着pXXUF1-HBs-Fab剂量的增加血清中目的蛋白水平逐渐升高.
Liu et al[28]与Zhang et al[29]等均强调压力的产生是细胞吸收DNA的必要条件. 注射速度和注射体积直接影响到DNA的转染效率, 7 s内注射2-3 mL体积可达到最高表达水平. 我们采用这一注射条件, 注射后小鼠100%成活, 并检测小鼠体内anti-HBsAg Fab的表达水平可达954.1±12.7 mg/L. 裸质粒与病毒载体相比具有很多优点, 如安全, 易制备, 因而费用低, 且可重复. 尾静脉液压法是一种简单而高效的基因转染方法, 观察时间短, 在快速检测基因体内表达能力方面明显优于其他方法, 但该方法不能直接用于人体实验, 所以将anti-HBsAg Fab用于临床预防乙肝复发的应用研究则须利于pXXUF1-HBs-Fab生产出rAAV, 证实安全有效后才能运用于人体. 我们已在体外对转染质粒的细胞系表达的目的蛋白进行纯化, 并初步证明其能预防HBV感染人原代肝细胞的功能(即将发表). 目前尚无小鼠感染HBV的模型, 因此不能在小鼠体内验证该anti-HBsAg Fab的抗HBV感染肝细胞的能力; 且小鼠体内表达的目的蛋白量少, 纯化后于体外验证功能可能性也不大. 因此本文我们未对蛋白功能进行深入探讨.
我国肝移植受者多为乙肝相关终末期肝病患者, 这些患者移植后极易发生乙肝病毒(HBV)的复发感染, 而复发后生存率明显下降. 运用基因治疗方法在受者体内表达保护性抗HBsAg小分子Fab抗体预防HBV复发感染的研究对提高我国肝移植患者生存率和生存质量具有重要意义.
1 裸质粒注射需要解决长期、稳定、高水平表达的问题. 因此可以使用腺相关病毒载体转染已达到长期稳定和高水平表达的目的.
2 目前尚无小鼠HBV感染模型, 体内检验抗HBsAg小分子Fab抗体预防HBV感染功能还是难题, 只能于灵长类动物体内研究其抗HBV感染能力.
目前国内外临床预防肝移植后乙肝复发的手段主要是乙肝免疫球蛋白(HBIG)、拉米呋啶等抗病毒药物、乙肝疫苗主动免疫等. 乙肝免疫球蛋白(HBIG) 预防是目前阻止HBV再感染和改善长期生存质量最有效的一种方法, 但这一措施应用于临床还存在许多问题: 治疗费用十分昂贵; 人源血液制品来源困难且可能有病原微生物的污染; 长期静脉注射可能造成汞中毒等. 因而HBIG实际临床应用受限, 我国尤为突出.
国内外在HBsAb的人鼠嵌合抗体、全人源化抗体片段如Fab和scFv已开展研究, 但大多处于抗体库构建、大肠杆菌表达、酵母菌表达或植物细胞表达等水平, 尚无用于哺乳动物基因治疗的研究.
基因工程抗体分子和抗体片断正在被越来越多的用于科学研究和临床疾病的诊治, HBsAb的人鼠嵌合抗体、全人源化抗体片段如Fab和scFv在国内均已开展研究, 但大多处于抗体库构建、大肠杆菌表达、酵母菌表达或植物细胞表达等水平, 尚无用于临床基因治疗的研究. 我们已构建了含有抗HBsAg抗体的重链Fd段和k轻链基因的真核表达质粒pXXUF1-HBs-Fab. 在本研究中证明重组抗HBsAg Fab可以在哺乳动物细胞体内分泌表达, 通过裸质粒注射的方法主要在肝脏表达, 并可进入血液循环, 通过肾脏代谢.
研究证明重组抗HBsAg Fab可以在哺乳动物细胞体内分泌表达, 通过裸质粒注射的方法主要在肝脏表达, 并可进入血液循环, 通过肾脏代谢, 充分验证其体内转染表达特点. 今后将转染该重组抗HBsAg Fab入灵长类动物体内, 继续研究其抗HBV感染的功能及基因治疗安全性, 最终运用于肝移植受者预防HBV复发感染.
小分子抗体Fab: Fab由重链Fd段(VH+CH1)和完整的轻链组成, 二者通过一个链间二硫键连接, 形成异二聚体, 是完整抗体的1/3, 仅有一个抗原结合位点. 属于小分子抗体. 他具有许多优点: 1: 分子小, 免疫源性低, 用于人体不易产生抗异种蛋白反应; 2: 易于渗透到达病灶周围的微循环; 3: 血循环和全身清除快, 半衰期短, 肾脏蓄积少; 4: 无Fc段, 不易与具有Fc受体的非靶细胞结合. 这些都是杂交瘤技术产生的抗体无法比拟的优点, 具有良好的应用前景.
该文采用裸质粒直接注射的方法, 介导外源性基因在小鼠体内的表达, 且研究的靶基因为在抗HBV感染中具有保护作用的抗HBsAg Fab, 因此从研究方法和研究结果来说均具有重要的价值.
电编: 李琪 编辑:潘伯荣
| 3. | Ho BM, So SK, Esquivel CO, Keeffe EB. Liver transplantation in Asian patients with chronic hepatitis B. Hepatology. 1997;25:223-225. [PubMed] [DOI] |
| 4. | Todo S, Demetris AJ, Van Thiel D, Teperman L, Fung JJ, Starzl TE. Orthotopic liver transplantation for patients with hepatitis B virus-related liver disease. Hepatology. 1991;13:619-626. [PubMed] |
| 5. | Karliova M, Malago M, Trippler M, Valentin-Gamazo C, Rothaar T, Broelsch CE, Gerken G, Treichel U. Seroconversion in patients with acute hepatitis B reinfection after liver transplantation with a combined treatment of lamivudine and hepatitis B immune globulin. Transplant Proc. 2002;34:3319-3322. [PubMed] [DOI] |
| 6. | Seehofer D, Berg T. Prevention of hepatitis B recurrence after liver transplantation. Transplantation. 2005;80:S120-S124. [PubMed] [DOI] |
| 7. | Terrault NA, Carter JT, Carlson L, Roland ME, Stock PG. Outcome of patients with hepatitis B virus and human immunodeficiency virus infections referred for liver transplantation. Liver Transpl. 2006;12:801-807. [PubMed] [DOI] |
| 8. | Becker W, Goldenberg DM, Wolf F. The use of monoclonal antibodies and antibody fragments in the imaging of infectious lesions. Semin Nucl Med. 1994;24:142-153. [PubMed] [DOI] |
| 9. | Sibler AP, Kempf E, Glacet A, Orfanoudakis G, Bourel D, Weiss E. In vivo biotinylated recombinant antibodies: high efficiency of labelling and application to the cloning of active anti-human IgG1 Fab fragments. J Immunol Methods. 1999;224:129-140. [PubMed] [DOI] |
| 10. | Boder ET, Wittrup KD. Yeast surface display for directed evolution of protein expression, affinity, and stability. Methods Enzymol. 2000;328:430-444. [PubMed] [DOI] |
| 11. | Ning D, Junjian X, Qing Z, Sheng X, Wenyin C, Guirong R, Xunzhang W. Production of recombinant humanized anti-HBsAg Fab fragment from Pichia pastoris by fermentation. J Biochem Mol Biol. 2005;38:294-299. [PubMed] |
| 12. | Maeda F, Takekoshi M, Nagatsuka Y, Aotsuka S, Tsukahara M, Ohshima A, Kido I, Ono Y, Ihara S. Production and characterization of recombinant human anti-HBs Fab antibodies. J Virol Methods. 2005;127:141-147. [PubMed] [DOI] |
| 13. | Zheng DY, Luo RC, Cai HB. Conditions for large-scale production of genetically engineered E.coli bearing humanized anti- HBsAg Fab. DiYi JunYi Da Xue XueBao. 2004;24:517-520. [PubMed] |
| 14. | Afanasieva TA, Wittmer M, Vitaliti A, Ajmo M, Neri D, Klemenz R. Single-chain antibody and its derivatives directed against vascular endothelial growth factor: application for antiangiogenic gene therapy. Gene Ther. 2003;10:1850-1859. [PubMed] [DOI] |
| 15. | Takai T, Okumura K, Ra C, Yokota T, Okumura Y. Expression of humanized Fab fragments that recognize the IgE-binding domain of human Fc(epsilon)RIalpha in COS and CHO cells. J Biochem (Tokyo). 2001;129:5-12. [PubMed] [DOI] |
| 16. | Norderhaug L, Olafsen T, Michaelsen TE, Sandlie I. Versatile vectors for transient and stable expression of recombinant antibody molecules in mammalian cells. J Immunol Methods. 1997;204:77-87. [PubMed] [DOI] |
| 17. | Evans MJ, Hartman SL, Wolff DW, Rollins SA, Squinto SP. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J Immunol Methods. 1995;184:123-138. [PubMed] [DOI] |
| 18. | Xu Y, Graves PN, Tomer Y, Davies TF. CTLA-4 and autoimmune thyroid disease: lack of influence of the A49G signal peptide polymorphism on functional recombinant human CTLA-4. Cell Immunol. 2002;215:133-140. [PubMed] [DOI] |
| 19. | Xu L, Shao H, Wu W, Cao Z, Zhao Z, Liu H, Jiang D, Mao X, Li W. Co-expression of the complement regulatory proteins human DAF and CD59 with an IRES-mediated dicistronic mammalian vector enhances their cell protective effects. Int J Mol Med. 2005;16:409-414. [PubMed] [DOI] |
| 20. | Mokrejs M, Vopalensky V, Kolenaty O, Masek T, Feketova Z, Sekyrova P, Skaloudova B, Kriz V, Pospisek M. IRESite: the database of experimentally verified IRES structures (www.iresite.org). Nucleic Acids Res. 2006;34:D125-D130. [PubMed] [DOI] |
| 21. | Fernandez J, Yaman I, Huang C, Liu H, Lopez AB, Komar AA, Caprara MG, Merrick WC, Snider MD, Kaufman RJ. Ribosome stalling regulates IRES-mediated translation in eukaryotes, a parallel to prokaryotic attenuation. Mol Cell. 2005;17:405-416. [PubMed] [DOI] |
| 22. | Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 1999;6:1258-1266. [PubMed] [DOI] |
| 23. | Zhang G, Budker V, Wolff JA. High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA. Hum Gene Ther. 1999;10:1735-1737. [PubMed] [DOI] |
| 24. | Vorup-Jensen T, Jensen UB, Liu H, Kawasaki T, Uemura K, Thiel S, Dagnaes-Hansen F, Jensen TG. Tail-vein injection of mannan-binding lectin DNA leads to high expression levels of multimeric protein in liver. Mol Ther. 2001;3:867-874. [PubMed] [DOI] |
| 25. | Wolff JA, Budker V. The mechanism of naked DNA uptake and expression. Adv Genet. 2005;54:3-20. [PubMed] [DOI] |
| 26. | Herweijer H, Wolff JA. Progress and prospects: naked DNA gene transfer and therapy. Gene Ther. 2003;10:453-458. [PubMed] [DOI] |
| 27. | Liu F, Nishikawa M, Clemens PR, Huang L. Transfer of full-length Dmd to the diaphragm muscle of Dmd(mdx/mdx) mice through systemic administration of plasmid DNA. Mol Ther. 2001;4:45-51. [PubMed] [DOI] |
| 28. | Liu D, Knapp JE. Hydrodynamics-based gene delivery. Curr Opin Mol Ther. 2001;3:192-197. [PubMed] |
| 29. | Zhang G, Song YK, Liu D. Long-term expression of human alpha1-antitrypsin gene in mouse liver achieved by intravenous administration of plasmid DNA using a hydrodynamics-based procedure. Gene Ther. 2000;7:1344-1349. [PubMed] [DOI] |
| 30. | Budker V, Budker T, Zhang G, Subbotin V, Loomis A, Wolff JA. Hypothesis: naked plasmid DNA is taken up by cells in vivoby a receptor-mediated process. J Gene Med. 2000;2:76-88. [PubMed] [DOI] |