修回日期: 2006-04-19
接受日期: 2006-04-24
在线出版日期: 2006-05-28
目的: 探讨部分肝移植后, 粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)对部分肝移植物再生的促进作用.
方法: 采用改良"二袖套法"建立SD大鼠50%部分肝移植模型, 受体鼠随机分为实验组和对照组, 术后分别注射(sc) G-CSF和相同体积的生理盐水5 d. 观察大鼠移植肝存活时间. 术后1, 3, 5, 7和14 d取血清和移植肝脏, 测移植物与受体质量比(graft-recipient weight ratio, GRWR), 检测血清生化指标, 并采用免疫组织化学方法观察肝内的增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的表达.
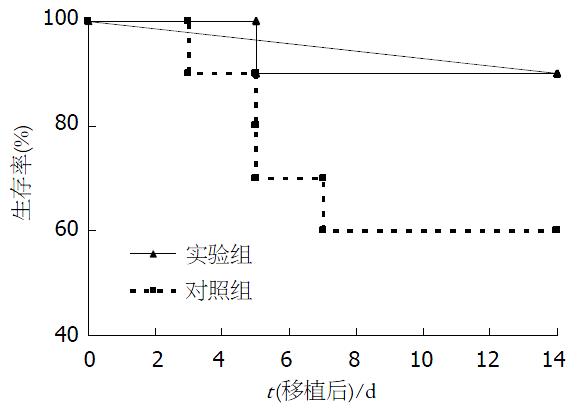
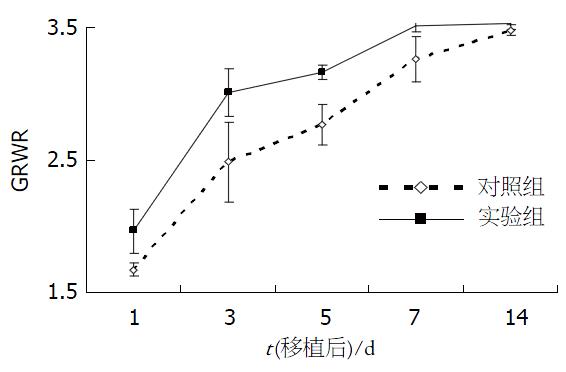
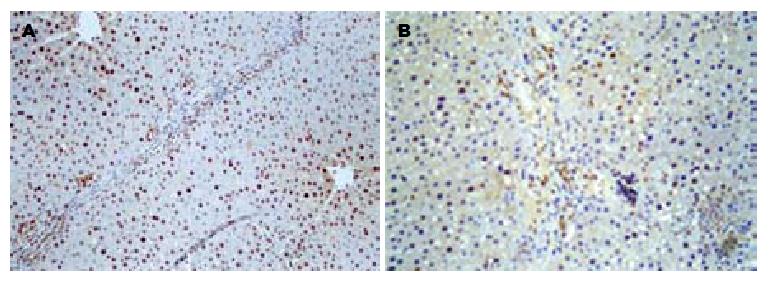
结果: 实验组移植肝存活率较对照组高(90% vs 60% , χ2 = 5.03, P<0.05), 术后第3-5天, 实验组GRWR较对照组明显增加(P<0.05). 两组肝再生均于移植后3 d达高峰. 与对照组相比, 实验组肝坏死灶少, AST, ALT水平低(3 d: t = 17.61,P<0.05; t = 20.16, P<0.05; 5 d: t = 15.64, P<0.05; t = 23.08, P<0.05), 白蛋白水平高(3 d: 36.2±4.7 vs29.5±3.4, P<0.05; 5 d: 43.2±4.1 vs 33.8±3.9, P<0.05), PCNA表达升高(t = 23.08, P<0.05).
结论: 大鼠部分肝移植后G-CSF可以促进肝细胞再生, 减轻肝损伤.
引文著录: 陈国栋, 刘玉兰, 尤鹏, 陈宁. 粒细胞集落刺激因子促进大鼠移植肝的再生作用. 世界华人消化杂志 2006; 14(15): 1466-1470
Revised: April 19, 2006
Accepted: April 24, 2006
Published online: May 28, 2006
AIM: To investigate the effect of granulocyte colony-stimulating factor (G-CSF) on the rege-neration of partial liver allograft in rats.
METHODS: Rat models with 50% partial liver transplantation (PLTx) were established, followed by administration of either saline or G-CSF for 5 consecutive days. Livers and serum samples were harvested 1 3, 5, 7 and 14 d after PLTx. GRWR (graft-recipient weight ratio) and serum biochemical parameters were calculated or measured, and the expression of PCNA (proliferating cell nuclear antigen) was detected by immunohistochemistry (SABC).
RESULTS: As compared with that in control group, the survival rate of liver allograft was significantly higher (90% vs 60%, χ2= 5.03, P < 0.05) in G-CSF groups. Three days after PLTx, liver regeneration reached the peak in both groups. In comparison with those in the controls, GRWR was increased (P < 0.05), and the level of aspartate transaminase (AST) and alanine aminotransferase (ALT) were lower (3 d: t = 17.61, P < 0.05; t = 20.16, P < 0.05; 5 d: t = 15.64, P < 0.05; t = 23.08, P < 0.05); the level of albumin (ALB) (3 d: 36.2 ± 4.7 vs 29.5 ± 3.4, P < 0.05; 5 d: 43.2 ± 4.1 vs 33.8 ± 3.9, P < 0.05) and the expression of PCNA (t = 23.08, P < 0.05) were higher 3 and 5 d after PLTx in G-CSF groups.
CONCLUSION: G-CSF can promote the regeneration and alleviate the injury of partial liver allograft in rats.
- Citation: Chen GD, Liu YL, You P, Chen N. Granulocyte colony stimulating factor accelerates regeneration and attenuates injury of partial liver allograft in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(15): 1466-1470
- URL: https://www.wjgnet.com/1009-3079/full/v14/i15/1466.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i15.1466
临床肝移植近年来发展迅速, 但供肝的缺乏严重影响临床肝移植发展[1-2]. 部分肝移植为解决供肝来源问题开拓了新的途径[3-5], 但移植后肝脏受缺血再灌注损伤、免疫抑制剂及宿主免疫系统应答等多种因素的影响, 肝再生情况不同于肝切除的肝再生[6-18]. 近来研究表明粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)可能具有促进细胞再生的能力[19-23], 故本实验观察其是否可以促进部分肝移植物的再生.
取SD纯系♂220-280 g大鼠, 随机分为2组(每一时间点6只). 实验组通过对Kamada法[24]改进, 熟练掌握二袖套法原位肝移植的手术技术, 达到1 wk存活率>90%后开始正式实验. 治疗组: 同基因大鼠原位50%部分肝移植(SD→SD)术(切除左外叶、部分中叶和尾叶), 3 h后用生理盐水稀释的rhG-CSF每日10 μg/kg, sc, 共5 d. rhG-CSF由麒麟鲲鹏(中国)生物药业有限公司生产, 商品名为惠尔血, 制剂标示量为75 μg/支. 给药前用生理盐水稀释至所需浓度. 对照组: 50%部分肝移植, 3 h后等量生理盐水sc 5 d. 分别于术后1, 3, 5, 7, 14 d从各组中取6只大鼠. 称取移植肝和受鼠的质量, 测移植物与受体质量比(GRWR)[25]. 将一部分肝脏组织块40 g/L甲醛固定, 石蜡包埋; 一部分肝脏组织块OCT包埋, 液氮速冻, -70 ℃保存备用.
取血标本室温下静置, 离心后, 取血清低温(-20 ℃)保存, 全自动生化分析仪检测丙氨酸氨基转移酶(alanine aminotransferase, ALT), 天冬氨酸氨基转移酶(aspartate aminotransferase, AST)和白蛋白(albumin, ALB)水平. 免疫组织化学(SABC)的方法检测肝组织石蜡切片中检测增殖细胞核抗原(PCNA)(武汉博士德公司)的表达, 操作按说明书进行. 结果判定标准: PCNA以细胞核呈界限清楚的棕色反应为阳性. 阳性结果分级按以下标准记录, 即每张切片随机观察5个高倍视野, 每个视野计100个细胞中的阳性细胞数, 取均值, 以百分数表示细胞增殖指数.
统计学处理 计量资料以mean±SD表示, 采用统计软件SPSS 10.0分析. 先以F检验判断其方差齐型, 各时间点两组间比较采用t检验, P<0.05为差异有统计学意义. 生存时间绘制成Kaplan-Meier曲线, 比较采用对数秩检验(log-rank), P<0.05为差异有显著性.
实验组14 d存活率(90%)高于对照组生存率(60%). 差异有统计学意义(c2 = 5.03, P<0.05, 图1). 实验组在术后3-5 d时GRWR明显较对照组高, 差异有统计学意义(P<0.05, 图2). 移植后3 d, 移植肝脏有轻度的汇管区单核细胞浸润, 肝细胞点状坏死灶, 并可见中央小静脉、肝窦和叶间静脉轻度扩张, 肝结构基本正常, 与对照组相比, 实验组移植后7-14 d汇管区浸润明显, 组织结构较好, 肝坏死灶少. 移植后3 d, 实验组细胞核有丝分裂像增多, 双核及三核细胞也显著增多, 7 d时肝细胞核分裂及多核肝细胞减少.
两组ALT和AST均于术后1 d升高, 然后呈下降趋势. 实验组和对照组相比, 以移植后3-5 d差异有显著性(3 d: ALT: 6601±567 vs 8802±950 nkat/L, t = 20.16, P<0.05; AST: 12 186±984 vs 17 153±1284 nkat/L, t = 17.61, P<0.05) (5 d: ALT: 4134±733 vs 6435±1000 nkat/L, t = 23.08, P<0.05; AST: 2884±517vs 9519±2884 nkat/L, t = 15.64, P<0.05), 实验组ALB水平在术后第3-5天时较对照组增高, 差异有显著性(P<0.05, 表1).
| 移植后(d) | ALT (nkat/L) | AST (nkat/L) | ALB (g/L) | PCNA (%) | ||||
| 实验组 | 对照组 | 实验组 | 对照组 | 实验组 | 对照组 | 实验组 | 对照组 | |
| 1 | 12 703±667 | 12 503±1450 | 20 921±3784 | 22 621±984 | 27.4±3.2 | 26.1±2.0 | 27.7±6.0 | 27.2±6.1 |
| 3 | 6601±567a | 8802±950 | 12 186±984a | 17 153±1284 | 36.2±4.7a | 29.5±3.4 | 67.7±14.0a | 56.8±6.0 |
| 5 | 4134±733a | 6435±1000 | 2884±517a | 9519±2884 | 43.2±4.1a | 33.8±3.9 | 33.3±6.7a | 24.7±5.1 |
| 7 | 1334±367 | 1817±317 | 2167±467 | 2534±900 | 46.1±3.7 | 42.1±4.4 | 23.2±5.6 | 19.8±5.7 |
| 14 | 934±350 | 1150±317 | 2184±700 | 2534±683 | 49.0±2.7 | 44.1±3.1 | 8.8±2.3 | 13.3±3.1 |
除影响大鼠原位全肝移植手术成功的因素外, 部分肝移植还有其独特的影响因素, 即移植肝体积减少可能导致肝功能衰竭. 本实验用"二袖套法"肝移植技术进行部分肝移植手术, 受体大鼠术中无死亡, 术后24 h内死亡亦被考虑为手术技术所致, 手术成功率与早期报道一致[26].
G-CSF是一种促粒细胞增殖的细胞因子. 近来研究表明G-CSF可以促进心肌梗塞后梗死心肌和血管的再生及促进出血性休克的修复[19-20], 提示G-CSF可能具有损伤修复的作用. 早期的研究也表明G-CSF具有增加部分肝切除后剩余肝脏的再生能力[21-23]. 而部分移植肝脏的再生能力除与肝脏的容量丧失有关, 还与缺血再灌注损伤、免疫抑制剂及宿主免疫系统应答等多种因素有关, 肝再生情况不同于肝切除的肝再生. 故我们观察G-CSF是否有助于部分移植肝脏的损伤修复. 部分肝移植物受损伤刺激启动其再生, 通过增殖以代偿. 因此肝再生是肝损伤的修复过程, 肝再生和肝损伤是一矛盾统一体, 其损伤和再生的程度与肝功能密切相关. 本研究中发现实验组存活率高于对照组. 组织学表明实验组中, 移植后第3-5天, 汇管区单个核细胞浸润明显, 移植后第7-14天, 肝组织结构整齐, 坏死灶减少, 肝损伤小. 血清学指标也进一步证实肝损伤比对照组轻. 提示G-CSF减轻了部分移植肝脏的损伤. GRWR在一定程度上反映细胞再生的情况; PCNA是一种与细胞周期相关的增殖细胞核抗原, 存在并合成于核内, 静止细胞中PCNA含量很少, 增殖细胞和转化细胞中其含量发生明显变化, 其含量和表达强弱的变化与DNA合成及DNA复制的活跃程度一致. 本研究中, 实验组移植物的GRWR和PCNA的表达在术后第3, 5天时明显高于对照组. 提示G-CSF能促进部分移植肝再生. 而术后第7天时两组移植物GRWR、肝细胞PCNA标记指数的差异无统计学意义, 这可能是由于术后第7天时两组移植物细胞再生的过程均已完成. 虽然大鼠部分肝移植后移植肝的细胞再生较大鼠部分肝切除后剩余肝脏的再生要延迟[27], 但有报道部分肝移植后的大鼠仍具有很强的细胞再生能力[8], 术后1 wk时肝脏的再生已基本完成, 这与本研究结果相符.
在实验组中, 肝损伤减少, 肝再生能力增加, 这提示G-CSF可能通过多种途径来对部分移植肝发挥作用. 一方面G-CSF促进部分肝切除模型中肝脏的再生, 说明G-CSF可以直接增加肝细胞的再生能力; 另一方面, G-CSF可以改变细胞因子的水平(如: TNF-α)[28], 而肝脏是多种细胞因子的靶器官, 故可能通过细胞因子对肝脏产生直接或间接的影响; 再者, G-CSF可以动员干细胞入血[29-30], 故动员的肝系相关的干细胞可能归巢入肝脏, 参与肝再生. 因此, 我们认为, G-CSF能够促进移植肝的细胞再生, 减轻肝损伤, 说明这种方法是有效的, 为临床应用提供了依据. 但需作进一步的研究明确其更深入的作用机制, 并了解其药物的量效关系及其副作用.
临床肝移植近年来发展迅速, 但供肝的缺乏严重影响临床肝移植发展. 部分肝移植为解决供肝来源问题开拓了新的途径, 但移植后肝脏受缺血再灌注损伤、免疫抑制剂及宿主免疫系统应答等多种因素的影响, 肝再生情况不同于肝切除的肝再生. 因此如何促进部分移植物迅速再生, 进而保障肝脏正常功能和受体存活显的尤为重要.
提高部分肝移植物存活率的研究主要集中于提高手术技术和改善缺血再灌注损伤方面, 如何促进肝再生方面的相关报道较少.
如何提高部分肝移植物的存活率, 目前主要集中于缺血再灌注损伤、免疫抑制剂的研究; 而如何提高肝再生的能力, 国内有使用IL-10, IL-18等的相关报道.
本文利用大鼠部分肝移植模型, 证实G-CSF可以促进部分肝移植物的再生, 减轻肝损伤.
本研究为今后临床部分肝移植术后更好地促进部分肝移植物的再生, 提高受体存活率, 提供了实验依据.
G-CSF: 粒细胞集落刺激因子, 作为一种促粒细胞增殖的细胞因子应用于临床, 近年来研究发现G-CSF还可以改变细胞因子的水平并促进细胞增殖的作用.
本文探讨了粒细胞集落刺激因子对大鼠移植肝再生的促进作用, 立题具有一定的创新性, 也具有一定的理论和实践意义, 但整体研究内容单薄.
电编: 张敏 编辑:潘伯荣
| 1. | Thalheimer U, Capra F. Liver transplantation: making the best out of what we have. Dig Dis Sci. 2002;47:945-953. [PubMed] [DOI] |
| 3. | de Jonge J, Kazemier G, Metselaar HJ, Tilanus HW. Partial liver transplantation. Scand J Gastroenterol Suppl. 2001;98-102. [PubMed] [DOI] |
| 5. | Ikegami T, Shiotani S, Ninomiya M, Minagawa R, Nishizaki T, Shimada M, Sugimachi K. Auxiliary partial orthotopic liver transplantation from living donors. Surgery. 2002;131:S205-210. [PubMed] [DOI] |
| 6. | Xu MQ, Yao ZX. Functional changes of dendritic cells derived from allogeneic partial liver graft un-dergoing acute rejection in rats. World J Gastroenterol. 2003;9:141-147. [PubMed] [DOI] |
| 7. | Fausto N, Riehle KJ. Mechanisms of liver regenera-tion and their clinical implications. J Hepatobiliary Pancreat Surg. 2005;12:181-189. [PubMed] [DOI] |
| 9. | Dahm F, Georgiev P, Clavien PA. Small-for-size syndrome after partial liver transplantation: definition, mechanisms of disease and clinical implications. Am J Transplant. 2005;5:2605-2610. [PubMed] [DOI] |
| 10. | Guo L, Haga S, Enosawa S, Naruse K, Harihara Y, Sugawara Y, Irani K, Makuuchi M, Ozaki M. Impro-ved hepatic regeneration with reduced injury by redox factor-1 in a rat small-sized liver transplant model. Am J Transplant. 2004;4:879-887. [PubMed] [DOI] |
| 12. | Cheng F, Li XC, Wang XH, Qian XF, Wang K, Huang P. Relationship between the expression of IL-10 and liver regeneration following reduced-size orthotopic liver transplantation in rats. Zhonghua Ganzangbing Zazhi. 2003;11:552-554. [PubMed] |
| 15. | Eguchi S, Yanaga K, Sugiyama N, Okudaira S, Furui J, Kanematsu T. Relationship between portal venous flow and liver regeneration in patients after living donor right-lobe liver transplantation. Liver Transpl. 2003;9:547-551. [PubMed] [DOI] |
| 16. | Selzner N, Selzner M, Tian Y, Kadry Z, Clavien PA. Cold ischemia decreases liver regeneration after partial liver transplantation in the rat: A TNF-alpha/IL-6-dependent mechanism. Hepatology. 2002;36:812-818. [PubMed] [DOI] |
| 17. | Dirsch O, Dahmen U, Gu YL, Shen K, Li J, Fan LM, Broelsch CE. Influence of cold ischemia on liver regeneration after partial liver transplantation. Transplant Proc. 2002;34:2303-2304. [PubMed] [DOI] |
| 18. | Xu MQ, Suo YP, Gong JP, Zhang MM, Yan LN. Augmented regeneration of partial liver allograft induced by nuclear factor-kappaB decoy oligode-oxynucleotides-modified dendritic cells. World J Gastroenterol. 2004;10:573-578. [PubMed] [DOI] |
| 19. | Fukuhara S, Tomita S, Nakatani T, Ohtsu Y, Ishida M, Yutani C, Kitamura S. G-CSF promotes bone marrow cells to migrate into infarcted mice heart, and differentiate into cardiomyocytes. Cell Transplant. 2004;13:741-748. [PubMed] [DOI] |
| 20. | Meng ZH, Dyer K, Billiar TR, Tweardy DJ. Distinct effects of systemic infusion of G-CSF vs. IL-6 on lung and liver inflammation and injury in hemorr-hagic shock. Shock. 2000;14:41-48. [PubMed] [DOI] |
| 21. | Theocharis SE, Papadimitriou LJ, Retsou ZP, Margeli AP, Ninos SS, Papadimitriou JD. Granulo-cyte-colony stimulating factor administration ameliorates liver regeneration in animal model of fulminant hepatic failure and encephalopathy. Dig Dis Sci. 2003;48:1797-1803. [PubMed] [DOI] |
| 22. | Theocharis SE, Margeli AP, Kittas CN. Effect of granulocyte colony-stimulating-factor administra-tion on tissue regeneration due to thioacetamide-induced liver injury in rats. Dig Dis Sci. 1999;44:1990-1996. [PubMed] [DOI] |
| 23. | Yannaki E, Athanasiou E, Xagorari A, Constantin-ou V, Batsis I, Kaloyannidis P, Proya E, Anagnosto-poulos A, Fassas A. G-CSF-primed hematopoietic stem cells or G-CSF per se accelerate recovery and improve survival after liver injury, predominantly by promoting endogenous repair programs. Exp Hematol. 2005;33:108-119. [PubMed] [DOI] |
| 24. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 25. | Gu Y, Dirsch O, Dahmen U, Ji Y, He Q, Chi H, Broelsch CE. Impact of donor gender on male rat recipients of small-for-size liver grafts. Liver Transpl. 2005;11:669-678. [PubMed] [DOI] |
| 27. | Wang J, Tahara K, Hakamata Y, Mutoh H, Murakami T, Takahashi M, Kusama M, Kobayashi E. Auxiliary partial liver grafting in rats: effect of host hepatectomy on graft regeneration, and review of literature on surgical technique. Microsurgery. 2002;22:371-377. [PubMed] [DOI] |
| 28. | Xu S, Hoglund M, Hakansson L, Venge P. Granulo-cyte colony-stimulating factor (G-CSF) induces the production of cytokines in vivo. Br J Haematol. 2000;108:848-853. [PubMed] [DOI] |
| 29. | Kroger N, Renges H, Kruger W, Gutensohn K, Loliger C, Carrero I, Cortes L, Zander AR. A randomized comparison of once versus twice daily recombinant human granulocyte colony-stimulating factor (filgrastim) for stem cell mobilization in healthy donors for allogeneic transplantation. Br J Haematol. 2000;111:761-765. [PubMed] |
| 30. | Elfenbein GJ. Granulocyte-colony stimulating factor primed bone marrow and granulocyte-colony stimulating factor mobilized peripheral blood stem cells are equivalent for engraftment: which to choose? Pediatr Transplant. 2005;9 Suppl 7:37-47. [PubMed] [DOI] |