修回日期: 2006-03-25
接受日期: 2006-04-06
在线出版日期: 2006-05-18
目的: 探索简便、经济的兔肝硬化造模方法, 并观察造模过程中的肝脏功能和组织病理学变化.
方法: 兔24只, 随机分为2组, 实验组20只给予乙醇灌服, 并sc CCl4, 正常对照组4只给予正常饮水并以等量橄榄油代替CCl4 sc. 每2 wk采集血样和小块肝组织, 进行生化指标检测和肝脏Masson三色胶原染色病理学观察.
结果: 随着四氯化碳处理时间的延长, 肝纤维化程度逐渐加重. 与对照组相比, 实验组8 wk后ALT值和AST值(ALT, 1867.1±200.1 nkat/L vs 883.5±116.7 nkat/L, P = 0.01; AST, 983.5±116.7 nkat/L vs 650.1±133.4 nkat/L, P = 0.03)均显著升高, 而GGT值(100.1±33.3 nkat/L vs 366.7±50.1 nkat/L, P = 0.01)显著降低; 实验8 wk末观察到肝硬化的典型病理表现,可观察到假小叶的形成.
结论: 联合应用CCl4和乙醇可成功诱导兔肝硬化, 该方法动物死亡率低、造模快、成功率高.
引文著录: 李栋, 张乐玲, 侯怀水, 时庆, 沈柏均. 四氯化碳诱导兔肝硬化模型的动态研究. 世界华人消化杂志 2006; 14(14): 1403-1407
Revised: March 25, 2006
Accepted: April 6, 2006
Published online: May 18, 2006
AIM: To establish a relatively simple and feasible rabbit model of liver cirrhosis and analyze the dynamic changes of function and histopathology of cirrhotic liver.
METHODS: Twenty-four New Zealand rabbits were divided into two groups, of which twenty were received subcutaneous injection of carbon tetrachloride (CCl4) along with gastric infusion of edible ethanol for eight weeks. Animals in control group were fed with regular water and injected subcutaneously with the same quantity of olive oil. The development of hepatic fibrosis was recorded by Masson's trichrome method fortnightly. Blood samples were collected to measure the blood protein and enzymes fortnightly.
RESULTS: After treatment with CCl4, hepatic fibrosis was aggravated with time went by. As compared with those in normal controls, the levels of aspartate transaminase (AST) and alanine aminotransferase (ALT) in the experimental groups were increased significantly (AST: 983.5 ± 116.7 nkat/L vs 650.1 ± 133.4 nkat/L, P = 0.03; ALT: 1867.1 ± 200.1 nkat/L vs 883.5 ± 116.7 nkat/L, P = 0.01), while the level of gamma-glutamyl transpeptidase (GGT) was decreased (100.1 ± 33.3 nkat/L vs 366.7 ± 50.1 nkat/L, P = 0.01) at the end of 8 wk. Typical features of liver cirrhosis and the formation of false lobe were observed at the end of 8 wk.
CONCLUSION: Rabbit models of liver cirrhosis, with a low mortality and high success rate, can be established by combination of CCl4 and ethanol in a relatively short time.
- Citation: Li D, Zhang LL, Hou HS, Shi Q, Shen BJ. Dynamic changes of liver in cirrhosis model of rabbits. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1403-1407
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1403.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1403
肝炎、肝硬化和肝癌是严重威胁人类健康的常见疾病, 肝硬化动物模型(liver cirrhosis model, LCM)的制作是开展有关医学药学研究的基础, 对人肝硬化的防治具有重要意义. 由于实验动物不感染人肝炎病毒, 目前缺乏与人类病因完全一致的肝炎LCM, 一般用化学性LCM多为小鼠或大鼠, 大型动物成功少, 作者尝试用CCl4和食用乙醇制作兔肝硬化模型, 并对实验过程中肝功能和组织病理学的改变进行动态观察, 旨在探讨兔肝硬化的病变特点和病理学量化诊断指标, 并探索简便、经济的兔肝硬化的造模方法.
体质量1.8±0.2 kg的健康3月龄♂新西兰大白兔24只及全价营养颗粒兔饲料, 由山东省农科院兔场提供. 试验前血清谷丙氨酸转氨酶(AST)、白蛋白(ALB)及球蛋白(GLB)均正常. 随机分为对照组4只, 实验组20只. CCl4, 橄榄油(上海化学试剂厂, 分析纯); 食用乙醇(景阳春酒业公司); 日本7170生化分析仪.
实验组和对照组每日均喂养正常兔饲料, 实验组第1次按1.5 mL/kg给予双下肢外侧皮下交替多点注射500 mL/L CCl4橄榄油溶液, 每周2次; 第3次开始改为按2.5 mL/kg注射, 持续2 wk; 第5周起再降为1.5 mL/kg, 每周2次; 同时从第1周开始每日用300 mL/L食用乙醇10 mL灌服. 对照组仅注射同体积橄榄油, 正常饮水. 0, 2, 4, 8 wk末保存血液, 评价肝功能指标. 根据预实验结果, 人为的将实验兔肝硬化病程分为3期: 早期变性坏死期; 中期纤维增生期; 晚期假小叶形成期. 在2, 4, 8 wk末随机取2只实验组兔行右肋缘下小切口取小块肝组织, 行HE染色和Masson三色染色, 动态观察实验过程中兔肝脏病理学改变, 包括肝细胞的变性坏死情况、炎性细胞浸润、纤维间隔及假小叶的形成等病理学变化特点. 以肉眼观察到肝硬化结节形成及镜下假小叶形成为肝硬化模型诱导成功. 另取0, 2, 4, 8 wk末血液, 测定ALT; γ-谷氨酰基转肽酶(GGT); 碱性磷酸酶(AKP); 总蛋白(TP); 白蛋白(ALB); 球蛋白(GLB); 白/球比例(A/G)和AST的动态变化.
统计学处理 实验数据以mean±SD表示, 组间差异用t检验分析, P<0.05为差异具有统计学意义.
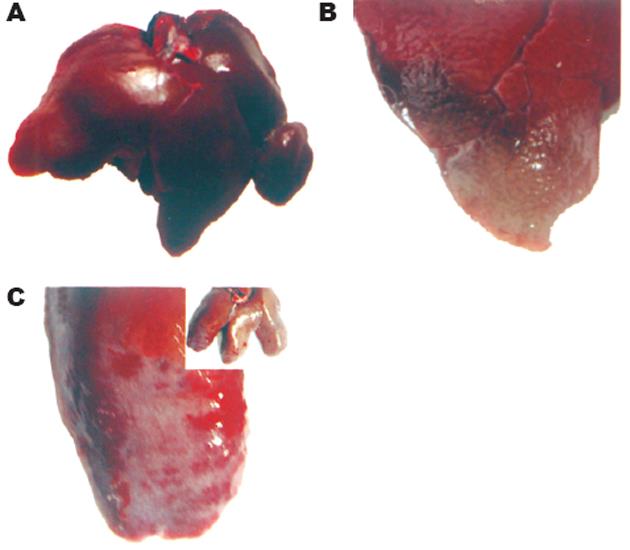
实验动物在造模过程中活动减少, 精神萎靡, 食欲不振, 对外界刺激反应迟钝, 动物毛发蓬乱而无光泽, 前期体质量下降明显, 后期体质量增长缓慢, 多数有溏泻, 用手触摸脊柱两侧肌肉层消失, 骨感明显; 正常组兔则毛发有光泽, 体态活泼, 食量及大便正常, 无嗜睡现象, 脊柱两侧肌肉层丰满. 实验组兔20只在实验2 wk死亡2只, 死亡率为10%, 解剖肝后见显著病理改变(图1B); 正常对照组无一例死亡. 其余有17只于实验8-9 wk末成功诱导出肝硬化(观察到肝硬化结节形成及镜下假小叶形成), 造模成功率达到94.4%.
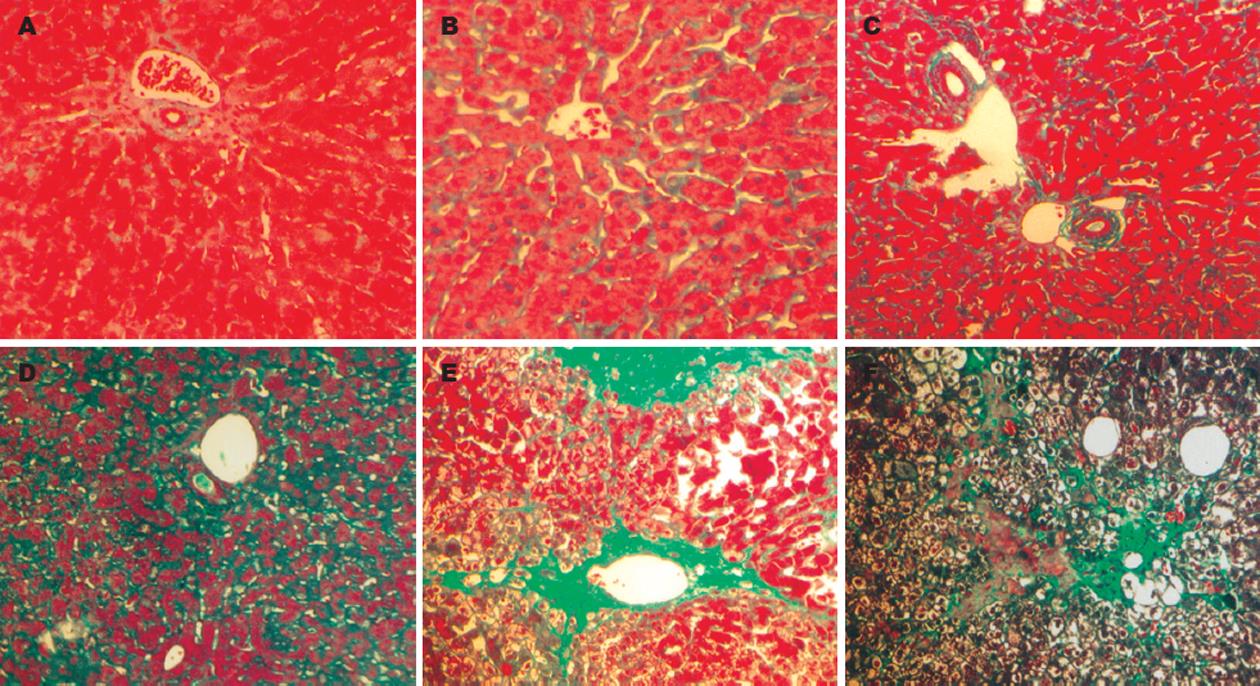
正常肝脏质地柔软光滑, 肝色泽均匀暗红, 大小在正常范围(图1A). 实验组兔8 wk末可见肝脏体积缩小, 表面呈小结节或小颗粒状, 无弹性, 质地硬(图1C). 正常肝脏肝小叶结构完整, 肝细胞索排列整齐, 汇管区清楚, 肝窦轮辐状分布(图2A). 实验2 wk肝充血、水肿、增大, 肝小叶中央静脉附近肝细胞肿胀, 近圆形, 肝窦狭窄, 炎症反应加重(图2B), 实验4 wk肝脏色泽暗µ, 肿胀稍减轻, 中央静脉周围肝细胞呈点、片状坏死(图2C), 部分小叶结构塌陷, 少量纤维结缔组织增生; 6 wk末可见肝内弥漫性纤维组织增生, 肝小叶结构紊乱, 并形成不典型假小叶(图2D). 实验8-9 wk坏死更广泛而严重, 从中央静脉和汇管区放射出的胶原纤维交织成网(图2E). 肝内假小叶广泛形成, 假小叶内肝细胞胞质极度疏松, 脂变严重, 呈大空泡(图2F).
实验前ALT平均883.5 nkat/L, 造模2 wk后升至5451.1 nkat/L, 然后逐渐下降; 0-8 wk: GGT, AKP和A/G值均逐渐下降; AST值也有一过性升高(表1).
| 检验项目 | t(实验后)/wk (mean±SD n = 20) | |||
| 0 | 2 | 4 | 8 | |
| ALT(nkat/L) | 883.5±116.7 | 5451.1±266.7a | 3687.4±266.7a | 1867.1±200.1a |
| GGT(nkat/L) | 366.7±50.1 | 350.1±66.7 | 166.7±33.3a | 100.1±33.3a |
| AKP(nkat/L) | 1416.9±133.4 | 1233.6±100.1 | 1166.9±116.7 | 1150.2±116.7 |
| 总蛋白(g/L) | 66.9±6 | 68.9±6.1 | 62.9±4.1 | 57.5±3.8 |
| 白蛋白(g/L) | 36.6±6.4 | 36.1±6.2 | 29.8±4.6 | 26.8±5a |
| 球蛋白(g/L) | 30.3±5.5 | 32.8±5.9 | 33.1±3.7 | 30.7±2.4 |
| A/G | 1.2 | 1.1 | 0.9 | 0.9 |
| AST(nkat/L) | 650.1±133.4 | 2300.5±166.7a | 1266.9±100.1a | 983.5±116.7a |
LCM建立方法较多, 常见的有血吸虫尾蚴法[1-2]、CCl4法[3-6]、硫代乙酰胺法[7-8]、低剂量长期应用致癌物法[9-10]、胆总管结扎法[11-12]和乙醇性[13-14]肝硬化模型等. 其中CCl4是最能诱导LCM的化学毒物. CCl4经肝微粒体细胞色素P450激活生成CCl3攻击肝细胞膜的磷脂, 引起脂质过氧化破坏膜性结构; CCl3还与蛋白质形成共价键, 损害线粒体, 影响三羧酸Ñ环致肝细胞"窒息"死亡. 低浓度CCl4反复应用使肝脏损害-修复-损害, 最终形成肝硬化[3]. CCl4所致动物肝硬化模型的肝再生能力显著降低, 白细胞介素-6、肿瘤坏死因子和肝细胞生长因子受体c-Met的表达水平下调, 而白细胞介素-1β和血小板激活因子的表达水平却有增加, 可引起门静脉高压等并发症[15-17]. 一般多选用小鼠或大鼠造模, 采用300-600 mL/L CCl4油剂sc或ip, 按1-3 mL/kg, 每周2次, 肝硬化可在12-13 wk形成[3-6,18], 但CCl4对脑肾毒性大, 注射位置易发生浸润性脓肿和溃疡, 故死亡率可高达30%-40%, 如降低CCl4浓度则需延长造模时间, 实验可行性降低. 乙醇与CCl4联合应用造模可起到相辅的效果: 乙醇本身即为肝硬化的重要病因, 成人日摄入量多于30 g/d即可诱发肝硬化[19-20]. 乙醇可刺激肝细胞脂肪合成, 并诱导P450活性, 从而增加CCl4的肝毒性, 加速肝细胞坏死[21-22], 明显减短造模时间, 同时可减少两者剂量从而降低副作用. 最初我们采用300 mL/L乙醇为唯一饮料, 但受注射影响, 兔拒饮现象普遍, 进而影响进食, 体质量下降过快. 后直接采用灌服法, 约60 d即形成了典型的兔肝硬化模型, 具有动物死亡率低、肝硬化成功率高和造模时间短等优点.
预实验发现, 实验组兔死亡多发生在前3 wk, 多伴随口鼻出血, 解剖肝后见显著病理改变(图1B), 考虑多由急性CCl4中毒引起肝坏死, 释放出凝血活酶样物质, 引起血管内皮损害, 导致严重出血有关. 我们将首2次CCl4注射剂量降低, 约1 wk后再提高到2.5 mL/kg, 使其产生耐受过程, 有效降低了死亡率. 实验中还必须注意密切观察, 因为个体间差异, 当有个别兔出现行动呆滞, 体质量显著减少和拒食拒饮的情况, 可暂停注射1-2次, 避免死亡.
病理学检查仍是确认肝硬化形成与否的指标, 本实验肝硬化造模可以分为3期: 变性坏死、纤维增生和假小叶形成期. 造模早期ALT急剧升高, 表明肝细胞中毒明显, 镜下以气泡样变性及坏死为主; 中晚期ALT有所下降, 但仍高于正常值; GGT却持续低值走势. 此期间肝细胞脂肪变性与坏死持续存在, 同时出现胶原纤维合成及肝小叶重建. 动物染毒后经历肝细胞坏死和纤维增生, 进而肝硬化, 肝功能持续受损, 合成蛋白的能力降低, 以ALB进行性减少最为明显, 导致A/G比例倒置. 实验组AKP虽有下降但不明显, 而AST早期明显升高, 可能是由于AST主要存在于线粒体内, 而乙醇和CCl4直接损害细胞质膜和线粒体膜上胆碱组分[13], 导致AST渗漏入血. 由表1还可见APTT时间延长, 这是肝硬化失代偿期的典型特征.
总之, 我们成功的建立了兔肝硬化模型, 具有动物死亡率低、肝硬化成功率高和造模时间短等优点, 为日后以兔为实验动物进行肝硬化的研究打下了基础.
肝炎、肝硬化和肝癌是严重威胁人类健康的常见疾病, 肝硬化动物模型的制作对人肝硬化的防治具有重要意义. 由于实验动物不感染人肝炎病毒, 肝硬化动物模型难以复制, 大型动物成功的报道少. 对实验造模过程中肝功能和组织病理学的改变进行动态观察并进行量化检测, 是开展后期治疗研究的重要前期工作.
肝硬化动物模型的制作方法大体可分为单因素造模和多因素造模两类, 后者可提高成功率, 目前问题是确定最佳造模方案, 使其与人肝硬化特征相同, 病变过程分期明显, 而且简便易行, 重点为提高造模成功率, 降低死亡率.
本文与其他方法的不同点在于: 采用兔为模型动物, 使用CCl4橄榄油皮下注射和乙醇灌胃结合进行复合因素造模, 降低了动物拒饮拒食造成的死亡率; 并且在首次小剂量注射后随着动物的耐受性增强而提高剂量, 后期再次降低剂量以进一步降低动物死亡率, 检测指标较为全面.
常见的肝硬化模型是小鼠或大鼠, 体型小, 不方便进行局部操作, 例如利用MRI进行干细胞示踪; 而兔的体型适中, 性格温顺, 便于操作. 本文提供了方便易行的造模方案, 各项生化指标和病理特征分期明显, 死亡率低, 是理想的肝硬化药物治疗和干细胞治疗的模型.
1 动物模型: 是指生物医学研究中建立的具有人类疾病模拟表现的动物研究对象, 可加强对人类疾病的发生过程、机制乃至防治的认识.
2 肝硬化: 是指一种或多种病因长期作用, 造成弥漫性肝脏损害, 肝细胞变性、坏死、再生、纤维组织增生及纤维板形成. 最终导致肝小叶结构被破坏及假小叶形成, 肝正常结构紊乱, 质地变硬. 可并发脾肿大、腹水、浮肿、黄疸、食道静脉曲张、出血、肝昏迷等.
3 细胞色素P450: 细胞色素P450由一个超基因家族编码, 目前有约1000个不同的细胞色素P450基因完成了序列测定, 分别属于74个基因家族; 居于肝内质网的细胞色素P450, 是最主要的药物氧化代谢酶.
该文通过联合应用四氯化碳和酒精成功诱导兔肝硬化模型的实验研究, 得出方便、快捷而且成功率高的兔肝硬化造模方法. 该实验针对基础研究中大型动物肝硬化模型成功率低的问题, 为进一步研究肝硬化的发病机制以及药物治疗打下基础.
电编: 张敏 编辑:潘伯荣
| 1. | Chatterjee S, Vrolix G, Depoortere I, Peeters T, Van Marck E. The therapeutic effect of the neuropeptide hormone somatostatin on Schistosoma mansoni caused liver fibrosis. BMC Infect Dis. 2005;5:45. [PubMed] [DOI] |
| 2. | Silva LM, Oliveira SA, Ribeiro-dos-Santos R, Andrade ZA, Soares MB. Comparison of immune responses of Schistosoma mansoni-infected mice with distinct chronic forms of the disease. Acta Trop. 2004;91:189-196. [PubMed] [DOI] |
| 3. | Sato R, Maesawa C, Fujisawa K, Wada K, Oikawa K, Takikawa Y, Suzuki K, Oikawa H, Ishikawa K, Masuda T. Prevention of critical telomere shorten-ing by oestradiol in human normal hepatic cultured cells and carbon tetrachloride induced rat liver fibrosis. Gut. 2004;53:1001-1009. [PubMed] [DOI] |
| 4. | Liu QH, Li DG, Huang X, Zong CH, Xu QF, Lu HM. Suppressive effects of 17beta-estradiol on hepatic fibrosis in CCl4-induced rat model. World J Gastroenterol. 2004;10:1315-1320. [PubMed] |
| 5. | Shi MX, Fang BJ, Liao LM, Yang SG, Liu YH, Zhao CH. Flk1+ mesenchymal stem cells ameliorate carbon tetrachloride-induced liver fibrosis in mice. Shengwu Gongcheng Xuebao. 2005;21:396-401. [PubMed] |
| 7. | Kang JS, Wanibuchi H, Morimura K, Puatanachok-chai R, Salim EI, Hagihara A, Seki S, Fukushima S. Enhancement by estradiol 3-benzoate in thioaceta-mide-induced liver cirrhosis of rats. Toxicol Sci. 2005;85:720-726. [PubMed] [DOI] |
| 8. | Bruck R, Schey R, Aeed H, Hochman A, Genina O, Pines M. A protective effect of pyrrolidine dithio-carbamate in a rat model of liver cirrhosis. Liver Int. 2004;24:169-176. [PubMed] [DOI] |
| 9. | Hata J, Ikeda E, Uno H, Asano S. Expression of hepatocyte growth factor mRNA in rat liver cirrhosis induced by N-nitrosodimethylamine as evidenced by in situ RT-PCR. J Histochem Cytochem. 2002;50:1461-1468. [PubMed] [DOI] |
| 10. | Sakaida I, Hironaka K, Terai S, Okita K. Gadolinium chloride reverses dimethylnitrosamine (DMN)-induced rat liver fibrosis with increased matrix metalloproteinases (MMPs) of Kupffer cells. Life Sci. 2003;72:943-959. [PubMed] [DOI] |
| 11. | Brond L, Hadrup N, Salling N, Torp M, Graebe M, Christensen S, Nielsen S, Jonassen TE. Uncoupling of vasopressin signaling in collecting ducts from rats with CBL-induced liver cirrhosis. Am J Physiol Renal Physiol. 2004;287:F806-F815. [PubMed] [DOI] |
| 12. | Jonassen TE, Brond L, Torp M, Graebe M, Nielsen S, Skott O, Marcussen N, Christensen S. Effects of renal denervation on tubular sodium handling in rats with CBL-induced liver cirrhosis. Am J Physiol Renal Physiol. 2003;284:F555-563. [PubMed] [DOI] |
| 13. | Li J, Niu JZ, Wang JF, Li Y, Tao XH. Pathological mechanisms of alcohol-induced hepatic portal hypertension in early stage fibrosis rat model. World J Gastroenterol. 2005;11:6483-6488. [PubMed] [DOI] |
| 14. | Xu GF, Li PT, Wang XY, Jia X, Tian DL, Jiang LD, Yang JX. Dynamic changes in the expression of matrix metalloproteinases and their inhibitors, TIMPs, during hepatic fibrosis induced by alcohol in rats. World J Gastroenterol. 2004;10:3621-3627. [PubMed] [DOI] |
| 15. | Masson S, Scotte M, Francois A, Coeffier M, Provot F, Hiron M, Teniere P, Fallu J, Salier JP, Daveau M. Changes in growth factor and cytokine mRNA levels after hepatectomy in rat with CCl(4)-induced cirrhosis. Am J Physiol. 1999;277:G838-846. [PubMed] |
| 16. | Yang Y, Nemoto EM, Harvey SA, Subbotin VM, Gandhi CR. Increased hepatic platelet activating factor (PAF) and PAF receptors in carbon tetrachlo-ride induced liver cirrhosis. Gut. 2004;53:877-883. [PubMed] [DOI] |
| 17. | Yang Y, Harvey SA, Gandhi CR. Kupffer cells are a major source of increased platelet activating factor in the CCl4-induced cirrhotic rat liver. J Hepatol. 2003;39:200-207. [PubMed] [DOI] |
| 18. | Kim SW, Schou UK, Peters CD, de Seigneux S, Kwon TH, Knepper MA, Jonassen TE, Frokiaer J, Nielsen S. Increased apical targeting of renal epithelial sodium channel subunits and decreased expression of type 2 11beta-hydroxysteroid dehydrogenase in rats with CCl4-induced decom-pensated liver cirrhosis. J Am Soc Nephrol. 2005;16:3196-3210. [PubMed] [DOI] |
| 19. | Bellentani S, Saccoccio G, Costa G, Tiribelli C, Man-enti F, Sodde M, Saveria Croce L, Sasso F, Pozzato G, Cristianini G. Drinking habits as cofac-tors of risk for alcohol induced liver damage. The Dionysos Study Group. Gut. 1997;41:845-50. [PubMed] [DOI] |
| 20. | Stickel F, Osterreicher CH. The role of genetic polymorphisms in alcoholic liver disease. Alcohol Alcohol. 2006;41:209-224. [PubMed] [DOI] |
| 21. | Nanji AA, Jokelainen K, Lau GK, Rahemtulla A, Tipoe GL, Polavarapu R, Lalani EN. Arginine reverses ethanol-induced inflammatory and fibrotic changes in liver despite continued ethanol admini-stration. J Pharmacol Exp Ther. 2001;299:832-839. [PubMed] |
| 22. | Feierman DE, Melinkov Z, Nanji AA. Induction of CYP3A by ethanol in multiple in vitro and in vivo models. Alcohol Clin Exp Res. 2003;27:981-988. [PubMed] [DOI] |