修回日期: 2006-03-19
接受日期: 2006-04-12
在线出版日期: 2006-05-18
目的: 探讨表达甲胎蛋白抗原的重组腺相关病毒rAAV-AFP转染对人外周血单核细胞来源树突状细胞(DC)免疫刺激功能的影响.
方法: 用rAAV-AFP转染新分离的DC; 苔盼蓝拒染法检测每天的活细胞比率; 流式细胞仪检测DC表面分子CD80, CD86, CD83, CD40, CD1a, HLA-DR及AFP的表达; 并用3H-TdR掺入法检测转染前后DC刺激自体淋巴细胞增殖能力; MTT法检测DC诱导T细胞的杀伤活性.
结果: 成熟DC 77.7%表达AFP蛋白; 转染对活细胞百分率和成熟DC表型无影响, 与未转染组无显著差异(P>0.05); 转染后DC仍保持较强的刺激自体淋巴细胞增殖的能力, 与未转染组也无显著性差异(P>0.05), 并且可诱导出特异性杀伤, 效应细胞和靶细胞为80∶1, 40∶1, 20∶1时, 与未转染组相比均有显著差异(35.5±5.5 vs 20.6±4.7; 28.7±3.6 vs 15.3±2.5; 16.2±2.8 vs 9.6±1.8; 均P<0.01).
结论: rAAV可负载AFP基因在DC中表达, rAAV-AFP转染DC对其功能无明显影响, 免疫功能更强.
引文著录: 梁政, 罗荣城, 尤长宣, 郑航. rAAV-AFP转染人外周血单核细胞来源树突状细胞增强免疫刺激功能. 世界华人消化杂志 2006; 14(14): 1362-1366
Revised: March 19, 2006
Accepted: April 12, 2006
Published online: May 18, 2006
AIM: To study the immunostimulatory effect of rAAV-AFP (recombinant adeno-associated virus expressing α-fetoprotein antigen) transfection on dendritic cells (DCs) derived from human peripheral blood monocytes.
METHODS: Newly isolated dendritic cells were infected with rAAV-AFP. The percentage of viable DCs was observed by trypan blue exclusion every 24 h. After transfection, the alterations of surface markers on mature DCs, including CD80, CD86, CD83, CD40, CD1a, HLA-DR and α-fetoprotein (AFP), were detected by flow cytometry. Meanwhile, 3H-thymidine incorporation method was used to measure the capacity of T-cell proliferation before and after transfection. The specific killing activity of T cells was evaluated by MTT assay.
RESULTS: About 77.7% mature DCs expressed AFP protein. The viable DCs percentages and surface marker expression showed no significant changes after transfection (P > 0.05). Transfected DCs still had strong potential of stimulating the proliferation of T lymphatic cells, and there was no significant difference between transfected and non-transfected group (P > 0.05). Transfected DCs were capable of inducing specific killing effect on the target cells, and the activity was significantly higher than those in the non-transfected cells when the DCs and T cells were mixed at the ratios of 80:1, 40:1, and 20:1 (35.5 ± 5.5 vs 20.6 ± 4.7; 28.7 ± 3.6 vs 15.3 ± 2.5; 16.2 ± 2.8 vs 9.6 ± 1.8; all P < 0.01).
CONCLUSION: AFP gene, which is carried by recombinant adeno-associated virus, can be transferred into DCs with high efficiency. The function of mature DCs is not affected significantly by AFP transfection.
- Citation: Liang Z, Luo RC, You CX, Zheng H. Infection of rAAV-AFP enhances immunostimulatory effect of human peripheral blood monocyte-derived dendritic cells. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1362-1366
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1362.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1362
肝细胞癌(HCC)作为一种常见的恶性肿瘤每年夺走超过100万人的生命. 近年来随着分子生物学及免疫学理论技术迅猛发展, 生物治疗模式以其低风险及应用的普遍性越发受到重视, 树突状细胞(DC)因处于免疫应答核心地位而成为热点. 甲胎蛋白(AFP)是由胚胎卵黄囊和胎肝合成, 出生后血中AFP水平迅速下降, 至成年时几乎难以检测, 在2/3的HCC患者的血清中有升高. 已有文献报道, AFP在体内能抑制宿主免疫系统[1], 通过对肿瘤坏死因子(TNF)家族及其受体系统的调节, 在逃避免疫监视中也发挥作用[2], 间接促进肿瘤的生长; 此外, 体外实验还证实, AFP 直接促进部分肿瘤细胞的生长[3-4]. 重组腺相关病毒(rAAV)近来被认为是最有前景的DC治疗抗原载体. 我们采用rAAV-AFP转染DC, 为优化基因转染DC治疗HCC提供依据.
AIM-V培养液、RPMI 1640培养液和T细胞尼龙毛柱购自Invitrogen公司; 重组人白介素-2(rhIL-2)购自北京瑞得合通公司; 重组人粒细胞巨嗜细胞集落刺激因子(rhGM-CSF)购自罗氏公司; 重组人白介素-4(rhIL-4)购自Promega公司; 肿瘤坏死因子-α(TNF-α)购自解放军军事医学科学院; 人AB血清购自广州血站; PE/FITC标记的鼠抗人CD80, CD86, CD83, CD40, CD1a, HLA-DR, IgG1购自深圳晶美公司; FITC标记的鼠抗人AFP由美国Liu Yong教授惠赠; 3H-TdR购自中国科学院上海原子核研究所; Ficoll (1077 g/L)淋巴细胞分离液购自天津市灏洋公司; 丝裂霉素C购自日本Kyowa Hakko公司; Bel-7402细胞株由本中心保存; 流式细胞仪源于美国Becton Dickinson FACSCalibur; 液闪计数仪为美国Backman公司产品; 病毒rAAV-AFP由美国阿肯色大学医学院基因治疗中心提供, 病毒滴度(拷贝数)为1×1013个病毒颗粒/L. DC的诱导采取已建立的方法[5]并做部分改进, 简述如下: 取健康志愿者外周血常规分离获得单个核细胞以AIM-V无血清培养液悬浮后, 加入6孔板(每孔2.5 mL), 在37℃, 50 mL/L CO2培养箱中温浴4 h, 分别获得贴壁与非贴壁细胞, 贴壁细胞每孔加入rhGM-CSF, 终浓度为8×105 U/L, AIM-V无血清培养液2.5 mL, 随后加入终浓度为1×1011个病毒颗粒/L的rAAV-AFP为rAAV-AFP-DC组, 并另设一组不加rAAV-AFP组为N-rAAV-AFP-DC组, 12 h后洗去载体病毒, 加入同上的完全培养液, 培养3 d半量换液, 加入IL-4, 终浓度1×106 U/L, 第5天全量换液, 第6天加入TNF-α, 终浓度20 μg/L, 7 d DC细胞成熟.
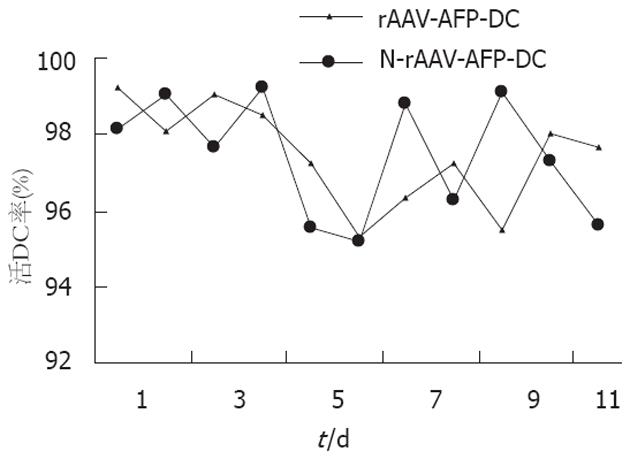
1.2.1 rAAV-AFP对DC生长的作用: 收集培养过程中的DC, 以倒置显微镜观察, 每天均以苔盼蓝拒染法计数总的细胞数与活细胞数, 计算出活DC比率.
1.2.2 流式细胞仪分析成熟DC的表型: 收集培养7 d的DC, 计数, 细胞悬液浓度应≥105, 分别取细胞悬液500 μL加入各测定管中, 用PE或FITC标记的抗体4℃孵育40 min, PBS洗2次, 送流式细胞仪上检测rAAV-AFP感染DC前体的效率及CD80, CD86, CD83, CD40, CD1a, HLA-DR的表达.
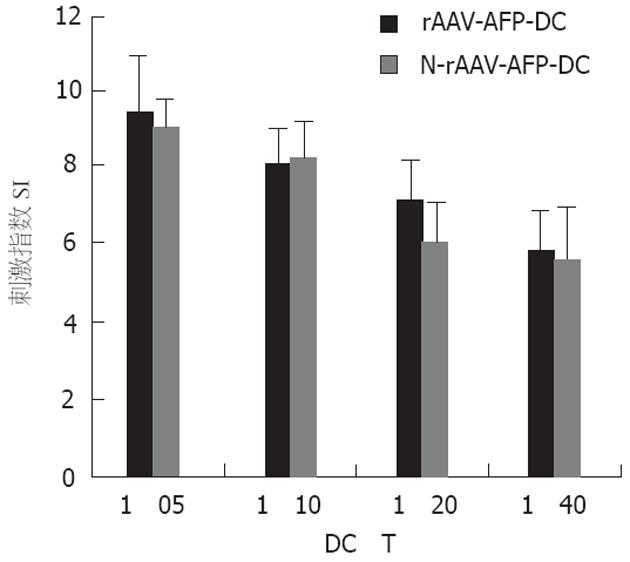
1.2.3 混合淋巴细胞反应(MLR): 取上述外周血分离非贴壁细胞置培养瓶中, 用含终浓度2×105 U/L的rhIL-2, 100 mL/L人AB血清的RPMI 1640培养液于37℃, 50 mL/L CO2培养箱中培养. 待DC成熟后, 将非贴壁细胞加在37℃预温的尼龙毛上, 37℃, 50 mL/L CO2孵育30 min后, 3/4预温的RPMI 1640轻轻洗出细胞, 所获细胞作为T细胞备用. 分别取培养7 d的rAAV-AFP-DC组以及培养同样长时间N-rAAV-AFP-DC组用25 mg/L的丝裂霉素C在37℃孵育45 min, PBS液洗3次, 用AIM-V培养基悬浮. 分别以2×104/孔、1×104/孔、5×103/孔和2.5×103/孔, 将DC加入96孔板中, 每组各3个复孔, 每孔再加入自体T细胞1×105细胞/孔, 终体积为200 μL. 37℃, 50 mL/L CO2培养96 h. 终止培养前18 h加入3H-TdR, 终浓度为37 MBq/L, 同时设淋巴细胞对照组及本底组. 收集细胞, 液闪计数仪检测dpm值, 并计算刺激指数SI, SI = (实验组dpm值-本底组dpm值)/(对照组dpm值-本底组dpm值), 结果用3孔均值表示.
1.2.4 CTL杀伤效应的测定: AFP高表达的Bel-7402细胞株为靶细胞, 将自体T淋巴细胞分两组, 按20∶1分别加入25 mg/L的丝裂霉素C处理后的两组DC混合培养4 d作为效应细胞, 然后将靶细胞分别接种在96孔培养板(均为1×104个/孔), 效应细胞和靶细胞按80∶1, 40∶1, 20∶1, 10∶1分别与两组效应细胞混合, 每个比例5复孔. 37℃, 50 mL/L CO2培养箱中温浴12 h后加入终浓度为0.5 mg/L MTT, 继续孵育6 h, 每孔加盐酸化异丙醇100 μL, 静置5 min后酶标仪测570 nm波长的A值. 杀伤率% = [1-实验孔A值/(T细胞A值+靶细胞A值)]×100%, 取平均值.
统计学处理 采用SPSS 10.0统计软件包进行处理, 数据以mean±SD表示, 用χ2检验、t检验判断差别的显著性.
倒置显微镜下, rAAV-AFP-DC组仍保持典型DC生长过程的变化, 培养初可见多数圆形贴壁细胞, 培养3 d后观察到细胞表面伸出毛刺样突起, 细胞数目明显增多, 体积增大, 呈集落样生长, 培养7 d后, 集落分散, 细胞悬浮生长, 分布较均匀, 可见典型的树枝状突起, 并与N-rAAV-AFP-DC组的活细胞比率之间无显著性差异(P>0.05, 图1).
流式细胞仪分析rAAV-AFP感染DC前体细胞后, AFP阳性细胞率为77.7%, 此结果也说明AFP在DC前体细胞内表达良好.
FACS分别检测两组DC表面分子的表达, 可见转染rAAV-AFP后对成熟DC表型无影响(P>0.05, 表1).
| DC | CD83 | CD86 | CD80 | CD40 | CD1a | HLA-DR |
| rAAV-AFP-DC | 6.90±2.90 | 87.72±6.00 | 6.97±2.65 | 37.21±9.60 | 41.22±6.50 | 89.02±8.04 |
| N-rAAV-AFP-DC | 7.65±3.21 | 90.75±3.51 | 7.29±2.03 | 40.12±6.86 | 43.06±10.97 | 88.88±6.29 |
rAAV-AFP-DC组与N-rAAV-AFP-DC组之间SI值无显著性差异(P>0.05, 图2), 仍保持较强的刺激自体T细胞增殖的能力.
树突状细胞(DC)由于处于免疫应答核心地位, 近年来受到广泛关注. 目前对肝细胞癌(HCC)肿瘤特异性抗原还不了解, 所以在如何提高DC递呈肝癌相关性抗原的效率成为亟待解决的问题. 人们对AFP与HCC之间关系作了基础和临床研究后, 认为AFP是肝癌细胞特异性表达的, 或由正在发生突变的肝细胞表达的[6]. 由于AFP在抗肿瘤过程中的负面作用, 致使以AFP结构本身作为肝癌生物治疗靶点的设想, 一直未能付诸实施, Vollmer et al[7]发现个体发育中T细胞库内对人类AFP的特异性CTL克隆并未清除, 适当条件或方法可使之激活, 所以AFP可成为HCC特异性免疫治疗的靶抗原. 利用自体肝癌细胞抗原致敏DC, 由AFP筛选出的抗原肽以及以痘苗病毒为载体负载AFP的肿瘤疫苗, 均可强有力的诱发T细胞免疫反应[8-10]. 基因转染DC的方法因其明确的靶向性, 稳定的产量估计会成为DC疫苗发展的方向. AFP-cDNA真核表达载体转染人类和小鼠DC的研究已取得了明确的进展[11-12]. 基因转移载体的选择上, 除了要求抗原基因能成功转移外, 还要能长期稳定表达. 相比较而言, 利用病毒载体介导编码基抗原修饰DC细胞因具有能持续表达、提供更广谱MHC限制性表位的优势而更受到青睐. 重组腺相关病毒(rAAV)载体是介导基因转移和基因治疗常用的载体系统之一, 他以其位点特异性的整合能力、自然缺陷以及无致病原性, 被认为是最有前景的DC治疗抗原载体. 此外, 在与腺病毒载体比较中, 他表现出了既无自身免疫原性[13], 转染效率又不低于前者的优势[14].
Liu et al[15]以rAAV携带乳腺癌肿瘤抗原BA46, 在DC表面获得良好表达, 明确证实已整合到DC染色体上, 并诱导出强大而特异的CTL效应, 结果令人鼓舞. 我们将靶向性比较明确的AFP抗原基因转染体外诱导扩增的DC, 并使DC将抗原递呈给初始T细胞, 旨在了解负载AFP的rAAV转染DC后是否仍能保持原有的形态、表型和刺激自体T细胞增殖的能力. 实验结果显示, 77.7%的DC能表达AFP蛋白, 说明rAAV能够高效介导AFP抗原基因在DC中的表达. 转染后成熟的DC表面特征性分子表达率保持较高水平, 仍保持较强的刺激淋巴细胞增殖的能力, 并且成熟DC转染前后形态无改变, 也无明显免疫抑制及自身细胞毒作用. AFP抗原基因转染的DC诱导的CTL效应显著高于对照组. 以上均提示以AFP为靶抗原, DC通过rAAV载体转染治疗AFP相关性肿瘤的可行性.
DC细胞是一类极强的MHC携带细胞, 是体内最强的抗原呈递细胞, 在抗肿瘤免疫方面发挥重要作用, 重组腺相关病毒近来被认为是最有前景的DC治疗抗原载体.
基因疫苗因其明确的靶向性, 稳定的产量估计会成为DC疫苗发展的方向, 利用病毒载体介导基因转移, 以其高效和良好的靶向性已成为基因治疗中应用最广泛的方法.
目前以AFP作为肝癌基因治疗和免疫治疗靶点的DC疫苗中, 国内尚无使用腺相关病毒载体的报道.
本文为rAAV-AFP转染DC的进一步研究提供了可行性依据, 也为最终用于临床提供重要参考.
重组腺相关病毒(rAAV): 一种活病毒载体, 具有稳定表达、定点整合、安全性较高, 且不表达任何病毒自身蛋白基因等优势, 是介导基因转移和基因治疗常用的载体系统之一, 他因其位点特异性的整合能力、自然缺陷以及无致病原性, 被认为是最有前景的DC治疗抗原载体.
电编: 张敏 编辑:潘伯荣
| 1. | Semeniuk DJ, Boismenu R, Tam J, Weissenhofer W, Murgita RA. Evidence that immunosuppression is an intrinsic property of the alpha-fetoprotein molecule. Adv Exp Med Biol. 1995;383:255-269. [PubMed] [DOI] |
| 2. | Ozoren N, El-Deiry WS. Cell surface Death Receptor signaling in normal and cancer cells. Semin Cancer Biol. 2003;13:135-147. [PubMed] [DOI] |
| 3. | Dudich E, Semenkova L, Gorbatova E, Dudich I, Khromykh L, Tatulov E, Grechko G, Sukhikh G. Growth-regulative activity of human alpha-fetoprotein for different types of tumor and normal cells. Tumour Biol. 1998;19:30-40. [PubMed] [DOI] |
| 5. | Liu Y, Chiriva-Internati M, Grizzi F, Salati E, Roman JJ, Lim S, Hermonat PL. Rapid induction of cytotoxic T-cell response against cervical cancer cells by human papillomavirus type 16 E6 antigen gene delivery into human dendritic cells by an adeno-associated virus vector. Cancer Gene Ther. 2001;8:948-957. [PubMed] [DOI] |
| 6. | 贺 平, 刘 彬彬, 叶 胜龙, 汤 钊猷. 人肝癌、癌旁组织中AFPmRNA的差异性分析. 中国肿瘤生物治疗杂志. 1998;5:163-166. |
| 7. | Vollmer CM Jr, Eilber FC, Butterfield LH, Ribas A, Dissette VB, Koh A, Montejo LD, Lee MC, Andrews KJ, McBride WH, Glaspy JA, Economou JS. Alpha-fetoprotein-specific genetic immunotherapy for hepatocellular carcinoma. Cancer Res. 1999;59:3064-3067. [PubMed] |
| 9. | Butterfield LH, Meng WS, Koh A, Vollmer CM, Ribas A, Dissette VB, Faull K, Glaspy JA, McBride WH, Economou JS. T cell responses to HLA-A*0201-restricted peptides derived from human alpha fetoprotein. J Immunol. 2001;166:5300-5308. [PubMed] [DOI] |
| 10. | Grimm CF, Ortmann D, Mohr L, Michalak S, Krohne TU, Meckel S, Eisele S, Encke J, Blum HE, Geissler M. Mouse alpha-fetoprotein-specific DNA-based immunotherapy of hepatocellular carcinoma leads to tumor regression in mice. Gastroenterology. 2000;119:1104-1112. [PubMed] [DOI] |
| 12. | Zeng B, Lu FG, Liu XW, Yang DY, Fang WY, Wang J, Liao AJ, Shi W. Construction of eukaryotic expression vector of mouse alpha-fetoprotein cDNA and its expression in dendritic cells and in vitro antitumor effect on hepatoma. Aizheng. 2005;24:1332-1337. [PubMed] |
| 13. | Zaiss AK, Liu Q, Bowen GP, Wong NC, Bartlett JS, Muruve DA. Differential activation of innate immune responses by adenovirus and adeno-associated virus vectors. J Virol. 2002;76:4580-4590. [PubMed] [DOI] |
| 14. | Enger PO, Thorsen F, Lonning PE, Bjerkvig R, Hoover F. Adeno-associated viral vectors penetrate human solid tumor tissue in vivo more effectively than adenoviral vectors. Hum Gene Ther. 2002;13:1115-1125. [PubMed] [DOI] |
| 15. | Liu Y, Chiriva-Internati M, You C, Luo R, You H, Prasad CK, Grizzi F, Cobos E, Klimberg VS, Kay H. Use and specificity of breast cancer antigen/milk protein BA46 for generating anti-self-cytotoxic T lymphocytes by recombinant adeno-associated virus-based gene loading of dendritic cells. Cancer Gene Ther. 2005;12:304-312. [PubMed] [DOI] |