修回日期: 2006-03-19
接受日期: 2006-03-29
在线出版日期: 2006-05-18
目的: 观察丹参酮ⅡA对肝癌SMMC-7721细胞生长和凋亡的影响及其作用机制.
方法: 体外培养肝癌SMMC-7721细胞株, 经丹参酮ⅡA(终浓度0.5 mg/L)作用后, 采用四唑盐(MTT)比色法检测细胞增殖, 透射电镜观察细胞凋亡, 流式细胞仪检测细胞凋亡, 免疫细胞化学SABC法检测COX-2蛋白表达, 放射免疫法检测前列腺素E2(PGE2)含量.
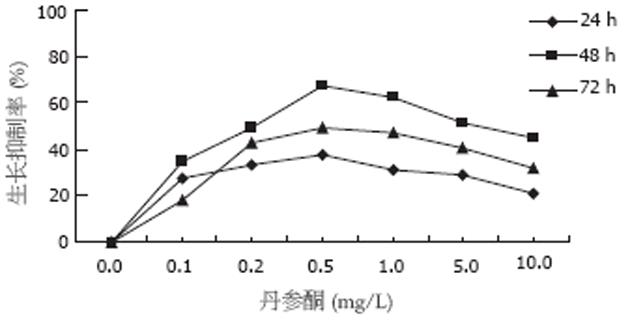
结果: 丹参酮ⅡA对肝癌细胞的生长有明显的抑制作用, 并呈剂量依赖性. 以0.5 mg/L作用终浓度抑制作用最明显, 其48 h的抑制率为 69.3%, 与对照组相比差异有显著性(P<0.01). 电镜下观察, 丹参酮ⅡA作用后肝癌细胞表现为细胞皱缩、核染色质浓缩、核碎裂以及凋亡小体形成等凋亡特征性的形态改变. 5 mg/L丹参酮ⅡA作用后, 随时间的延长, 凋亡率逐渐升高, 48 h达到高峰, 随后逐渐下降(24, 48, 72 h凋亡率分别为7.45%±0.33%、6.59%±0.45%、4.78%±1.05%), 与对照组比较, 各处理组都有显著性差异(均P<0.01), 丹参酮作用组肝癌细胞COX-2表达明显减少, 其培养液中PGE2的产生量下降, 与对照组相比差异均有显著性(P<0.01).
结论: 丹参酮ⅡA可能是通过下调COX-2 mRNA的表达水平发挥其对肝癌细胞生长抑制及促进凋亡作用.
引文著录: 徐俊丽, 和水祥, 陈静宏, 符寒, 赵刚, 王艳丽, 任牡丹. 丹参酮ⅡA对肝癌SMMC-7721细胞COX-2表达的影响. 世界华人消化杂志 2006; 14(14): 1352-1356
Revised: March 19, 2006
Accepted: March 29, 2006
Published online: May 18, 2006
AIM: To observe the effect of Tanshinone II A on the proliferation and apoptosis of human hepatocellular carcinoma cell line SMMC-7721 and its machanism.
METHODS: The human hepatocellular carcinoma cell line SMMC-7721 cultured in vitro was treated with different concentrations (final 0.5 mg/L) Tanshinone II A. The proliferation of the cells was measured by MTT assay, and the apoptosis of the cells was investigated by flow cytometry and transmission electron microscopy (TEM). The expression of Cyclooxygenase-2 (COX-2) was detected by immunocytochemistry. The levels of prostaglandin E2 (PGE2) in medium were measured by radioimmunoassay.
RESULTS: Tanshinone II A inhibited the growth of SMMC-7721 cells in a dose-dependent manner. The inhibitory rate reached the peak (69.3%) after 0.5 mg/L Tanshinone II A was used for 48 h, which was significantly higher than that in the controls (P < 0.01). Typical features of apoptosis as cell shrinkage, nuclear chromatin condensation, fragmentation, and the formation of apoptotic bodies was found by TEM in the cells treated with Tanshinone II A. FCM analysis showed the apoptotic rates for 24, 48 and 72 h were 7.45% ± 0.33%, 6.59% ± 0.45%, and 4.78% ± 1.05%, respectively, when 5 mg/L Tanshinone II A was used, which were markedly higher than those in the controls (all P < 0.01). Both the expression of COX-2 (P < 0.01) and the production of PGE2 (40.18 ± 1.37 μg/L vs 75.31 ± 1.64 μg/L, P < 0.01) were decreased significantly after Tanshinone II A treatment as compared with those in the controls.
CONCLUSION: Tanshinone II A inhibits the proliferation and increases the apoptosis of human hepatocellular carcinoma cell line SMMC-7721 by down-regulation of COX-2 protein expression.
- Citation: Xu JL, He SX, Chen JH, Fu H, Zhao G, Wang YL, Ren MD. Effect of tanshinone II A on COX-2 expression in hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1352-1356
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1352.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1352
丹参是常用的活血化淤中药之一, 神农本草经记载丹参可破症除瘕. 近年研究表明, 丹参的有效成分丹参酮Ⅱ A可通过杀伤肿瘤细胞, 诱导分化和凋亡等途径发挥其抑癌作用[1], 但具体作用机制仍不清楚. 我们观察了丹参酮Ⅱ A对肝癌SMMC-7721细胞凋亡及其对COX-2表达的影响,进一步探讨其抗肿瘤机制.
丹参酮Ⅱ A系由中国药物制品检定所提供的化学标准品, 溶解于二甲亚砜(DMSO, 终浓度为0.2 g/L)中4℃冷藏备用. RPMI 1640培养液, 小牛血清购自Gibco公司, 四甲基偶氮唑蓝(MTT)购自Sigma公司; 尼美舒利(Nimesulide) 购自美国Sigma公司, DMSO溶解, 4℃冷藏备用; COX-2鼠抗人mAb(工作浓度为1∶80)及免疫细胞化学SABC试剂盒(即用型)均购自北京中山生物技术中心; PGE2放射免疫试剂盒购于武汉博士德试剂公司; 酶标仪为Sigma公司产品; FACSCalibur购自美国BD公司. 人肝癌细胞株(SMMC-7721)由西安交通大学医学院第一附属医院临床分子实验中心陈威主任惠赠, 用含150 mL/L小牛血清, 50 U/L青霉素和50 mg/L链霉素的RPMI 1640培养液, 37℃恒温, 50 mL/L CO2密闭传代培养.
将丹参酮Ⅱ A配制成0, 0.1, 0.2, 0.5, 1, 5, 10 mg/L不同浓度, 以0 mg/L为阴性对照组, 并设终浓度为300 μmol/L尼美舒利为阳性对照组[2], 其余为处理组, 实验根据MTT结果选取最佳作用浓度的丹参酮Ⅱ A处理肝癌细胞.
1.2.1 MTT比色法检测SMMC-7721的增殖: 传一代培养的SMMC-7721以150 mL/L小牛血清的RPMI 1640制备细胞悬液2×108/L, 接种于96孔板, 每孔200 μL, 生长24 h后, 随机分8组, 每组6复孔, 1-7组加入丹参酮Ⅱ A终浓度分别为0(空白对照组), 0.1, 0.2, 0.5, 1, 5, 10 mg/L的培养液, 第8组加入300 μmol/L尼美舒利作为对照组, 分别作用24, 48, 72 h后每孔加新配置的5 g/L MTT贮存液20 μL继续孵育4 h后, 弃上清并每孔加150 μL二甲基亚砜溶解细胞内结晶, 酶标490 nm波长测定吸光度(A)值. 抑制率 = (对照孔A490-实验孔A490)/对照孔A490×100%.
1.2.2 透射电镜观察: 收集处于对数生长期的细胞, 接种于T-25培养瓶内, 随机分3组加药(根据细胞毒性试验, 选用丹参酮Ⅱ A 0.5 mg/L作为处理组, 0 mg/L为阴性对照组, 300 μmol/L尼美舒利为阳性对照组), 每组各6瓶细胞. 药物处理细胞48 h后, 胰蛋白酶消化细胞, 置于EP管中, 2000 r/min离心10 min, 弃上清, 加入4℃预冷的20 g/L戊二醛固定2 h, PBS液清洗, 再用10 g/L 锇酸固定30 min PBS液洗, 梯度乙醇脱水, 环氧树脂包埋, 超薄切片机切片, 醋酸铀和枸橼酸铅双色, 透射电子显微镜下观察并摄影.
1.2.3 流式细胞术检测细胞凋亡: 收集经浓度为5 mg/L丹参酮Ⅱ A处理0, 24, 48, 72 h后的细胞, 用2.5 g/L的胰酶消化后制成单细胞悬液, 1500-2000 r/min离心10 min, 弃上清, 沿管壁缓慢加入700 mL/L预冷(-20℃)乙醇固定, 4℃保存12 h. 上机检测前RNA酶消化, 再加入PI染色液, 4℃避光30 min. 采用FACScort流式细胞仪对样品进行检测, 每次计细胞数20 000个, 激发波长488 nm, 分析软件CellQuest计算凋亡率.
1.2.4 免疫细胞化学染色: 以胰蛋白酶消化对数生长期SMMC-7721细胞, 制成单细胞悬液, 接种在预先放置盖玻片的24孔板上, 随机分3组加药(0, 0.5 mg/L浓度的丹参酮Ⅱ A组, 300 μmol/L尼美舒利组), 每组各5瓶细胞. 置37℃培养箱中, 48 h后取出, 用PBS清洗, 40 g/L多聚甲醛固定10 min后取出自然干燥, -20℃冰箱保存. 采用SABC法免疫细胞化学染色, 光学显微镜观察. 结果判断: 全面观察每张切片COX-2定位于细胞质和细胞膜, 阳性细胞染色呈棕褐色或棕黄色为阳性, 随机选择10个具有代表意义的高倍视野, 每个视野计数100个细胞中的阳性细胞数, 取平均数作为结果. 其中无阳性细胞为(-), 阳性细胞数<25%为(+), 25%-55%为(++), >55%为(+++); 染色阴性计0分; µ黄色计1分; 棕黄色计2分; 棕褐色计3分. 两种积分相加, 积分为0-1分, 表示阴性(-); 积分为2-3分, 表示阳性(+); 积分为4-5分, 表示阳性(++); 积分为6-7分, 表示阳性(+++). +视为低表达, ++, +++视为高表达[3], 计算阳性细胞百分比.
1.2.5 PGE2的含量测定: 采用丹参酮对SMMC-7721细胞分泌前列腺素E2的能力的影响来反映他对COX-2活性的影响. 取对数生长期细胞, 随机分3组加药(0, 0.5 mg/L浓度的丹参酮 Ⅱ A组, 300 μmol/L尼美舒利组), 每组各6瓶细胞. 培养48 h后收集上清, 存于-20℃备用. 取上述细胞培养上清按PGE2放射免疫试剂盒说明测定PGE2.
统计学处理 所有实验数据均采用mean±SD表示, 用SPSS 11.0软件进行t检验.
不同浓度丹参酮Ⅱ A作用细胞后, 细胞生长受到不同程度的抑制, 这一抑制作用随丹参酮ⅡA浓度的变化而变化; 组间两两均有非常显著性差异(P<0.01), 并且浓度与抑制率间呈现明显的依赖效应(图1).
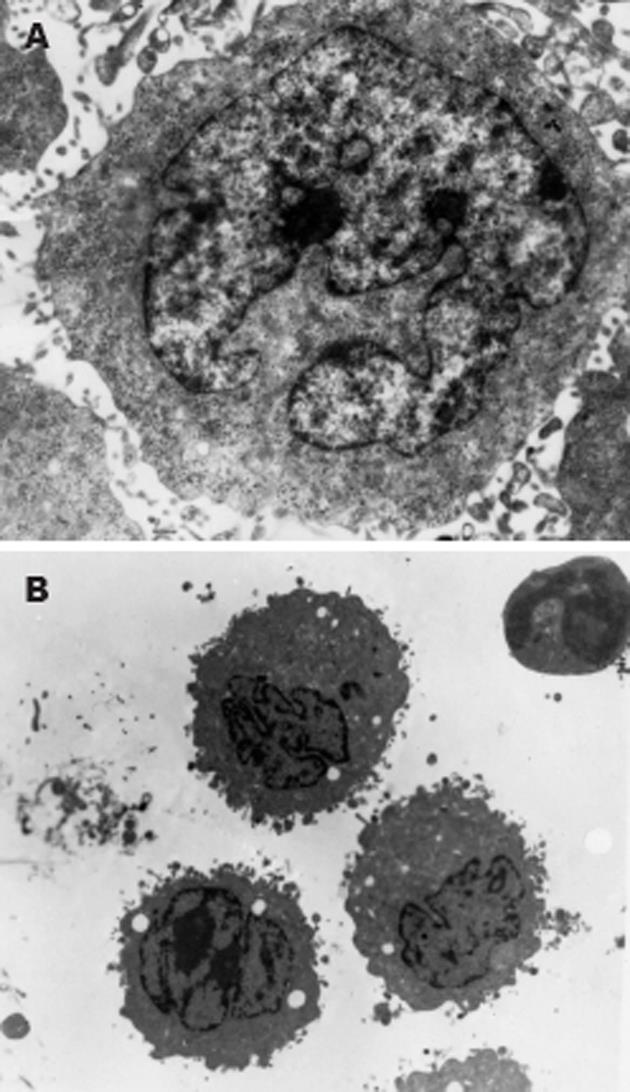
未加药的肝癌细胞, 细胞核较大, 有凹陷, 畸形核或分叶核, 染色质均匀, 细胞表面有毛细状突起(图2A). 给予0.5 mg/L丹参酮Ⅱ A后, 细胞体积缩小, 表面出现粗大的突起, 细胞器肿胀, 核固缩, 染色质边集于核膜下, 形成新月形小体, 核膜消失或突起呈小泡样, 核质浓缩, 发生碎裂, 形成凋亡小体, 呈早中期的凋亡表现的细胞数明显增多(图2B). 300 μmol/L尼美舒利组除可见凋亡细胞外, 还可以见到部分细胞胀大, 细胞器肿胀、破坏, 辨认不清, 细胞核破碎等细胞死亡征象.
FCM定量显示, 5 mg/L丹参酮Ⅱ A 作用后, 随时间的延长, 凋亡细胞增多, 48 h的凋亡率达到最高值, 随后逐渐下降, 与对照组比较, 各处理组都有显著性差异(P<0.01, 表1).
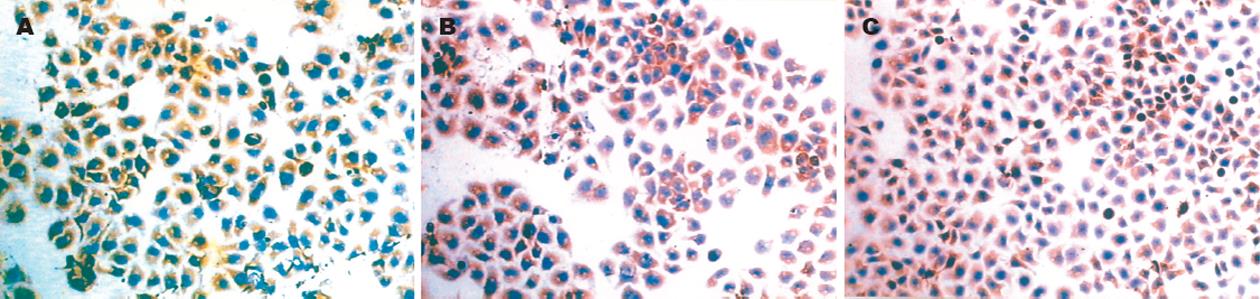
COX-2主要定位于肝癌细胞的胞质, 棕黄色颗粒分布于整个胞质或沿核膜周边呈线状分布间质细胞染色差异较大, 不计入阳性计数. 在0.5 mg/L丹参酮Ⅱ A组高表达率为73.3%, +++比例较大(图3B). 未加药组(图3A)和尼美舒利组(图3C)高表达率分别为80.0%和66.7%, 差异有显著意义(P<0.01, 表2).
处理组的PGE2释放水平, 其值为40.18±1.37 μg/L, 与阴性对照组(75.31±1.64 μg/L)及阳性对照组(51.67±4.37 μg/L)相比, 差异有显著性(P<0.001). 说明丹参酮Ⅱ A处理后的肝癌细胞COX-2的活性下降, 导致其催化产物PGE2释放水平下降.
现代医学研究表明, 肿瘤的发生不仅与肿瘤细胞增殖加快有关, 而且与肿瘤细胞死亡受抑制密切相关. 1972年Kerr et al[4]首先提出细胞凋亡的概念以来, 随着对凋亡分子机制的逐步认识, 人们发现细胞凋亡抑制是肿瘤形成的一个共同的重要事件, 诱导肿瘤细胞凋亡是一条有效的肿瘤治疗途径. 比杀伤肿瘤细胞的治疗有明显的优越性, 故寻求高效低毒的肿瘤细胞凋亡诱导剂已成为目前肿瘤治疗的研究热点. 丹参酮Ⅱ A是从活血化淤中药丹参中提取的有效成分, 有研究表明, 丹参酮Ⅱ A具有较强的抗癌活性[5]. 袁淑兰 et al[6]研究报道, 丹参酮杀伤肿瘤细胞, 诱导其分化和凋亡等途径发挥其抑癌作用. 本结果显示, 用不同浓度丹参酮Ⅱ A作用于人肝癌细胞后, 对其生长增殖具有较强抑制作用, 且与浓度呈明显的依赖效应. 用0.5 mg/L丹参酮Ⅱ A处理人肝癌细胞48 h后透射电镜观察, 可见细胞体积缩小、核固缩、染色质边聚及凋亡小体形成等凋亡早中期形态学变化, 进一步证实丹参酮Ⅱ A可诱导人肝癌细胞凋亡.
研究表明, 肝癌的发生、发展与多种凋亡相关基因有关. COX-2是花生四烯酸代谢过程中的限速酶, 不但在结直肠癌有较高水平的表达, 而且在人类的其他许多肿瘤组织中也有表达, 如胃癌、肺癌、食管癌、乳腺癌、胰腺癌、胆囊癌等[7-10]. 目前研究证实, COX-2在肿瘤的发生、发展过程中起了十分重要的作用[11], 他的激活是肿瘤发生的早期事件, 且与肿瘤的分级有关, 有促进肿瘤侵袭和转移的潜能[12], 而抑制或阻断COX-2的表达, 有助于抑制肿瘤生长, 减弱其侵袭力, 从而降低消化道肿瘤的发病率[13]. 张必翔 et al[14]研究发现, 选择性COX-2抑制剂尼美舒利能够诱导肝癌细胞HepG2细胞凋亡, 说明凋亡基因COX-2表达状态与肝癌的形成与转归关系密切, 可作为评价抗癌药物疗效及其作用机制的理想指标. 我们发现0.5 mg/L丹参酮Ⅱ A处理肝癌细胞后COX-2表达明显下调, 其催化产物前列腺素E2的释放水平亦明显下降, 与对照组比较差异均有显著性(P<0.01), 说明丹参酮Ⅱ A可以抑制肝癌细胞COX-2的表达并降低其活性. 同时电镜下及流式细胞术可以观察典型的细胞凋亡征象. 以上结果提示, 丹参酮Ⅱ A可能是通过下调COX-2 mRNA的表达, 发挥其对肝癌细胞生长抑制及促进凋亡作用的. 但是300 μmol/L尼美舒利作用组, COX-2表达率较丹参酮组下降, 且前列腺素E2释放水平亦低于作用组, 考虑为尼美舒利直接选择性阻断或抑制了COX-2的活性, 而丹参酮可能是间接作用于COX-2, 下调其表达水平, 影响前列腺素E2释放, 发挥肿瘤抑制和凋亡作用[15]. 因此丹参酮Ⅱ A作为一种植物成分的新型抗癌类药物, 其具体的作用机制值得进一步探讨.
研究表明, 肿瘤的发生不仅与肿瘤细胞增殖加快有关, 而且与肿瘤细胞死亡受抑制密切相关. 诱导肿瘤细胞凋亡是一条有效的肿瘤治疗途径, 比杀伤肿瘤细胞的治疗有明显的优越性, 寻求高效低毒的肿瘤细胞凋亡诱导剂已成为目前肿瘤治疗的研究热点.
目前研究证实COX-2在肿瘤的发生、发展过程中起了十分重要的作用, 他的激活是肿瘤发生的早期事件, 且与肿瘤的分级有关, 有促进肿瘤侵袭和转移的潜能, 而抑制或阻断COX-2的表达, 有助于抑制肿瘤生长, 减弱其侵袭力, 从而降低消化道肿瘤的发病率. 凋亡基因COX-2表达状态与肝癌的形成与转归关系密切, 可作为评价抗癌药物疗效及其作用机制的理想指标.
袁淑兰 et al研究报道丹参酮杀伤肿瘤细胞、诱导其分化和凋亡等途径发挥其抑癌作用. 张必翔 et al研究发现选择性COX-2抑制剂尼美舒利能够诱导肝癌细胞HepG2细胞凋亡, 说明凋亡基因COX-2表达状态与肝癌的形成与转归关系密切, 可作为评价抗癌药物疗效及其作用机制的理想指标.
本试验采用免疫细胞化学法观察0.5 mg/L丹参酮Ⅱ A处理肝癌细胞后COX-2表达情况, 与对照组相比明显下调, 其催化产物前列腺素E2的释放水平亦明显下降, 与对照组比较差异均有显著性(P<0.01), 考虑丹参酮可能是间接作用于COX-2, 下调其表达水平, 影响前列腺素E2释放, 发挥肿瘤抑制和凋亡作用.
随着对丹参酮ⅡA抗癌机制的不断深入研究, 将作为一种植物成分的新型抗癌类药物, 应用于临床治疗.
丹参酮: 活血化淤中药丹参的有效成分, 为一组脂溶性菲醌类成分. 包括丹参酮Ⅰ、丹参酮ⅡA、丹参酮ⅡB、隐丹参酮、二氢丹参酮等. 他们通过杀伤肿瘤细胞, 诱导其分化和凋亡等途径发挥其抑癌作用.
电编: 张敏 编辑:潘伯荣
| 1. | Mosaddik MA. In vitro cytotoxicity of tanshinones isolated from Salvia miltiorrhiza Bunge against P388 lymphocytic leukemia cells. Phytomedicine. 2003;10:682-685. [PubMed] [DOI] |
| 2. | 田 耕, 于 皆平. 尼美舒利对肝癌SMMC-7721细胞增殖、凋亡的干预作用. 武汉大学学报(医学版). 2002;23:37-39. |
| 3. | Rodrigues NR, Rowan A, Smith ME, Kerr IB, Bodmer WF, Gannon JV, Lane DP. p53 mutations in colorectal cancer. Proc Natl Acad Sci USA. 1990;87:7555-7559. [PubMed] [DOI] |
| 4. | Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implica-tions in tissue kinetics. Br J Cancer. 1972;26:239-257. [PubMed] [DOI] |
| 5. | Wu WL, Chang WL, Chen CF. Cytotoxic activities of tanshinones against human carcinoma cell lines. Am J Chin Med. 1991;19:207-216. [PubMed] [DOI] |
| 7. | Saukkonen K, Nieminen O, van Rees B, Vilkki S, Harkonen M, Juhola M, Mecklin JP, Sipponen P, Ristimaki A. Expression of cyclooxygenase-2 in dys-plasia of the stomach and in intestinal-type gastric adenocarcinoma. Clin Cancer Res. 2001;7:1923-1931. [PubMed] |
| 8. | Souza RF, Shewmake K, Beer DG, Cryer B, Spechler SJ. Selective inhibition of cyclooxygenase-2 suppre-sses growth and induces apoptosis in human eso-phageal adenocarcinoma cells. Cancer Res. 2000;60:5767-5772. [PubMed] |
| 9. | Singh B, Lucci A. Role of cyclooxygenase-2 in breast cancer. J Surg Res. 2002;108:173-179. [PubMed] [DOI] |
| 10. | Kasper HU, Wolf H, Drebber U, Wolf HK, Kern MA. Expression of inducible nitric oxide synthase and cyclooxygenase-2 in pancreatic adenocarcino-ma: correlation with microvessel density. World J Gastroenterol. 2004;10:1918-1922. [PubMed] [DOI] |
| 12. | Koga H, Sakisaka S, Ohishi M, Kawaguchi T, Taniguchi E, Sasatomi K, Harada M, Kusaba T, Tanaka M, Kimura R. Expression of cyclo-oxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology. 1999;29:688-696. [PubMed] [DOI] |
| 14. | 张 必翔, 陈 孝平, 张 万广, 余 红平, 朱 虹, 罗 顺峰, 王 其, 吴 在德, 裘 法祖. 选择性COX-2抑制剂Nimesulide对肝肿瘤细胞HepG2增殖与凋亡的影响. 中华实验外科杂志. 2004;21:430-432. |
| 15. | Cianchi F, Cortesini C, Fantappie O, Messerini L, Sardi I, Lasagna N, Perna F, Fabbroni V, Di Felice A, Perigli G. Cyclooxygenase-2 activation mediates the proangiogenic effect of nitric oxide in colorectal cancer. Clin Cancer Res. 2004;10:2694-2704. [PubMed] [DOI] |