修回日期: 2005-11-19
接受日期: 2005-11-26
在线出版日期: 2006-05-18
目的: 探讨经口接种制作的幽门螺杆菌(H. pylori)小鼠感染模型H. pylori对肝组织Cyclin D1和PCNA表达的影响.
方法: C57BL/6小鼠30只经口感染接种H. pylori悉尼株(SS1), 置层流柜中饲养8 mo. 用巢式PCR检测肝组织中H. pylori 16S rRNA, 并提取阳性样本的mRNA与蛋白, 用RT-PCR、Western blot等方法检测小鼠肝组织癌基因Cyclin D1和PCNA mRNA及蛋白表达变化.
结果: 巢式PCR检测15只小鼠肝组织中H. pylori DNA, 有6只16S rRNA基因为阳性, 测序结果经序列分析后显示与胃黏膜分离培养细菌、接种细菌同源性100%. 肝组织内有H. pylori定植的6只感染小鼠肝组织Cyclin D1和PCNA mRNA表达升高(0.78±0.13 vs 0.66±0.03, P<0.05; 0.86±0.17 vs 0.56±0.24, P<0.01). Western blot结果显示, Cyclin D1蛋白表达有增高趋势, 但与对照组比较无显著性差异; PCNA蛋白表达增高, 与对照组比较有显著性差异(1.16±0.40 vs 0.64±0.11, P<0.05).
结论: 经口接种H. pylori可达小鼠肝脏, 使Cyclin D1和PCNA表达增强.
引文著录: 田雪飞, 范学工, 黄燕, 张艳, 朱才. 感染幽门螺杆菌小鼠肝组织Cyclin D1和PCNA的表达. 世界华人消化杂志 2006; 14(14): 1341-1345
Revised: November 19, 2005
Accepted: November 26, 2005
Published online: May 18, 2006
AIM: To detect the expression of Cyclin D1 and proliferating cell nuclear antigen (PCNA) in liver tissues of C57BL/6 mice infected with H. pylori by oral inoculation.
METHODS: Thirty C57BL/6 strain mice, used as experiment animal, were orally inoculated with H. pylori SS1 strain and fed in laminar flow cabinets for 8 mo. H. pylori 16S rRNA in liver was examined by nested polymerase chain reaction (PCR), and then mRNA and protein were extracted from the positive liver tissues. The mRNA and protein expression of Cyclin D1 and PCNA were detected by reverse transcription PCR (RT-PCR) and Western blot, respectively.
RESULTS: Six of fifteen liver tissues were positive for H. pylori 16S rRNA after examination of nested PCR. Sequencing results of 16S rRNA PCR products showed the 100% homogeneity with cultured H. pylori from gastric mucosa and inoculated H. pylori SS1. The mRNA expression of Cyclin D1 and PCNA in liver of C57BL/6 mice infected with H. pylori were significantly increased in comparison with those in the controls (0.78 ± 0.13 vs 0.66 ± 0.03, P < 0.05; 0.86 ± 0.17 vs 0.56 ± 0.24, P < 0.01), and the protein expression of PCNA was also increased (1.16 ± 0.40 vs 0.64 ± 0.11, P < 0.05). Although the expression of Cyclin D1 protein had an increased tendency, it was not significantly different from those in the controls (P > 0.05).
CONCLUSION: H. pylori inoculated orally can arrive at liver, and induce increased expression of Cyclin D1 and PCNA.
- Citation: Tian XF, Fan XG, Huang Y, Zhang Y, Zhu C. Expression of Cyclin D1, proliferating cell nuclear antigen in liver of C57BL/6 mice infected with Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1341-1345
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1341.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1341
H. pylori作为胃癌和胃淋巴瘤的致病因素已为许多研究所确定, 但在肝癌的发生、发展中是否也起作用, 目前仍在研究之中. 研究发现肝癌患者肝组织内存在H. pylori感染[1-5]. 但H. pylori定植于肝脏, 是否能作为独立的致病因素引起肝细胞病变, 甚至促进肝癌的发生? 我们已观察到经口接种的H. pylori可到达小鼠肝脏, 并能作为独立的致病因素引起肝脏炎症反应[6], 本研究中, 我们通过检测经口感染H. pylori的C57BL/6小鼠肝组织细胞周期素D1(cyclin D1)、增生细胞核抗原(PNCA)表达的变化, 更进一步探讨H. pylori与肝癌发展之间的可能关系.
C57BL/6小鼠(清洁级)30只, 6-8周龄, ♂, 体质量25-30 g, 购自上海实验动物中心, 随机分为实验组(经口接种感染H. pylori, 20只)与对照组(未接种H. pylori, 10只). H. pylori使用悉尼株(SS1), 培养按我室建立方法进行[7]. 蛋白酶K购自丹麦Dako公司; 逆转录试剂购自Promega公司; TRIzol购自Omega公司; PCR相关试剂为大连宝生物工程有限公司产品; 兔抗小鼠Cyclin D1、PCNA、actin多克隆抗体, 辣根过氧化物酶标记羊抗兔二抗均购自美国SantCruz公司; PVDF膜购自美国Pierce公司; ECL增强化学发光试剂盒购自美国Amersham公司. H. pylori感染小鼠模型参照我室建立方法进行[5]. 饲养8 mo时处死, 取肝组织入液氮保存.
部分肝组织提取细菌DNA用于巢式PCR检测H. pylori 16S rRNA基因[1], 其引物序列: 外引物: 上游5'-GCT ATG ACG GGT ATC C-3', 下游5'-ACT TCA CCC CAG TCG CTG-3', 扩增片段1200 bp, 55℃退火1.5 min, 72℃延伸2 min; 内引物: 上游5'-GAC ACG GTC CAG ACT CCT A-3', 下游5'-TGG CTG ATT TGC GAT TA-3', 扩增片段1020 bp, 52℃ 1.5 min, 72℃ 2 min. PCR产物纯化后基因测序, 大连宝生物工程技术有限公司完成. 实验组选取肝组织H. pylori 16S rRNA基因阳性的小鼠提取肝组织总RNA及蛋白. 总RNA提取按TRIzol试剂盒说明进行, 紫外分光光度计测定总RNA浓度与纯度, -70℃保存备用. 逆转录取总RNA 2 μL, 10 mmol/L Oligo dT 1 μL, 用DEPC水补至总体积12 μL, 70℃ 5 min, 冰上骤冷后加入5×buffer 4 μL, 20 mU/L RNA酶抑制剂1 μL, 10 mmol/L dNTP 2 μL, 200 mU/L M-MLV 1 μL, 37℃ 反应60 min, 94℃灭活5 min. PCR引物根据GenBank中小鼠Cyclin D1, PCNA, β-actin cDNA 序列进行设计(表1). 取PCR产物5 μL在15 g/L琼脂糖凝胶上电泳(含0.5 mg/L溴化乙锭). 肝组织蛋白提取: 100 mg肝组织, 加入组织蛋白提取裂解液(20 mmol/L Tris-HCl, pH 7.4, 1 mol/L NaCl, 1 mmol/L EDTA, 1 mmol/L MgCl2, 1 mmol/L β-ME, 10 g/L NP-40, 1 g/L SDS, 5 mmol/L DTT, 10 mmol/L PMSF) 200 μL匀浆, DTT与PMSF临用前加入, 冰上放置30 min裂解,最大功率脉冲超声粉碎30 s, 13 000 r/min离心30 min, 取上清液分装, Bradford法测定蛋白浓度, Western blot检测Cyclin D1和PNCA的表达. PCR及Western blot条带应用Eagle Eye Ⅱ图像分析处理系统分析结果.
| 因 | 引物序列 | PCR反应条件 | 目的片段大小 |
| CyclinD1 | GAGAAGTTGTGCATCTACAC | 94℃ 1 min, 55℃ 1 min, 72℃ 1.5 min, 35 cycles | 400 bp |
| GAAGGGCTTCAACTGTTCC | |||
| PCNA | AACTTGGAATCCCAGAACA | 94℃ 1 min, 55℃ 45 s, 72℃ 45 s, 35 cycles | 293 bp |
| AGACAGTGGAGTGGCTTTT | |||
| β-actin | GCTGTCCCTGTATGCCTCT | 461 bp | |
| GGTCTTTACGGATGTCAACG |
统计学处理 实验数据用mean±SD表示, 两组间样本先进行F方差齐性检验, 方差齐用两样本等方差t检验, 方差不齐用两样本异方差t检验. 全部数据经SPSS 10.0大型统计软件包处理, P<0.05为统计学上差异有显著性.
实验组20只小鼠造模灌胃过程中死亡2只, 2 mo时为观察H. pylori胃内定植情况处死3只, 剩余15只, 饲养8 mo时处死. 结果在15例中6例16S rRNA, 26 kDa, cagA以及vacA基因全部为阳性, 阳性率40%; 对照组无一例阳性. 取2例阳性小鼠肝组织的H. pylori 16S rRNA PCR产物测序, 与胃黏膜分离培养以及接种H. pylori的16S rRNA PCR产物测序结果进行同源比较, 3者的同源性为100%.
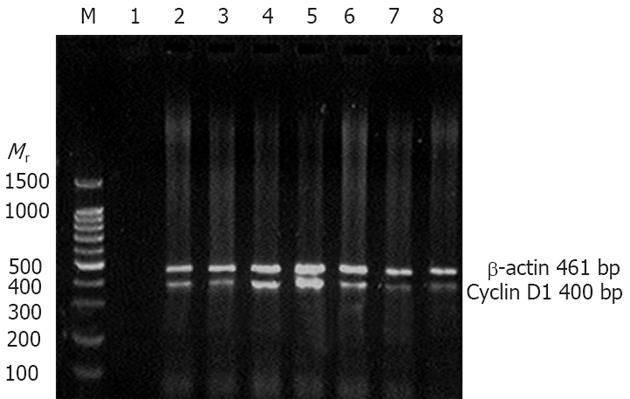
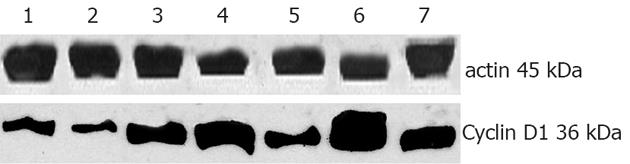
根据Cyclin D1及β-actin基因PCR扩增条带凝胶电泳后照相扫描图像分析结果, 发现与对照组比较, 肝组织内检测到H. pylori基因的6例实验组小鼠肝组织Cyclin D1 mRNA在感染8 mo时表达升高(P<0.05, 图1). 采用Western blot方法观察肝组织Cyclin D1蛋白表达, 结果虽然6例小鼠肝组织Cyclin D1蛋白表达有增高趋势, 但与对照组比较无显著性差异(图2, 表2).
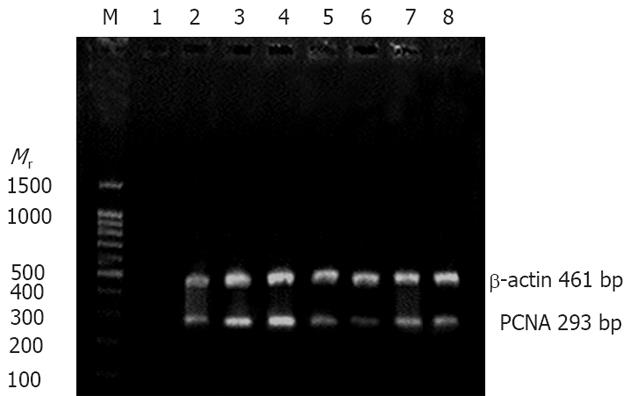
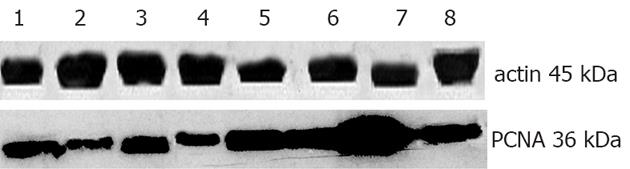
根据PCNA及β-actin基因PCR扩增条带凝胶电泳后照相扫描图像分析结果, 与对照组比较, 肝组织内检测到H. pylori基因的6例实验组小鼠肝组织PCNA mRNA在感染8 mo时表达升高(P<0.01, 图3). 采用Western blot方法观察肝组织PCNA蛋白表达, 与对照组比较有显著性差异(P<0.05, 图4, 表2).
H. pylori与人胃外疾病的关系已引起相关领域学者们的兴趣和重视, H. pylori在冠心病患者冠状动脉的粥样斑块[8-9]、胆管癌患者的胆囊[10-12]及肝癌患者的肝癌组织[1-5]中不断被发现. 作为Ⅰ类致癌因子的H. pylori与胃癌的发生关系密切, 与其他器官肿瘤的发生是否也存在一定联系? 我们前期的研究已从肝癌组织病理切片中观察到弯曲杆状细菌存在[13], 并且从肝癌患者石蜡包埋及新鲜肝组织中均扩增出螺杆菌16S rRNA基因, 测序及同源比较显示与H. pylori有99%-100%的同源性[1-2]. 表明H. pylori肝组织感染与肝癌发生之间存在联系. 在本研究中, 我们在经口接种感染H. pylori的C57BL/6小鼠肝组织中用巢式PCR方法扩增H. pylori 16S rRNA基因, 15例中6例阳性(阳性率40%), 与胃组织培养出的H. pylori及接种的原始菌株PCR产物测序结果进行同源比较, 三者同源性达100%, 证实小鼠肝组织中检测到的H. pylori与接种H. pylori为同一细菌. 因此我们认为, 经口接种的H. pylori可通过某种途径到达小鼠肝组织.
前期研究中, 我们已观察了H. pylori对体外HepG2细胞的细胞毒作用以及对癌基因Cyclin D1和PCNA的影响, 初步结果发现H. pylori有明显的致肝细胞病变作用[14-15], 并能使HepG2细胞的上述癌基因mRNA及蛋白表达升高[16-17]. 经口接种的H. pylori可到达C57BL/6小鼠肝脏, 主要分布在肝脏中央小静脉与肝血窦内, 并出现以淋巴细胞浸润为主的炎症浸润[18]. McCathey[19]观察了腹腔注射H. pylori的小鼠肝组织的病理变化, 结果发现接种3 d后肝组织就开始出现以淋巴细胞浸润为主的炎症病灶. 有学者甚至观察到1例经口接种感染H. pylori的C57BL/6小鼠23 mo后诱导出肝癌[20]. 为进一步了解H. pylori感染在肝癌发生中的可能作用, 我们检测了感染H. pylori C57BL/6小鼠8 mo时肝组织中Cyclin D1和PCNA的mRNA与蛋白表达变化. Cyclin D1是细胞周期G1/S期监控点重要的正向调控因子, 与细胞周期素依赖的蛋白激酶4(CDK4)结合并激活CDK4, 从而催化视网膜母细胞瘤蛋白(RB蛋白)磷酸化使细胞从G1期进入S期[21-24], 在进展期肝癌中发现有Cyclin D1的过量表达, 提示Cyclin D1的过量表达与肝癌进展有关[25-26]. PCNA是细胞周期G1/S相合成的细胞核蛋白, 与细胞增生活性有关[27-29], 与肝癌的发生、分化、大小、侵袭、复发和预后等均密切相关[30-31]. 我们发现, H. pylori感染小鼠8 mo时肝组织PCNA mRNA与蛋白表达均增加, Cyclin D1 mRNA表达增加, 而蛋白表达则只呈现增高趋势, 出现这一现象的原因我们推测H. pylori作为外来刺激因素, 首先引起PCNA的表达增加, 而随时间的迁延, 进而引起Cyclin D1的表达增加. 由于Cyclin D1和PCNA基因在肿瘤发生、发展中的重要作用, 因此我们认为H. pylori在肝癌的发展中可能起一定作用. 遗憾的是我们未能从肝组织中观察到肝癌或癌前增生性变化, 可能与感染时间或病理切片的取样位置有关, 但进一步将通过更长程的体外动物实验以明确H. pylori能否诱导肝癌或癌前增生性病变, 以确定H. pylori是否为肝癌发病的潜在诱发因素.
肝细胞癌是最常见的恶性肿瘤之一. 除病毒性肝炎、黄曲霉素、寄生虫感染等因素以外, 还有部分肝癌患者发病原因不明. 近年来, 已有少数研究报告在肝癌组织内观察到螺杆状细菌并检测出H. pylori DNA, 动物实验结果也显示H. pylori可经口接种到达肝脏, 但H. pylori是否为诱导肝癌的直接因素及深入的机制尚不清楚, 因此通过动物实验观察经口接种H. pylori小鼠肝组织cyclin D1和PCNA的表达, 以进一步明确H. pylori与肝癌发生的关系.
作为Ⅰ类致癌因子的H. pylori可能诱导肝癌的发生.
本文对经口接种H. pylori的C57BL/6小鼠8 mo时肝组织Cyclin D1和PCNA表达进行研究, 初步探讨了H. pylori对肝癌相关基因的影响.
巢式PCR: 设计两对引物, 一对引物扩增稍长片段(外引物), 在这一扩增范围内再设计一对引物(内引物), 扩增的产物是以第一对引物的产物稀释100到1000倍后为模板再行扩增的PCR方法. 可提高PCR的特异性和灵敏度.
本文从分子水平探讨了H. pylori感染与肝癌发生的相关性, 对于深入研究肝癌与H. pylori感染有理论意义和指导价值.
电编: 张敏 编辑:潘伯荣
| 1. | Fan XG, Peng XN, Huang Y, Yakoob J, Wang ZM, Chen YP. Helicobacter species ribosomal DNA recovered from the liver tissue of chinese patients with primary hepatocellular carcinoma. Clin Infect Dis. 2002;35:1555-1557. [PubMed] [DOI] |
| 3. | Ito K, Nakamura M, Toda G, Negishi M, Torii A, Ohno T. Potential role of Helicobacter pylori in hepa-tocarcinogenesis. Int J Mol Med. 2004;13:221-227. [PubMed] |
| 4. | Pellicano R, Mazzaferro V, Grigioni WF, Cutufia MA, Fagoonee S, Silengo L, Rizzetto M, Ponzetto A. Helicobacter species sequences in liver samples from patients with and without hepatocellular carcinoma. World J Gastroenterol. 2004;10:598-601. [PubMed] [DOI] |
| 5. | Verhoef C, Pot RG, de Man RA, Zondervan PE, Kuipers EJ, IJzermans JN, Kusters JG. Detection of identical Helicobacter DNA in the stomach and in the non-cirrhotic liver of patients with hepatocellu-lar carcinoma. Eur J Gastroenterol Hepatol. 2003;15:1171-1174. [PubMed] [DOI] |
| 8. | Kowalski M, Rees W, Konturek PC, Grove R, Scheffold T, Meixner H, Brunec M, Franz N, Konturek JW, Pieniazek P. Detection of Helicobacter pylori specific DNA in human atheromatous coronary arteries and its association to prior myocardial infarction and unstable angina. Dig Liver Dis. 2002;34:398-402. [PubMed] [DOI] |
| 9. | Pulkowski G, Majer M, Budzynski J, Swiatkowski M. Gastroesphageal reflux disease and coronary heart disease-coexistence or athological relationship? Pol Merkuriusz Lek. 2006;20:104-108. [PubMed] |
| 10. | Silva CP, Pereira-Lima JC, Oliveira AG, Guerra JB, Marques DL, Sarmanho L, Cabral MM, Queiroz DM. Association of the presence of Helicobacter in gallbladder tissue with cholelithiasis and cholecy-stitis. J Clin Microbiol. 2003;41:5615-5618. [PubMed] [DOI] |
| 11. | Maurer KJ, Rogers AB, Ge Z, Wiese AJ, Carey MC, Fox JG. Helicobacter pylori and cholesterol gallstone formation in C57L/J mice: a prospective study. Am J Physiol Gastrointest Liver Physiol. 2006;290:G175-G182. [PubMed] [DOI] |
| 12. | Abayli B, Colakoglu S, Serin M, Erdogan S, Isiksal YF, Tuncer I, Koksal F, Demiryurek H. Helicobacter pylori in the etiology of cholesterol gallstones. J Clin Gastroenterol. 2005;39:134-137. [PubMed] |
| 17. | Zhang Y, Fan XG, Chen R, Xiao ZQ, Feng XP, Tian XF, Chen ZH. Comparative proteome analysis of untreated and Helicobacter pylori-treated HepG2. World J Gastroenterol. 2005;11:3485-3489. [PubMed] [DOI] |
| 19. | McCathey SN, Shomer NH, Schrenzel MD, Whary MT, Taylor NS, Fox JG. Colonization and tissue tropism of Helicobacter pylori and a novel urease-negative Helicobacter species in ICR mice are independent of route of exposure. Helicobacter. 1999;4:249-259. [PubMed] [DOI] |
| 20. | Wang X, Willen R, Svensson M, Ljungh A, Wadstrom T. Two-year follow-up of Helicobacter pylori infection in C57BL/6 and Balb/cA mice. APMIS. 2003;111:514-522. [PubMed] [DOI] |
| 21. | Li YJ, Wei ZM, Meng YX, Ji XR. Beta-catenin up-regulates the expression of cyclinD1, c-myc and MMP-7 in human pancreatic cancer: relationships with carcinogenesis and metastasis. World J Gastroenterol. 2005;11:2117-2123. [PubMed] [DOI] |
| 22. | Dimova I, Zaharieva B, Raicheva S, Milev I, Dimitrov R, Doganov N, Aleksandrov M, Todorov T, Toncheva D. Association of CyclinD1 copy number changes with histological type in ovarian tumors. Acta Oncol. 2004;43:675-679. [PubMed] [DOI] |
| 23. | Koroleva OA, Tomlinson M, Parinyapong P, Sakvarelidze L, Leader D, Shaw P, Doonan JH. CycD1, a putative G1 cyclin from Antirrhinum majus, accelerates the cell cycle in cultured tobacco BY-2 cells by enhancing both G1/S entry and progression through S and G2 phases. Plant Cell. 2004;16:2364-2379. [PubMed] [DOI] |
| 24. | Jones CD, Darnell KH, Warnke RA, Zehnder JL. CyclinD1/CyclinD3 ratio by real-time PCR improves specificity for the diagnosis of mantle cell lymphoma. J Mol Diagn. 2004;6:84-89. [PubMed] [DOI] |
| 25. | Anna CH, Iida M, Sills RC, Devereux TR. Express-ion of potential beta-catenin targets, cyclin D1, c-Jun, c-Myc, E-cadherin, and EGFR in chemically induced hepatocellular neoplasms from B6C3F1 mice. Toxicol Appl Pharmacol. 2003;190:135-145. [PubMed] [DOI] |
| 26. | Joo M, Lee HK, Kang YK. Expression of beta-catenin in hepatocellular carcinoma in relation to tumor cell proliferation and cyclin D1 expression. J Korean Med Sci. 2003;18:211-217. [PubMed] [DOI] |
| 27. | Maes L, Kalala JP, Cornelissen M, De Ridder L. PCNA, Ki-67 and hTERT in residual benign menin-giomas. In Vivo. 2006;20:271-275. [PubMed] |
| 28. | Watts FZ. Sumoylation of PCNA: Wrestling with recombination at stalled replication forks. DNA Repair (Amst). 2006;5:399-403. [PubMed] [DOI] |
| 29. | Arias EE, Walter JC. PCNA functions as a molecular platform to trigger Cdt1 destruction and prevent re-replication. Nat Cell Biol. 2006;8:84-90. [PubMed] [DOI] |
| 30. | Saftoiu A, Ciurea T, Georgescu C, Banita M, Coma-nescu V, Rogoveanu I, Gorunescu F, Georgescu I. Immunohistochemical assessment of proliferating cell nuclear antigen in primary hepatocellular carcinoma and dysplastic nodules. J Cell Mol Med. 2003;7:436-446. [PubMed] [DOI] |
| 31. | Xiao EH, Li JQ, Huang JF. Effects of p53 on apopto-sis and proliferation of hepatocellular carcinoma cells treated with transcatheter arterial chemoembo-lization. World J Gastroenterol. 2004;10:190-194. [PubMed] |