修回日期: 2006-01-10
接受日期: 2006-01-25
在线出版日期: 2006-05-08
目的: 探讨复方甘草酸苷(Stronger Neo-Minophagen C, SNMC)对暴发性肝衰竭(FLF)患者的保护作用.
方法: 全部病例均为2003-03/2005-03期间住院的患有急性、亚急性重型肝炎的86例实验分为治疗组和对照组. 治疗组每天注射(iv)SNMC 120 mL, 同时采用常规保肝支持对症治疗. 对照组则仅用保肝支持对症治疗. 对比观察两组的转氨酶(ALT)、胆固醇(CHOL)、总胆红素(TBIL)、凝血酶原活动度(PTA)、肿瘤坏死因子-α(TNF-α)、一氧化氮(NO)、白介素-6(IL-6)的变化情况及病情转归.
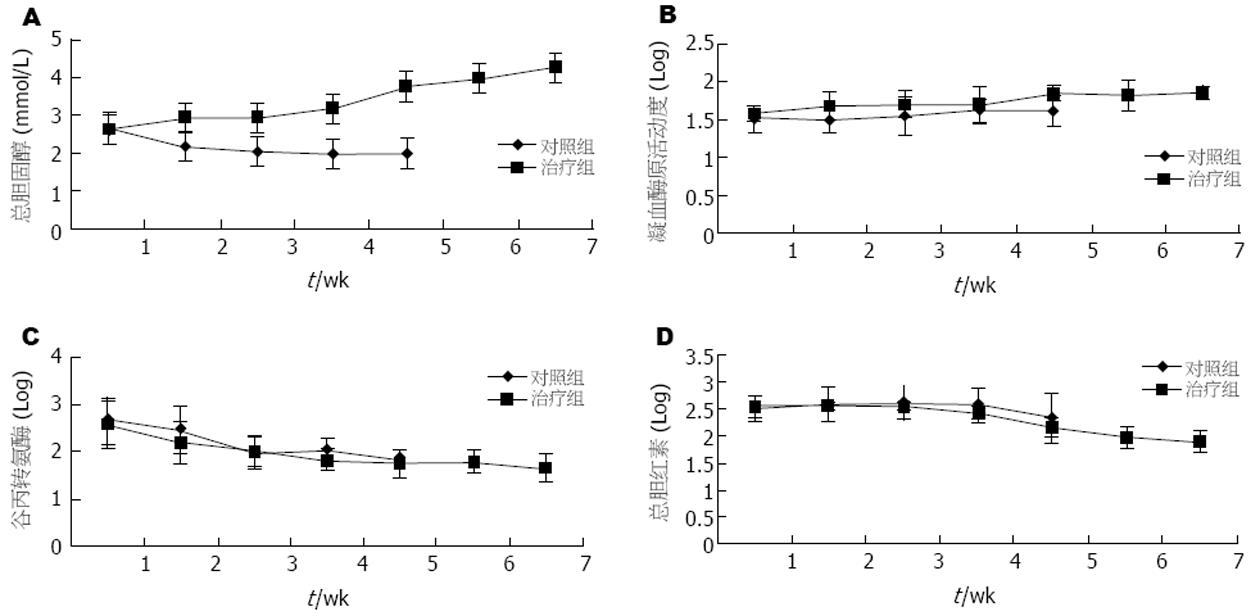
结果: ALT、TBIL两组比较差异不显著(P>0.05); CHOL、PTA在治疗组的恢复程度(3 wk后)明显优于对照组, 两组差异显著(P<0.01). 两组治疗后, 治疗组NO、IL-6水平与对照组相比有显著差异(24.5±18.1 μmol/L vs 48.1±24.1 μmol/L, P<0.01; 76.9±71.2 ng/L vs 357.1±79.1 ng/L, P<0.01). 治疗组有17例治疗无效, 病死率为37.8%(17/45), 对照组有29例治疗无效, 病死率为70.7%(29/41), 两组相比差异显著(P<0.01).
结论: SNMC对暴发性肝衰竭有明显的保护作用, 并抑制各种因素所介导的炎症反应, 从而防止或缓解肝坏死及减少并发症, 降低病死率.
引文著录: 于仲青, 杨宝山, 王岩, 陈立艳, 毕蔓茹, 王福祥, 马英骥. 复方甘草酸苷对暴发性肝衰竭患者的保护作用. 世界华人消化杂志 2006; 14(13): 1318-1322
Revised: January 10, 2006
Accepted: January 25, 2006
Published online: May 8, 2006
AIM: To discuss the protective effect of Stronger Neo-Minophagen C (SNMC) on patients with fulminant liver failure (FLF).
METHODS: From March 2003 to March 2005, 86 FLF patients were selected for this study, and they were assigned into group A and B. The patients in group A were intravenously injected with SNMC 120 mL per day, combined with symptomatic treatment to protect the liver. Symptomatic treatment was only performed on patients in group B, serving as controls. The level changes of serum alanine aminotransferase (ALT), cholesterol (CHOL), total bilirubin (TBIL), prothrombin activity (PTA), tumor necrosis factor TNF-α, nitrix oxide (NO), and interleukin-6 (IL-6), as well as the outcome of the disease, were observed and comparatively analyzed.
RESULTS: The levels of ALT and TBIL had no significant difference between the two groups (P > 0.05), while those of CHOL and PTA were significantly different between them (P < 0.01). After treatment, the levels of NO and IL-6 were markedly lower in group A than those in group B (24.5 ± 18.1 μmol/L vs 48.1 ± 24.1 μmol/L, P < 0.01; 76.9 ± 71.2 ng/L vs 357.1 ± 79.1 ng/L, P < 0.01). The fatality rates were 37.8% (17/45) and 70.7% (29/41), respectively, in group A and B, and there was significant difference between them (P < 0.01).
CONCLUSION: SNMC has obvious protective effect on FLF patients through inhibiting the inflammation mediated by inflammatory mediators.
- Citation: Yu ZQ, Yang BS, Wang Y, Chen LY, Bi MR, Wang FX, Ma YJ. Protective effect of Stronger Neo-Minophagen C on patients with fulminant liver failure. Shijie Huaren Xiaohua Zazhi 2006; 14(13): 1318-1322
- URL: https://www.wjgnet.com/1009-3079/full/v14/i13/1318.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i13.1318
越来越多的研究证明, 各种急、慢性肝病, 尤其是暴发性肝衰竭的发病过程与细胞免疫直接导致的炎症坏死有密切关系, 一些炎症介质和细胞因子(包括NO, TNF-α, ET-1, IL-6, 内毒素等)参与了暴发性肝衰竭的发病过程. 近年国内外研究表明, 肝细胞凋亡与肝炎尤其是暴发性肝衰竭关系十分密切. 最新研究发现, 当LPS与D2GalN联合应用时可复制出类似人类暴发性肝衰竭的损伤模型, 更重要的是在肝脏损伤过程中有细胞凋亡的发生, 尤其在损伤早期凋亡特别明显, 因而二者合用致肝损伤有逐步取代两者单用成为研究FLF理想模型的趋势.
目前对于重症肝炎尚无有效的治疗方法, 预后极差, 病死率高达70%. 人工肝治疗和肝移植的开展虽然可以改善重症肝炎的预后, 但由于其价格昂贵及技术复杂还未能被众多的患者所接受. 因此重症肝炎的死亡率仍居高不下. 近年来诸多的医学工作者都在寻找新的方法和药物来治疗重症肝炎以降低其病死率, 但都没取得满意的结果. 以甘草酸为主要成分的复方甘草酸苷(Stronger neominophagen C, SNMC)注射剂具有抗炎及抗过敏, 并具有类激素样作用. 1958年日本的山本佑夫首次将SNMC用于治疗慢性肝炎, 认为其对降低转氨酶有效果. 后来铃木宏经过多年的临床应用和总结, 证明SNMC有明确的肝细胞保护作用. 其药理作用有: 保护肝细胞膜; 抗炎作用; 类固醇样作用; 免疫调节作用; 抑制病毒增殖、灭活病毒作用; 调控细胞凋亡作用; 抗补体作用; 抗纤维化作用. 但对重症肝炎治疗的研究尚未见报告. 近两年来我们根据本药的药理学作用将其试用于治疗重症肝炎获得了较好的疗效. 为了深入研究SNMC对人类暴发性肝衰竭的保护机制, 我们采用临床随机对照多中心研究观察了SNMC对暴发性肝衰竭患者的保护作用, 同时探讨了SNMC对患者血清NO, TNF-α, IL-6的影响, 为临床应用SNMC治疗重症肝炎提供了一定的临床和实验依据, 可能对提高重症肝炎治疗的疗效有重要意义.
入选标准: 既往无肝炎病史, 此次感染甲至戊型嗜肝病毒或非嗜肝病毒; 既往有慢性肝炎病史或乙肝病毒携带病史, 近1年内无肝功变化者新近重叠感染甲至戊型嗜肝病毒或非嗜肝病毒; 药物性肝损伤; 妊娠合并肝炎; 实验室主要指标: PTA≤40%(40%<PTA<60%诊断为重症趋势); TBIL每天增长≥17.1 μmol/L或血清总胆红素大于正常值10倍以上; 肝脏储备能力降低(蛋白和胆固醇合成能力明显降低). 排除标准: 单纯自身免疫性肝损伤; 单纯酒精性肝损伤; 代谢性疾病引起肝损伤; 慢性肝炎1年内肝功反复活动; 入院后治疗疗程小于7 d; 出现2种以上危急及生命并发症者. 全部病例均为住院的急性、亚急性重型肝炎. 分为治疗组和对照组, 其中治疗组45例, 对照组41例. 治疗前两组患者的性别比例、年龄构成、病程长短及病情定度等主要指标差异无显著意义(P>0.05). 所有入选病例共观察4-8 wk. 治疗组男30例, 女15例, 平均年龄47.3±17.0岁; 其中甲肝5例, 戊肝13例, 乙肝17例(其中2例重叠感染戊肝), 未分型10例; 该组中有7例由重症倾向转为亚急性重型肝炎; 腹水型18例, 脑型6例, 两者同时存在者14例. 对照组男28例, 女13例, 平均年龄45.2±17.0岁; 甲肝3例, 戊肝12例, 乙肝19例(其中1例重叠感染戊肝), 未分型7例; 5例由重症倾向转为亚急性重型肝炎; 腹水型16例, 脑型5例, 两者同时存在者15例. 甘草酸苷由日本美能发源制药公司提供; IL-6, TNF-α定量酶联检测试剂盒购自上海森雄科技试验有限公司; NO荧光试剂盒购自南京建成生物工程研究所; MOF-38IE超低温冰箱, 由日本SANYO公司制造; Q/BL001-91离心机, 北京医学离心机厂生产; DR-HW-1恒温水浴箱, 北京西城区医疗器械厂.
1.2.1 对照组采用综合治疗措施: 即目前通用的综合治疗措施. 稳定水、电解质平衡; 保持热量平衡; 支持治疗(新鲜血浆: 200-400 mL/d; 白蛋白: 50-100 mL/d); 护肝及促肝细胞再生; 并发症的防治. 治疗组在综合治疗措施基础上用SNMC替代甘利欣, iv点滴120 mL/d, 疗程应大于7 d. 治疗过程中24 h详细记录患者出入量, 观察基本生命体征、消化道症状、体力、精神状态及出血倾向等, 每3 d复查1次血尿分析、生化全项、PT和PTA. PTA的检测用酶联免疫法, 按说明书操作. 血清NO用硝酸还法, 按说明书操作. ALT, TBIL, ALB, CHOL用日立7070全自动生化仪进行检测. TNF-α, NO, IL-6分别于入院时(用药前)和出院时(用药后)各化验1次; CHOL, PTA, ALT, TBIL治疗组平均每周采血1次, 共7次, 对照组因死亡或病情加重退院及经济承受能力等原因, 仅采血5次. 同时观察患者消化道症状, 体力恢复, 黄疸消退的情况, 及并发肝性脑病, 出血, 腹水, 肝肾综合征, 肝肺综合征, 继发感染等情况, 以及病死率.
1.2.2 疗效判定: 显效为PTA>70%或接近正常、生化学检查各项指标达到或接近正常、症状和体征基本消失、生活质量明显提高; 好转为40%≤PTA≤70%、生化学检查各项指标得到一定改善、症状和体征明显好转、危及生命的并发症得到控制、生活质量改善; 恶化为黄染进行性加深、PTA进行性下降、出现了难以控制的危及生命的并发症; 死亡. 将上述标准归纳为有效和无效2类, 有效包括显效及好转, 无效包括恶化和死亡.
统计学处理 NO, TNF-α, IL-6的数据用mean±SD表示, 不同组别间用SPSS 10.0软件进行配对t检验及成组t检验, 其他数据的处理则仅用t检验.
治疗组严重乏力、消化道症状、黄疸、出血倾向、焦虑和烦躁、低热、肝臭及并发症的缓解情况明显好于对照组. 治疗组有17例治疗无效(包括死亡和病情恶化自动出院的患者), 病死率为37.8%(17/45), 对照组有29例治疗无效(包括死亡和病情恶化自动出院的患者), 病死率为70.7%(29/41). 两组病例PTA<20%的患者均死亡, 死亡者大多数合并二种以上严重的并发症, 如肝肾综合征、严重感染、腔道出血、肝性脑病等. 另外, 治疗组有7例重症趋势发展为重症肝炎的病例, 经积极治疗仅有1例死亡, 而对照组有5例类似患者就有1例死亡. 经统计学处理后, 出院时治疗组病情转归则明显优于对照组, 治疗前两组病例一般情况、病情定度无显著差异(P>0.05, 表1).
| 分组 | n | ALB(g/L) | TBIL(μmol/L) | CHOL(mmol/L) | PTA(%) |
| 治疗组 | 45 | 32.3±4.6 | 322.1±1.8 | 2.6±1.0 | 32.8±1.5 |
| 对照组 | 41 | 32.5±4.8 | 360.6±1.6 | 2.6±0.9 | 38.6±1.3 |
2.1 实验指标ALT, TBIL两组比较差异不显著, 可能与重症肝炎酶胆分离以及肝内淤胆有关; CHOL, PTA在治疗组的恢复程度明显优于对照组, 两组差异显著(P<0.01), 于治疗第3周后即明显改善(图1).
2.2 炎症介质两组之间的变化有显著差异, 可见SNMC对上述细胞因子作用明显(表2).
| 分组 | n | 治疗 | NO(μmol/L) | TNF-α(μg/L) | IL-6(ng/L) |
| 治疗组b | 45 | 前 | 54.6±31.2 | 206.1±62.5 | 447.8±91.9 |
| 后 | 24.5±18.1 | 148.7±108.4 | 76.9±71.2 | ||
| 对照组 | 41 | 前 | 60.0±28.1 | 114.9±55.6 | 403.4±81.4 |
| 后 | 48.1±24.1 | 94.1±54.4 | 357.1±79.1 |
暴发性肝衰竭是病毒性肝炎的严重临床类型, 其主要病理生理改变是机体免疫功能改变和肝细胞凋亡或死亡, 导致的肝功能衰竭. 急性重型肝炎发病多在14 d之内, 入院时多伴有神志障碍或昏迷; 亚急性重型肝炎发病多在8-10 wk之间, 肝功能全面受损, 黄疸加深, PTA降低, 昏迷不多见, 至少入院时未发生昏迷; 极度乏力、严重的消化道症状如腹胀、恶心、呕吐、呃逆是重型肝炎的早期而重要的表现; 性格改变、睡眠颠倒、计算力下降是肝昏迷先兆; 出血倾向、感染、少尿是重型肝炎的危险信号; 而劳累、酗酒、情绪波动、各类感染、上消化道出血、高蛋白饮食是重型肝炎病情加重的诱发因素, 重型肝炎病情重, 合并症多, 预后差[1]. 复方甘草酸苷是最先由日本开发的以甘草酸(甘草甜素)为主要成分的静脉和口服制剂. 1958年, 日本学者将SNMC尝试性地用于慢性肝炎患者的治疗, 结果肝功能指标得到了明显改善. 1977年, 日本肝病专家铃木宏教授采用严格的随机双盲对照法验证了SNMC对慢性肝炎的疗效, 证实SNMC能够有效降低ALT, AST和γ-GT, 目前, 在日本肝病临床上正作为最佳的肝保护剂广泛应用. 1980年初, 北京协和医院等11家医院将甘草酸苷用于治疗慢性乙肝, 证明其具有明显改善肝功能的疗效, 1985年我国应用甘草单胺盐制剂α-体治疗慢性病毒性肝炎, 临床应用证实该制剂有显著改善肝功能的作用. 但应用本制剂对重型肝炎患者的临床治疗研究尚未见报道[2]. 我们首先通过动物实验研究证明, 本剂有明显阻止肝细胞凋亡和碎屑样坏死, 减轻内毒素所介导的炎症介质对肝细胞的损伤, 提高实验动物的存活率[3]. 本研究经过2年的临床观察, 共对照治疗86例, 在综合治疗的基础上加用SNMC, 共治疗45例, 与对照组相比, 在治疗完成1 wk以上的患者大部分自觉症状明显改善, 体力、食欲好转, 实验室指标, 如血清白蛋白、总胆固醇、PTA等主要指标明显优于对照组(P<0.05). 同时我们还观察到治疗组的TNF-α, NO, IL-6比对照组低[4]. 实验结果表明, SNMC通过使NO, IL-6释放的减少, 从而减轻FLF中肝血窦内微血栓形成及肝内微循环障碍的发生, 并且还能抑制FLF过程中产生的各种细胞因子所介导的免疫损伤, 减轻FLF时内毒素的产生, 从而减轻了LPS对肝细胞二次损伤作用. 这与动物实验得出的结果一致. 重型肝炎血清中TNF-α水平升高[5], 患者外周血单个核细胞诱生TNF-α活性增高, 恢复期下降[6], 提示TNF-α与肝坏死有一定关系. 有学者认为, 病毒性肝炎组织中TNF-α的表达和肝坏死病变的程度呈正相关, 肝组织中参与了病毒性肝炎肝坏死的发生. TNF-α具有活化CD4+CD8+及NK细胞杀伤肝细胞的作用, 是抗病毒防御效应的重要机制; 而TNF-α则与肝细胞的坏死密切相关[7]. 因此CTL被活化后在发挥抗病毒效应时还能引起肝细胞的损伤甚至严重的肝衰竭. 我们利用SNMC保护肝细胞的作用将其用于重型肝炎的患者, 发现SNMC不但能降低胆红素, 提高凝血酶原活动度, 缓解病情, 减少并发症, 降低病死率, 而且能够降低重症肝炎患者血清TNF-α, NO, IL-6的水平. 我们不但证明SNMC能降低FLF患者血清ALT和TBIL, 增加PTA和CHOL, 更为重要的是通过我们的实验证实, SNMC能使FLF患者血清TNF-α, NO, IL-6水平明显下降, 从而减少危及患者生命的严重并发症的发生, 缓解病情降低病死率, 但强调治疗必须早期. 本研究中治疗组7例重症倾向发展为重型肝炎, 经早期积极治疗有1例死亡, 而对照组3例只有1例痊愈. 两组病例中PTA<20%的所有患者均出现严重并发症而死亡就是一个证明. 已有实验研究证实SNMC能使小鼠FLF的肝细胞凋亡减少[6], 对FLF小鼠肝细胞有明显保护作用, 本实验又在临床治疗对照研究中证明了其在FLF患者的相同疗效. 我们推测SNMC能使FLF患者变性的肝细胞得到恢复, 阻止其进一步坏死, 使未变性的肝细胞免于损伤, 同时可促进肝细胞再生, 从而使FLF患者肝细胞坏死面积缩小.
在临床对照治疗观察前, 已通过实验研究验证了甘草酸苷对小鼠暴发性肝坏死模型的保护作用. 该领域中的研究热点是重型肝炎肝细胞凋亡的发病机制及甘草酸苷对其保护机制研究.
本文首次应用甘草甜素在临床上对重型肝炎患者进行了多中心、随机、对照观察,降低了重型肝炎的病死率, 且筛选出取得最佳疗效的剂量, 这将对重型肝炎的临床治疗具有重要的指导作用, 为有效降低重肝的病死率提供新疗法.
电编: 韩江燕 编辑:潘伯荣