修回日期: 2006-04-15
接受日期: 2006-04-28
在线出版日期: 2006-05-08
目的: 探讨肠炎清的疗效及其机制.
方法: 以葡聚糖硫酸钠(DSS)饮水法复制小鼠实验性结肠炎40只, 随机平均分为4组: 肠炎清中药组、柳氮磺胺吡啶(SASP)西药组、肠炎清和SASP中西药结合组和模型组. 观察肠炎清(灌胃剂量为0.2 mL/(20g•d)、1次/d、疗程7 d)对疾病活动指数(DAI)和肠组织髓过氧化物酶(MPO)活性及TNF-α、IL-1β和IL-6 mRNA表达的影响.
结果: 与模型组相比, 肠炎清可降低DAI (1.413±0.835 vs 2.167±0.911, P<0.05)和MPO活性(72.4±0.590 nkat/g vs 117.0±0.902 nkat/g, P<0.05), 并降低肠组织TNF-α(0.841±0.190 vs 1.320±0.282, P<0.05)、IL-1β (0.641±0.095 vs 0.920±0.082, P<0.05)和IL-6 mRNA (1.241±0.247 vs 1.620±0.312, P<0.05)的表达, 中西医结合组以上指标下降更为明显(DAI: 0.608±0.449; MPO: 27.3±0.211; TNF-α: 0.339±0.081; IL-1β: 0.239±0.073; IL-6: 0.639±0.141)(P<0.01). 肠炎清与柳氮磺胺吡啶(SASP)的作用相当(P>0.05).
结论: 肠炎清可治疗DSS结肠炎, 其降低肠组织TNF-α、IL-1β和IL-6 mRNA的表达可能是其疗效机制之一.
引文著录: 吕永慧, 胡品津, 陈文红, 毕向军, 庞瑞萍. 中药肠炎清治疗小鼠葡聚糖硫酸钠所致结肠炎的机制. 世界华人消化杂志 2006; 14(13): 1283-1287
Revised: April 15, 2006
Accepted: April 28, 2006
Published online: May 8, 2006
AIM: To investigate the therapeutic effects of Changyanqing on dextran sulfate sodium(DSS)-induced colitis and its mechanism.
METHODS: DSS was used to establish the model of experimental colitis in 40 mice. Then the mice were averagely randomized into 4 groups (A, B, C, and D). The mice in group A, B, and C were treated with Changyanqing, salicylazosulfapyridine (SASP), and Changyanqing + SASP, respectively, and those in group D served as controls. Changyanqing was administratered by gastric irragation at a dose of 0.2 mL/(20g•d) for 7 d. The disease activity index (DAI) and the activity of intestinal myeloperoxidase (MPO) were observed. The levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and IL-6 mRNA were detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: In comparison with those in the controls, the DAI (1.413 ± 0.835 vs 2.167 ± 0.911, P < 0.05), and activity of MPO (72.4 ± 0.590 nkat/g vs 117.0 ± 0.902 nkat/g, P < 0.05), and the expression of TNF-α (0.841 ± 0.190 vs 1.320 ± 0.282, P < 0.05), IL-1β (0.641 ± 0.095 vs 0.920 ± 0.082, P < 0.05), and IL-6 (1.241 ± 0.247 vs 1.620 ± 0.312, P < 0.05) mRNA were significantly decreased in group A. The above decreases were more significant in group C (DAI: 0.608 ± 0.449; MPO: 27.3 ± 0.211; TNF-α: 0.339 ± 0.081; IL-1β: 0.239 ± 0.073; IL-6: 0.639 ± 0.141)(P < 0.01). There was marked difference between group A and B (P > 0.05).
CONCLUSION: Changyanqing is effective in the treatment of DSS-induced colitis, which may be associated with the decrease of DAI, MPO activity, and TNF-α, IL-1β and IL-6 mRNA expression.
- Citation: Lü YH, Hu PJ, Chen WH, Bi XJ, Pang RP. Therapeutic mechanism of Changyanqing in treatment of colitis induced by dextran sulfate sodium. Shijie Huaren Xiaohua Zazhi 2006; 14(13): 1283-1287
- URL: https://www.wjgnet.com/1009-3079/full/v14/i13/1283.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i13.1283
炎症性肠病(inflammatory bowel disease, IBD)是一组病因不明的慢性肠道炎症性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克隆恩病(Crohn's disease, CD). 其中UC的发病率近年来有明显增加的趋势. 本病治愈难度大, 且愈后又常易复发, 已被世界卫生组织列为现代难治病之一. 我们先前的研究发现, 中药制剂肠炎清口服并灌肠治疗UC的疗效优于柳氮磺胺吡啶(SASP)[1]. 为探讨该药的作用机制, 以期为临床使用提供理论依据, 我们观察了肠炎清对葡聚糖硫酸钠(dextran sulfate sodium, DSS)所致结肠炎的疗效以及对肠组织TNF-α, IL-1β和IL-6 mRNA表达的影响.
清洁级♀BALB/c小鼠40只, 8-10周龄, 体质量18-22 g, 由中山大学中山医学院实验动物中心提供. 肠炎清制剂由黄连、黄芪、蒲黄、白及、元胡按2∶5∶3∶4∶3比例制成, 每mL含3.375 g生药. 灌胃剂量为33.75 g生药/(kg•d), 即0.2 mL/(20g•d), 相当于成人剂量的2倍. 由广州市中医院药房按标准制造工艺加工提供. SASP片为上海三维制药有限公司产品, 批号: 200106c07, SASP碾磨成粉, 配成浓度为50 g/L的混悬液, 灌胃剂量为0.5 g/(kg•d), 即0.2 mL/(20g•d), 相当于成人剂量的2倍. DSS(Mr36 000-50 000)为ICN Biomedicals Inc.产品. Taq DNA聚合酶、AMV逆转录酶、提取组织总RNA试剂盒为宝生物工程有限公司产品; TNF-α, IL-1β, IL-6和β-actin引物由宝生物工程有限公司合成. DSS结肠炎模型参照Okayasu et al[2]的方法稍加改良. 以30 g/L DSS代替饮用水给予小鼠饮用, 连续7 d.
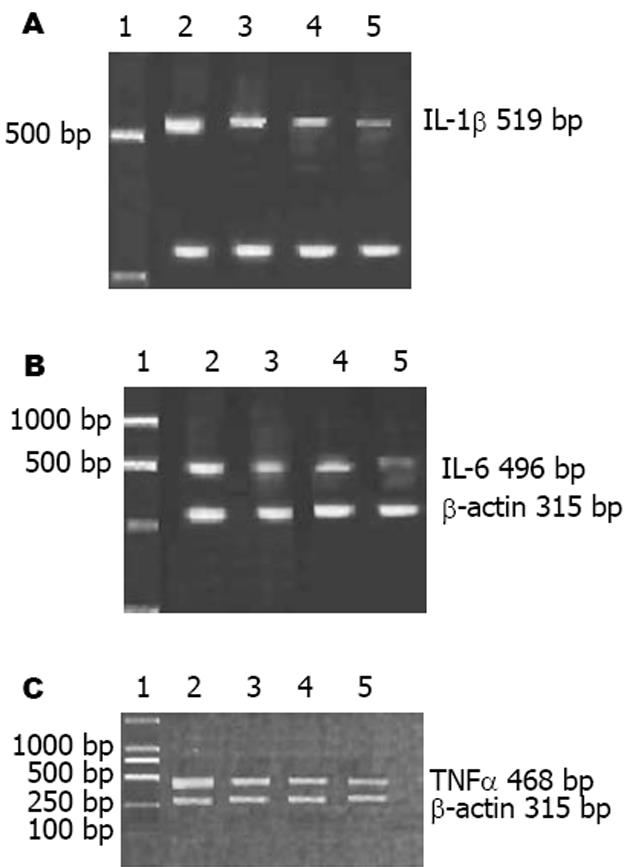
将40只小鼠随机分为4组. 中药组(n = 10)、西药组(n = 10)、中西药结合组(n = 10)和模型组(n = 10), 均给予30 g/L DSS 7 d, 并于4 d起分别灌胃给予肠炎清、SASP、肠炎清(中药组的半量)+SASP(西药组的半量)和等容的生理盐水, 连续7 d. 观察体质量变化、大便性状及潜血试验以计算疾病活动指数(disease activity index, DAI). 在11 d处死动物, 取下1/2段结肠, 部分置固定液中固定以作病理检查, 部分置液氮保存备用. 据Murthy et al[3]方法稍加改良, 计算DAI(表1). IL-1β引物: 5'-CCA GGA TGA GGA CCC AAG CA-3', 3'-CC TTT GTC GTT ACC AGC CCT-5', 扩增片段长度为519 bp; TNF-α引物: 5'-CGA GTG ACA AGC CCG TAG CC-3', 3'-CC GCT GAC CGC ACA AGT AGG-5', 扩增片段长度为468 bp; IL-6引物: 5'-CTT CCA GCC AGT TGC CTT CT-3', 3'-GG GGT TGA AGG TTA CGA GAG-5'扩增片段长度为496 bp; β-actin引物: 5'-ACC ACA GTC CAT GAA ATC AC-3', 5'-AGG TTT CTC CAG GCG GCA TG-3', 扩增片段长度为315 bp. 取结肠组织100 mg按试剂盒步骤提取组织总RNA, 经紫外分光光度计测量A260/A230比值, 计算提取液中RNA含量, 每例各取2.0 μg 总RNA, 于65℃变性5 min, 依次加入0.5 mmol/L dNTP, 5×RT Buffer, Random Primer 100 ng, 反转录酶10 U, 反应体系为20 μL, 42℃ 40 min, 95℃ 5 min, 将所得TNF-α, IL-1β, IL-6和β-actin cDNA于-20℃保存备用. PCR反应体系: 取cDNA产物5 μg, 10×PCR Buffer, Taq DNA聚合酶1 U, 反应体系为25 μL . TNF-α扩增条件为: 94℃ 2 min, 94℃ 45 s, 50℃ 45 s, 72℃ 45 s, 循环35次, 72℃ 10 min. 取PCR扩增产物10 μL, 经20 g/L琼脂糖凝胶电泳, 在紫外灯下观察鉴定扩增产物的片段长度, 并拍照, 用ZL-2000医学图像处理系统对电泳谱带进行灰度及面积扫描, 将同一标本的TNF-α mRNA电泳谱带的积分灰度值与β-actin mRNA的灰度值的比值作为该标本的TNF-α mRNA的半定量结果. IL-1β和IL-6的结果判断与此相同.
| 评分 | 体质量↓(%) | 大便 | 出血 |
| 0 | (-) | 正常 | 阴性 |
| 1 | 1-5 | (+) | |
| 2 | 5-10 | 松软 | (++) |
| 3 | 11-15 | (+++) | |
| 4 | >15 | 腹泻 | 肉眼血便 |
统计学处理 结果用mean±SD表示, 多组间比较用方差分析和q检验, 用SPSS10.0统计软件包进行分析.
给予30 g/L DSS 7 d后模型组的所有动物均可观察到大便松软或腹泻、血便及体质量减轻, 而3个治疗组的大便较成形、血便及体质量减轻较不明显(表2). 各组的疾病活动指数, 中药组和西药组较模型组明显降低(P<0.05和P<0.01), 但又高于中西药结合组(P<0.01和P<0.05), 中药组和西药组之间无明显差别(P>0.05).
中药组和西药组较模型组明显降低(P<0.05和P<0.01), 但又高于中西药结合组(P<0.01和P<0.05), 中药组和西药组之间无明显差别(P>0.05, 表2).
治疗UC的传统药物主要有水杨酸类药物、皮质类固醇和免疫抑制剂. 但这些药物由于副作用多而大使不少患者不能耐受. 新药5-氨基水杨酸虽疗效好且副作用少, 但其价格又过于昂贵. 近年来国内有关中药治疗UC的报道较多, 治疗方法多样, 疗效显著, 无明显毒副作用, 显示中药治疗本病的优越性和广阔的前景. 但任何一种药物治疗都必须有严格的动物实验, 而类似人类疾病的动物模型对验证药物疗效和研究其作用机制非常重要. 有关UC的动物模型有很多, 目前得到公认和广泛用作药物干预的是DSS模型, 其临床表现和组织学特点类似人类UC[2-5]. 国内有关中药治疗UC的临床报道虽多, 但开展动物实验研究的不多, 目前已有个别利用DSS结肠炎模型验证药物疗效和研究药物作用机制的报道[6]. 本研究显示, 给予30 g/L DSS 7 d后, 模型组各动物均出现不同程度的大便松软或腹泻、血便和体质量减轻, 组织学显示结肠下段糜烂或溃疡伴黏膜和黏膜下显著的炎症细胞浸润、部分有隐窝炎, 类似人类UC, 与文献 [2,7]报道相符. UC与免疫调节异常密切相关, 正常胃肠道内有大量的抗原物质存在, 如致病菌、正常菌群、细菌毒素、病毒、代谢的化学物质及食物等, 这些内容物均可能是潜在的免疫原. 显然, 肠免疫系统处于一种不断地反应状态, 当机体免疫功能正常时, 则诱发保护性免疫反应, 炎症就不会发生. 肠上皮细胞黏膜屏障的破坏为大量摄取肠抗原创造了条件, 免疫调节失衡是UC的免疫学特性. Sartor认为, UC的发病机制经过一系列的步骤, 如始发事件、诱发事件、免疫调节异常、组织损伤及临床症状. 始发因素可以是感染、毒素、非甾体类固醇药物等, 破坏了肠上皮屏障使肠组织暴露在大量的肠抗原中, 在遗传易感的宿主中诱发黏膜免疫反应. 故肠黏膜慢性失控的炎症是UC的特征, 细胞因子在此起了重要的作用[8-9]. 近年来对于细胞因子研究尚多. 细胞因子主要是指由机体免疫细胞和某些非免疫细胞合成, 分泌的一类具有广泛生物活性的小分子多肽物质, 作为细胞间的信号传递分子. 在介导和调节免疫应答及炎症反应过程中发挥重要作用. 在UC患者的结肠黏膜中可检测到大量淋巴细胞、浆细胞、巨噬细胞、中性粒细胞的存在[10], 这些免疫细胞可释放多种细胞因子. 根据细胞因子的大体作用, 细胞因子常分为三类: 促炎细胞因子抗炎细胞因子, 以及生长因子. 促炎细胞因子包括白介素-1(IL-1), IL-2, IL-6, 1L-8, IL-12, 肿瘤坏死因子-α(TNF-α), TNF-β, IFN等, 其中多数细胞因子由单核细胞以及巨噬细胞产生, 参与细胞介导的免疫反应. 抗炎细胞因子包括IL-4, IL-5, IL-10, IL-13等, 主要由T细胞产生, 参与体液免疫反应. 另一类生长因子包括了增殖刺激因子、转移生长因子(TGF)、表皮生长因子(EGF)、胰岛素样生长因子、成纤维细胞生长因子等, 对不同的细胞具有生长调节和增殖作用. 促炎细胞因子与抗炎细胞因子之间的平衡失调被视为UC的一个重要的发病机制[11-14]. 如果抗炎与促炎因子的平衡状态被破坏. 如促炎因子一方占优势则导致疾病的发生. 现已证实细胞因子在局部炎症反应和免疫反应中起重要作用. IL-1、IL-6、IL-8和TNF等促炎症细胞因子是公认的能介导UC发病的细胞因子[9], 且结肠IL-8水平与黏膜组织的中性粒细胞数成正相关[15-16]. 在活动性UC的病变部位, IL-1, IL-6, TNF-α及其他细胞因子如IL-8等均可增高 [17], 且与病变活动性有关. 研究发现, UC患者致炎细胞因子IL-1β、TNF-α、IL-6、IL-8明显升高[18-22], 且IL-1β和TNF-α的水平与疾病活动度及内镜分级相关; IL-1β是诱导IBD的肠道炎症的一种非常重要的细胞因子[23], Stevens et al[24]报道了从UC患者结肠黏膜分离的单核巨噬细胞中产生大量的IL-1β, 在UC活动期明显升高; Breese et年l报道在UC活动期TNF-α的水平在血浆及粪便中升高. IL-1β还可通过自分泌或旁分泌刺激其他炎症递质如IL-6、IL-8和TNF-α的产生, TNF-α则可使中性粒细胞聚集, 内皮细胞黏附分子上调以及增加上皮紧密连接的通透性和抑制上皮细胞的生长等. IL-6主要由单核巨噬细胞产生, 有广泛的促炎作用, 如促进B细胞活化、增生并最终分化为浆细胞, 增加免疫球蛋白合成; 并能促进T细胞增生、刺激毒性T细胞反应[25]. 有文献报道[26]: UC时IL-6水平明显升高, 可与TNF-α和IL-1α相互作用, 导致UC活动期的特征性炎症反应. 我们的研究显示, 模型组结肠组织出现TNF-α、IL-1β、IL-6 mRNA表达, 经肠炎清或SASP或肠炎清加SASP治疗后, 反映临床表现的DAI和组织学表现得到改善, 结肠组织TNF-α、IL-1β、IL-6 mRNA表达明显降低, 其中肠炎清和SASP的疗效相当, 但以肠炎清加SASP的疗效为最好, 说明中西药结合的疗效优于单用中药或西药, 而且可以减少肠炎清和SASP的用药量, 提示有可能减少药物的副作用. 肠炎清中黄连清热燥湿以治其标, 黄芪健脾以治其本, 元胡、蒲黄行气化瘀以改善肠黏膜的微循环, 白芨生肌护膜以修复肠黏膜, 肠炎清的治疗可降低肠组织TNF-α、IL-1β、IL-6 mRNA的表达, 结合临床[26]及本动物实验的疗效, 说明肠炎清对溃疡性结肠炎有显著的治疗作用, 其机制可能与抑制结肠黏膜损伤, 促进溃疡修复, 增强机体清除自由基和抗氧化能力, 调节紊乱的免疫功能有关.
本文应用分子生物学技术手段, 探讨了中药肠炎清治疗结肠炎的机制, 对了解中成药的治疗作用是个很好的研究方向. 课题设计合理, 方法先进, 统计资料详实, 结果有说服力.
电编: 李琪 编辑:潘伯荣
| 2. | Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 1990;98:694-702. [PubMed] [DOI] |
| 3. | Murthy SN, Cooper HS, Shim H, Shah RS, Ibrahim SA, Sedergran DJ. Treatment of dextran sulfate sodium-induced murine colitis by intracolonic cyclosporin. Dig Dis Sci. 1993;38:1722-1734. [PubMed] [DOI] |
| 4. | Ni J, Chen SF, Hollander D. Effects of dextran sulphate sodium on intestinal epithelial cells and intestinal lymphocytes. Gut. 1996;39:234-241. [PubMed] [DOI] |
| 8. | Papadakis KA, Targan SR. Role of cytokines in the pathogenesis of inflammatory bowel disease. Annu Rev Med. 2000;51:289-298. [PubMed] [DOI] |
| 9. | 李 琪佳, 徐 敏, 宫 恩聪. 细胞因子与溃疡性结肠炎. 中国煤炭工业医学杂志. 2001;4:411. |
| 10. | Schreiber S. Experimental immunomodulatory therapy of inflammatory bowel disease. Neth J Med. 1998;53:S24-S31. [PubMed] [DOI] |
| 11. | MacDonald TT, Monteleone G, Pender SL. Recent developments in the immunology of inflammatory bowel disease. Scand J Immunol. 2000;51:2-9. [PubMed] [DOI] |
| 12. | Papadakis KA, Targan SR. Role of cytokines in the pathogenesis of inflammatory bowel disease. Annu Rev Med. 2000;51:289-298. [PubMed] [DOI] |
| 13. | Ardizzone S, Porro GB. Inflammatory bowel disease: new insights into pathogenesis and treatment. J Intern Med. 2002;252:475-496. [PubMed] [DOI] |
| 14. | Rogler G, Andus T. Cytokines in inflammatory bowel disease. World J Surg. 1998;22:382-389. [PubMed] [DOI] |
| 15. | Daig R, Andus T, Aschenbrenner E, Falk W, Scholmerich J, Gross V. Increased interleukin 8 expression in the colon mucosa of patients with inflammatory bowel disease. Gut. 1996;38:216-222. [PubMed] [DOI] |
| 16. | Kusugami K, Fukatsu A, Tanimoto M, Shinoda M, Haruta J, Kuroiwa A, Ina K, Kanayama K, Ando T, Matsuura T. Elevation of interleukin-6 in inflammatory bowel disease is macrophage- and epithelial cell-dependent. Dig Dis Sci. 1995;40:949-959. [PubMed] [DOI] |
| 18. | Guimbaud R, Bertrand V, Chauvelot-Moachon L, Quartier G, Vidon N, Giroud JP, Couturier D, Chaussade S. Network of inflammatory cytokines and correlation with disease activity in ulcerative colitis. Am J Gastroenterol. 1998;93:2397-2404. [PubMed] [DOI] |
| 19. | Arai F, Takahashi T, Furukawa K, Matsushima K, Asakura H. Mucosal expression of interleukin-6 and interleukin-8 messenger RNA in ulcerative colitis and in Crohn's disease. Dig Dis Sci. 1998;43:2071-2079. [PubMed] [DOI] |
| 20. | Ishiguro Y. Mucosal proinflammatory cytokine production correlates with endoscopic activity of ulcerative colitis. J Gastroenterol. 1999;34:66-74. [PubMed] [DOI] |
| 21. | Holtkamp W, Stollberg T, Reis HE. Serum interleukin-6 is related to disease activity but not disease specificity in inflammatory bowel disease. J Clin Gastroenterol. 1995;20:123-126. [PubMed] [DOI] |
| 22. | Holub MC, Mako E, Devay T, Dank M, Szalai C, Fenyvesi A, Falus A. Increased interleukin-6 levels, interleukin-6 receptor and gp130 expression in peripheral lymphocytes of patients with inflammatory bowel disease. Scand J Gastroenterol Suppl. 1998;228:47-50. [PubMed] |
| 24. | Stevens C, Walz G, Singaram C, Lipman ML, Zanker B, Muggia A, Antonioli D, Peppercorn MA, Strom TB. Tumor necrosis factor-alpha, interleukin-1 beta, and interleukin-6 expression in inflammatory bowel disease. Dig Dis Sci. 1992;37:818-826. [PubMed] [DOI] |