修回日期: 2006-03-10
接受日期: 2006-03-15
在线出版日期: 2006-05-08
目的: 探讨缺氧诱导因子-1α(HIF-1α)在食管鳞癌细胞系EC-109中的表达及其意义.
方法: 采用逆转录聚合酶链反应(RT-PCR)和Western blot分别检测HIF-1α mRNA和蛋白在常氧及缺氧状态下在食管鳞癌EC-109细胞中的表达.
结果: HIF-1α mRNA在缺氧食管鳞癌EC-109细胞中过表达(P<0.05), 在缺氧24 h时HIF-1α mRNA表达最高, 其后随时间延长表达下降; HIF-1α蛋白水平在缺氧食管鳞癌EC-109细胞中无明显上调(P>0.05).
结论: 低氧可诱导食管鳞癌EC-109细胞中HIF-1α mRNA的过度表达, 缺氧状态下HIF-1α蛋白水平较常氧时无明显增加.
引文著录: 杜琰萍, 施瑞华, 肖斌, 朱宏, 凌亭生, 张国新, 郝波. 食管鳞癌细胞系EC-109中缺氧诱导因子-1α的表达意义. 世界华人消化杂志 2006; 14(13): 1247-1251
Revised: March 10, 2006
Accepted: March 15, 2006
Published online: May 8, 2006
AIM: To investigate expression and significance of hypoxia inducible factor-1α (HIF-1α) in human esophageal squamous cancer cell line EC-109.
METHODS: Semiquantity reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were performed to detect the expression of HIF-1α mRNA and protein in esophageal squamous cancer cell line EC-109 exposed to normal oxygen or hypoxia condition.
RESULTS: HIF-1α mRNA was over-expressed in esophageal squamous cancer cell line EC-109 under hypoxia condition (P < 0.05), and reached the peak at 24 h. However, HIF-1α protein had no significant up-regulation in hypoxia (P > 0.05).
CONCLUSION: Hypoxia can induce high expression of HIF-1α at mRNA level, but not at protein level.
- Citation: Du YP, Shi RH, Xiao B, Zhu H, Ling TS, Zhang GX, Hao B. Expression and significance of hypoxia-inducible factor-1 alpha in esophageal squamous cancer cell line EC-109. Shijie Huaren Xiaohua Zazhi 2006; 14(13): 1247-1251
- URL: https://www.wjgnet.com/1009-3079/full/v14/i13/1247.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i13.1247
我国是食管癌高发区, 食管癌校正死亡率达20.4/10万, 居世界首位, 主要为食管鳞状细胞癌, 占全部食管癌的95%左右. 食管癌总的疗效和预后较差, 对人们健康构成极大威胁. 近年来国内外学者对食管鳞癌进行了大量的基础研究, 特别是血管再生在食管癌发病机制中的作用. 缺氧诱导因子(hypoxia inducible factor, HIFs)是调节血管生成的重要活性调节因子. 施瑞华 et al[1-3,18]对HIF-1α的表达及其多态性与食管鳞癌临床病理特征的关系进行了研究, 结果提示HIF-1α可能与食管鳞癌血管生成、浸润能力、淋巴结转移和TNM分期有关; 我们进一步研究了体外培养食管鳞癌细胞EC-109中HIF-1α在常氧及缺氧状态下mRNA和蛋白水平的表达, 以探讨HIF-1α在食管鳞癌发生、发展中的作用机制.
人食管鳞癌细胞系EC-109购自中国科学院上海细胞所. 小牛血清购自杭州四季青公司; RPMI 1640培养液购自Gibco公司; RNA提取试剂Tri-Blue购于上海申能博彩公司; RT-PCR试剂盒购于Fermentas公司; 鼠抗人的HIF-1α单抗为Chemicon公司生产; HRP标记的羊抗鼠的二抗为Rockland公司产品; 鼠抗人的Tubulin单抗为Sigma公司产品; PVDF膜(微孔性的聚偏乙烯双氟化物膜)购自Roche公司. 其余试剂均为分析纯. 食管鳞癌EC-109细胞呈贴壁生长, 培养于含100 mL/L小牛血清、100 kU/L青霉素和100 mg/L链霉素的RPMI 1640培养液中, 置于含50 mL/L CO2的37℃培养箱中. 1-2 d换液1次, 3-4 d用2.5 g/L胰酶消化传代1次. 缺氧处理: 将细胞置于一密封袋中, 持续充以混合气体(50 mL/L O2, 100 mL/L CO2, 100 mL/L H2, 800 mL/L N2)模拟低氧环境, 缺氧时间分别为3, 6, 12, 24, 48, 72 h; 相应设置空白对照组.
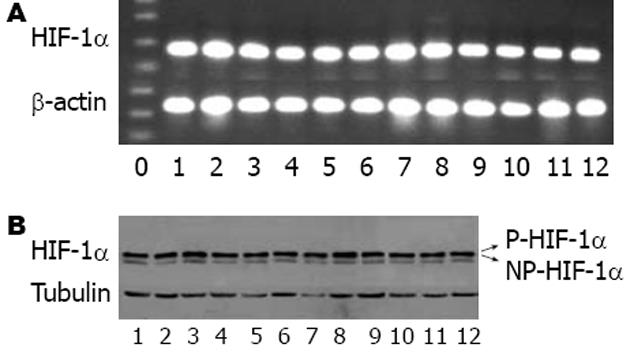
1.2.1 RT-PCR检测HIF-1α mRNA的表达: Tri-Blue试剂一步法提取细胞总RNA, 按照试剂盒说明书完成各个样本RNA的抽提纯化和cDNA的合成. 取总RNA 5 μL用MMLV逆转录酶进行逆转录, PCR扩增HIF-1α, 同时扩增β-actin作为内参照. 每个样本至少重复3遍. HIF-1α引物用Primer-5软件根据引物设计要求自己设计, 上游引物为5'-GCAAGACTTTCCTCAGTCGACACA-3', 下游引物为5'-GCATCCTGTACTGTCCTGTGGTGA-3', 扩增片段长度为207 bp; β-actin引物参照文献[4]设计, 上游引物为5'-AGCGGGAAATCGTGCGTG-3', 下游引物为5'-CAGGGTACATGGTGGTGCC-3', 扩增片段为287 bp; 引物合成于Invitrogen公司. PCR反应条件: 95℃预变性3 min, 94℃变性30 s, 60℃退火45 s, 72℃延伸1 min, 35个循环; 72℃延伸8 min. 产物于4℃保存. 10 g/L琼脂糖凝胶电泳分析结果.
1.2.2 Western blot检测HIF-1α蛋白的表达: 取3×105 EC-109细胞加细胞裂解液[20 mmol/L Tris(pH 7.5), 4 mmol/L EDTA(pH 8.0), 20 g/L SDS]150 μL裂解细胞制备总蛋白. 超声破碎后12 000 r/min, 离心10 min, 取上清, 用BSA标准蛋白检测蛋白浓度, 取总蛋白40 μg上样, 行稳流SDS-PAGE电泳, 稳压冰浴电转至PVDF膜, 50 g/L脱脂奶粉室温封闭1 h后TBST漂洗3×5 min加入鼠抗人HIF-1α单抗(工作浓度1∶500)4℃孵育过夜. TBST漂洗3×5 min后再加HRP标记的羊抗鼠二抗(工作浓度为1∶10 000)室温孵育1 h, TBST漂洗3×5 min. ECL化学发光法显影, 以Tubulin(工作浓度为1∶4000)为内参照.
统计学处理 数据以mean±SD表示, 两组数据比较采用配对t检验, P<0.05认为有统计学意义. Tanon Gis软件对凝胶电泳条带和感光胶片条带进行灰度值分析, 以目的条带与内参照条带的比值代表目的基因mRNA和蛋白的表达水平.
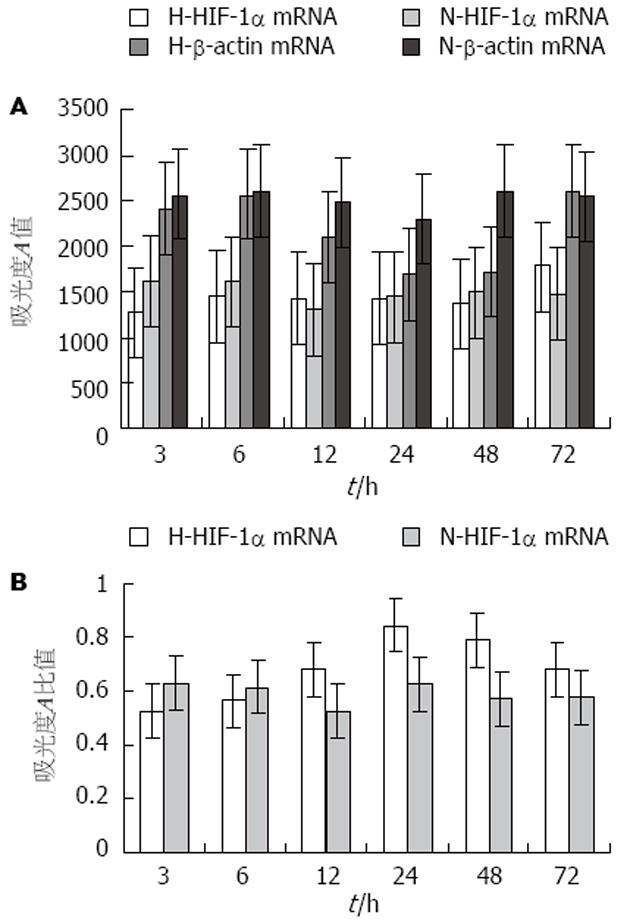
EC-109细胞中HIF-1α mRNA水平在缺氧组较常氧组明显升高(P<0.05), 而且在缺氧24 h时HIF-1α mRNA水平最高, 其后随缺氧时间延长而表达下降(图1A, 2A-B).
肿瘤增生过快造成肿瘤微环境始终处于相对缺氧和代谢紊乱状态, 这是恶性肿瘤的生长特点之一, 实体肿瘤一般可有10%-35%的缺氧细胞[5]. 研究表明缺氧可触发机体产生一系列应激性保护反应, 新生血管形成和细胞无氧代谢增加是肿瘤细胞得以在缺氧环境下免受损伤或死亡, 继续生长、增殖的重要途径[6-9]. 其中缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)的表达和活性增强是肿瘤细胞适应缺氧环境的重要原因. HIF-1是缺氧状态下广泛存在于哺乳动物及人体内的一种核转录因子. 由HIF-1α和HIF-1β两个亚基组成异源二聚体, HIF-1α是主要的氧调节亚基和功能亚基. 因为HIF-1α在常氧下迅速降解而在缺氧时稳定表达并活化[10-11], 所以其在细胞适应缺氧途径中是连接上下游基因激活的重要调节因子. 常氧时HIF-1α尽管表达, 但很快被泛素-蛋白酶体降解, 因此几乎检测不到; 缺氧时a亚单位降解被阻断, 得以在核内蓄积, 并与HIF-1β结合形成有活性的HIF-1, 从而启动50多种下游靶基因, 如EPO, VEGF, 血红素氧合酶-1, 葡萄糖转运因子1、3, 转铁蛋白及糖酵解酶类等的转录活化, 涉及肿瘤细胞能量代谢、血管生成、肿瘤转移、离子代谢和儿茶酚胺代谢等方面. 施瑞华 et al[1-2]的研究提示HIF-1α在食管鳞癌病理组织标本过表达而在正常食管上皮中无表达, 提示HIF-1α与食管鳞癌的血管生成、TNM分期、转移能力有关; 在本研究中我们也观察到体外培养的食管鳞癌EC-109细胞中无论在常氧还是缺氧状态下HIF-1α均有表达, 而且在缺氧状态下过表达(图1, 2A-B), 这也提示HIF-1α可能在食管鳞癌的发生、发展中发挥一定作用. 这与在人类其他恶性疾病如肺、肾、膀胱、前列腺、乳腺、胃、结直肠癌、宫颈癌、乳腺癌、垂体腺瘤等多种肿瘤及局部和远处转移灶中HIF-1α过表达[4-5,9,12,19-26], 而且其表达水平与肿瘤的发生演变过程、浸润能力、多药耐药及预后判断有关系[9,27-30], 但在大部分正常组织中无表达的研究结果一致.
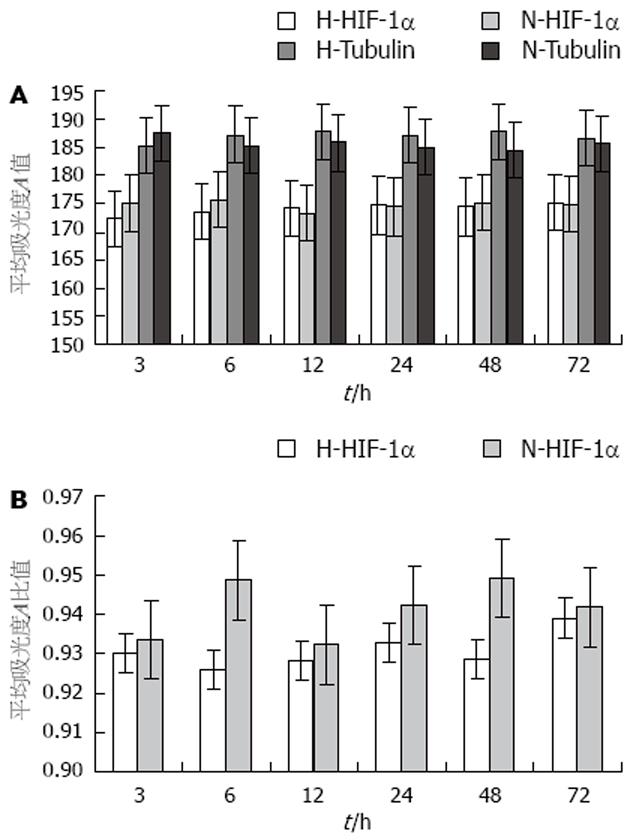
缺氧对HIF-1α活性的调节可以发生在转录、磷酸化、蛋白稳定等多个水平上. 我们的研究表明, 食管鳞癌EC-109细胞在缺氧状态下HIF-1α mRNA过表达, 但HIF-1α蛋白水平上调不明显, 提示其活性调节可能发生在转录水平(图2B, 3B). 这与有研究认为缺氧可上调HIF-1α转录水平[13]结果一致, 也有认为缺氧时HIF-1α的调节主要发生在蛋白而非转录水平[4,14-15]. 在缺氧及常氧状态下食管鳞癌EC-109细胞中HIF-1α蛋白均有磷酸化及非磷酸化两种形式存在. 最近的研究表明, HIF-1α的两种不同存在形式决定了他们的不同活性, 磷酸化的HIF-1α与b亚基结合, 而去磷酸化的HIF-1α与p53结合, 从而引起不同的效应[17]. 这也提示我们HIF-1α蛋白的活性调节可能与其空间构象而非蛋白表达量有关, 可能存在2条途径, 但这尚需大量的实验研究证实. 我们还观察到, 食管鳞癌EC-109细胞中HIF-1α水平随缺氧时间延长其表达上升, 在缺氧24 h时达高峰, 其后随缺氧时间延长表达下降(虽然mRNA明显过表达而蛋白水平无统计学意义), 这提示可能存在两种效应机制. 近来发现, 随缺氧严重程度的不同, HIF-1α具有促进凋亡和抗凋亡两种不同的效应. 细胞轻度缺氧时, HIF-1α能与b亚基结合, 通过活化其靶基因的转录, 降低bax/bcl-2比例, 降低caspase3活性等途径抑制细胞凋亡. 而细胞缺氧严重时, HIF-1α与p53结合, 使p53稳定并发挥促进细胞凋亡的效应; p53与HIF-1α结合后还能通过抑制HIF-1α对靶基因的转录激活及促进HIF-1α的蛋白酶性降解两种方式调节HIF-1α的表达[16].
总之, 缺氧状态下HIF-1α在食管鳞癌细胞EC-109中有过表达, 主要表现在转录水平; 提示HIF-1α可能与食管鳞癌EC-109细胞适应缺氧环境有关系; 蛋白水平的活性调节机制尚需进一步研究.
我国是食管癌高发区, 对人们健康构成极大威胁. 近年来学者对食管鳞癌进行了大量的基础研究, 我们进一步研究了体外培养食管鳞癌细胞EC-109中HIF-1a在缺氧状态下的表达及其意义.
国内外对食管鳞癌中HIF-1a的研究较少, 本实验在既往研究的基础上观察了缺氧状态下食管鳞癌细胞EC-109中HIF-1a的表达意义.
本文进一步研究了HIF-1a的表达意义, 对今后的研究有一定的借鉴作用.
本文题目切题, 研究背景与目的明确, 设计合理, 结论有一定科学意义. 文章的科学性、创新性和可读性能较好地反映我国或国际食管癌基础研究的先进水平.
电编: 张敏 编辑:潘伯荣
| 1. | 施 瑞华, 朱 宏, 张 国新, 凌 亭生, 郝 波, 王 红娣, 张 智弘, 张 伟明. 缺氧诱导因子1a、2a和血管内皮生长因子在食管鳞癌中的表达. 胃肠病学. 2004;9:335-339. |
| 2. | 朱 宏, 施 瑞华, 张 国新, 凌 亭生, 郝 波, 张 智弘, 张 伟明. 食管鳞癌发生过程中缺氧诱导因子1a和血管内皮生长因子的表达变化. 中华消化杂志. 2004;24:755-756. |
| 3. | 凌 亭生, 施 瑞华, 于 莲珍, 朱 宏, 张 国新, 郝 波. 缺氧诱导因子1a的多态性对食管鳞癌血管生成的影响. 南京医科大学学报(自然科学版). 2005;7:495-499. |
| 4. | 兰 梅, 时 永全, 魏 茂富, 王 淑兰, 韩 者艺, 潘 阳林, 王 晋, 乔 泰东, 樊 代明. 缺氧诱导因子HIF-1a在胃癌细胞系中的表达和意义. 现代肿瘤医学. 2005;13:21-23. |
| 5. | Fan LF, Diao LM, Jiang CQ, Tang ZJ, Xia D, Liu MQ, Liu ZS, Ai ZL. Expression and pathobiological implication of hypoxia-inducible factor-1alpha in human colorectal carcinoma. Zhonghua Binglixue Zazhi. 2004;33:242-246. [PubMed] |
| 6. | Mizukami Y, Li J, Zhang X, Zimmer MA, Iliopoulos O, Chung DC. Hypoxia-inducible factor-1-indepen-dent regulation of vascular endothelial growth factor by hypoxia in colon cancer. Cancer Res. 2004;64:1765-1772. [PubMed] [DOI] |
| 7. | Harris AL. Hypoxia-a key regulatory factor in tumour growth. Nat Rev Cancer. 2002;2:38-47. [PubMed] [DOI] |
| 8. | Ryan HE, Poloni M, McNulty W, Elson D, Gass-mann M, Arbeit JM, Johnson RS. Hypoxia-inducible factor-1alpha is a positive factor in solid tumor growth. Cancer Res. 2000;60:4010-4015. [PubMed] |
| 9. | Zhong H, De Marzo AM, Laughner E, Lim M, Hil-ton DA, Zagzag D, Buechler P, Isaacs WB, Semenza GL, Simons JW. Overexpression of hypoxia-induci-ble factor 1alpha in common human cancers and their metastases. Cancer Res. 1999;59:5830-5835. [PubMed] |
| 10. | Lando D, Peet DJ, Whelan DA, Gorman JJ, White-law ML. Asparagine hydroxylation of the HIF tran-sactivation domain a hypoxic switch. Science. 2002;295:858-861. [PubMed] [DOI] |
| 11. | Wang GL, Jiang BH, Rue EA, Semenza GL. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA. 1995;92:5510-5514. [PubMed] [DOI] |
| 12. | Sun X, Kanwar JR, Leung E, Lehnert K, Wang D, Krissansen GW. Gene transfer of antisense hypoxia inducible factor-1 alpha enhances the therapeutic efficacy of cancer immunotherapy. Gene Ther. 2001;8:638-645. [PubMed] [DOI] |
| 13. | Semenza GL. HIF-1: mediator of physiological and pathophysiological responses to hypoxia. J Appl Physiol. 2000;88:1474-1480. [PubMed] |
| 14. | Maxwell PH, Ratcliffe PJ. Oxygen sensors and angiogenesis. Semin Cell Dev Biol. 2002;13:29-37. [PubMed] [DOI] |
| 15. | Wenger RH, Kvietikova I, Rolfs A, Gassmann M, Marti HH. Hypoxia-inducible factor-1 alpha is regulated at the post-mRNA level. Kidney Int. 1997;51:560-563. [PubMed] [DOI] |
| 16. | Piret JP, Mottet D, Raes M, Michiels C. Is HIF-1alpha a pro- or an anti-apoptotic protein? Biochem Pharmacol. 2002;64:889-892. [PubMed] [DOI] |
| 17. | Suzuki H, Tomida A, Tsuruo T. Dephosphorylated hypoxia-inducible factor 1alpha as a mediator of p53-dependent apoptosis during hypoxia. Oncogene. 2001;20:5779-5788. [PubMed] [DOI] |
| 18. | Ling TS, Shi RH, Zhang GX, Zhu H, Yu LZ, Ding XF. Common single nucleotide polymorphism of hypoxia-inducible factor-1alpha and its impact on the clinicopathological features of esophageal squa-mous cell carcinoma. Chin J Dig Dis. 2005;6:155-158. [PubMed] [DOI] |
| 19. | Kondo Y, Hamada J, Kobayashi C, Nakamura R, Suzuki Y, Kimata R, Nishimura T, Kitagawa T, Kunimoto M, Imura N. Over expression of hypoxia-inducible factor-1alpha in renal and bladder cancer cells increases tumorigenic potency. J Urol. 2005;173:1762-1766. [PubMed] [DOI] |
| 20. | Yao K, Gietema JA, Shida S, Selvakumaran M, Fonrose X, Haas NB, Testa J, O'Dwyer PJ. In vitro hypoxia-conditioned colon cancer cell lines derived from HCT116 and HT29 exhibit altered apoptosis susceptibility and a more angiogenic profile in vivo. Br J Cancer. 2005;93:1356-1363. [PubMed] [DOI] |
| 21. | Jubb A, Hillan K. Expression of HIF-1 alpha in human tumours. J Clin Pathol. 2005;58:1344. [PubMed] |
| 22. | Griffiths EA, Pritchard SA, Welch IM, Price PM, West CM. Is the hypoxia-inducible factor pathway important in gastric cancer? Eur J Cancer. 2005;41:2792-2805. [PubMed] [DOI] |
| 23. | Yoshida D, Kim K, Yamazaki M, Teramoto A. Expression of hypoxia-inducible factor 1alpha and cathepsin D in pituitary adenomas. Endocr Pathol. 2005;16:123-131. [PubMed] [DOI] |
| 24. | Kim K, Yoshida D, Teramoto A. Expression of hypoxia-inducible factor 1alpha and vascular endo-thelial growth factor in pituitary adenomas. Endocr Pathol. 2005;16:115-121. [PubMed] [DOI] |
| 25. | Kuijper A, van der Groep P, van der Wall E, van Diest PJ. Expression of hypoxia-inducible factor 1 alpha and its downstream targets in fibroepithelial tumors of the breast. Breast Cancer Res. 2005;7:R808-R818. [PubMed] [DOI] |
| 26. | Palit V, Phillips RM, Puri R, Shah T, Bibby MC. Expression of HIF-1alpha and Glut-1 in human bladder cancer. Oncol Rep. 2005;14:909-913. [PubMed] |
| 27. | Zhu H, Chen XP, Luo SF, Guan J, Zhang WG, Zhang BX. Involvement of hypoxia-inducible factor-1-alpha in multidrug resistance induced by hypoxia in HepG2 cells. J Exp Clin Cancer Res. 2005;24:565-574. [PubMed] |
| 28. | Belozerov VE, Van Meir EG. Hypoxia inducible factor-1: a novel target for cancer therapy. Antican-cer Drugs. 2005;16:901-909. [PubMed] [DOI] |
| 29. | Kimura S, Kitadai Y, Kuwai T, Tanaka S, Hihara J, Yoshida K, Toge T, Chayama K. Expression of p53 protein in esophageal squamous cell carcinoma: relation to hypoxia-inducible factor-1alpha, angiog-enesis and apoptosis. Pathobiology. 2005;72:179-185. [PubMed] [DOI] |
| 30. | Maxwell PH. The HIF pathway in cancer. Semin Cell Dev Biol. 2005;16:523-530. [PubMed] [DOI] |