修回日期: 2006-02-10
接受日期: 2006-02-13
在线出版日期: 2006-05-08
我国具有庞大的乙型肝炎患者群, 同时又是药用植物资源十分丰富的国家. 从药用植物中筛选具有抗乙肝病毒(HBV)活性的天然目标化合物, 对以开发出抗病毒的高效价廉药物, 对控制乙肝流行具有非常重要的意义. 本文对近20年来药用植物的木脂素、多酚、生物碱、萜类、黄酮和香豆素类等70余个化学成分体外抗HBV活性的研究进展进行评述, 以供参考.
引文著录: 左国营, 刘树玲, 徐贵丽. 近20年来药用植物成分体外抗HBV活性的研究进展. 世界华人消化杂志 2006; 14(13): 1241-1246
Revised: February 10, 2006
Accepted: February 13, 2006
Published online: May 8, 2006
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2006; 14(13): 1241-1246
- URL: https://www.wjgnet.com/1009-3079/full/v14/i13/1241.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i13.1241
乙型肝炎病毒(HBV)感染是一个世界性的健康问题. 全球20亿人口受过HBV感染, 慢性患者达3.6亿, 每年死亡患者达52万(5万死于急性HBV患者, 47万死于肝硬化和肝癌). 我国HBV人群感染率57.6%, 乙肝表面抗原(HBsAg)阳性者9.75%, 全国现症慢性乙型肝炎(简称慢乙肝)约3000-4000万[1-2]. 抗病毒治疗是病毒性肝炎治疗的关键, 目前公认有效的抗病毒药物是干扰素和拉米夫定等化学合成的核苷类似物, 以核苷类似物为代表的这些合成抗病毒药的结构类型单一, 存在停药后复发率高, 对HBeAg作用不明显, 需长期用药致病毒耐受等问题; 以干扰素为代表的生物类药物治疗乙肝同样复发率较高、不良反应严重而且价格昂贵, 患者经济负担大, 临床难以广泛使用. 因此, 研发新型的抗HBV药物以治疗乙肝, 对传染源的控制及疾病的转归具有极其重要的社会意义和经济意义.
天然药物化合物库的分子结构多样性是找寻新药目标化学实体的源泉, 有多达40%的治疗药物源于传统药用植物等天然资源, 当前国际国内对传统天然药物在抗病毒研究上日趋重视[3-5]. 具有抗HBV作用的植物源天然产物包括木脂素、酚性成分、生物碱、萜类、黄酮和香豆素等类化合物(图1, 2). 针对我国庞大的HBV患者群和丰富的传统中草药植物资源的实际, 从其结构多样的天然化合物中找寻抗HBV潜在的有效目标化合物, 是新药研究工作者的一个重要的方向. 为此, 本文就近20年来药用植物体外抗HBV活性成分的研究进展进行归纳总结, 以供同行参考.
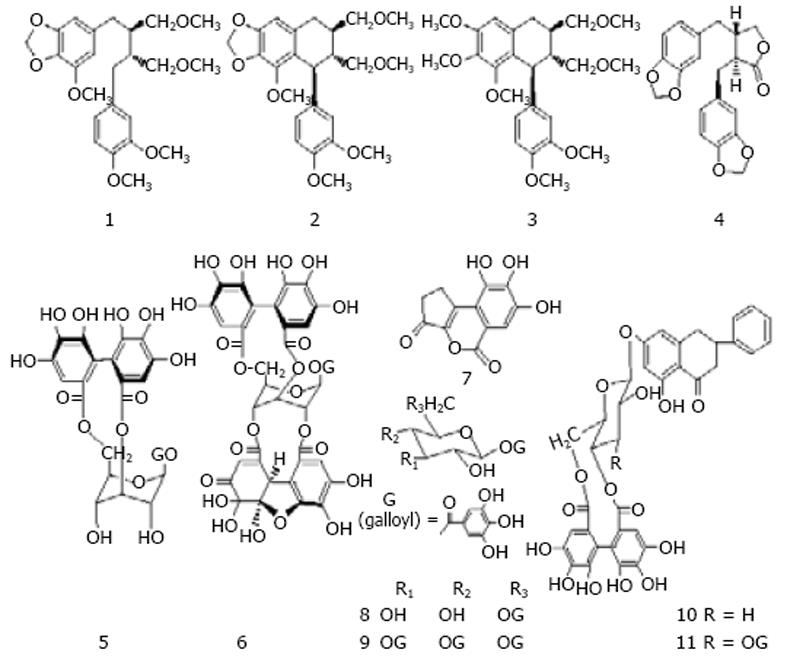
自从Thyagaraian et al[6]于1982年首次发现大戟科叶下珠属的苦味叶下珠(Phyllanthus urinaria)具有抗乙肝病毒的活性以后, 形成了一股叶下珠抗HBV研究的热潮. 可以说, 在中草药抗HBV的基础和临床应用研究方面, 国内外对叶下珠的研究是最为广泛、持久和深入的, 其提取物对多种HBV指标均呈现一定的抑制作用. 研究表明, 叶下珠属植物中所含有的木脂素等多酚类化学成分是其抗HBV活性的关键组分. Huang et al[7]筛选了得自4种叶下珠属植物的25个化合物(其中大部分是多酚类化合物)对人肝癌细胞株MS-G2分泌的HBV抗原HBsAg、HBeAg的抑制作用, 发现在50 μmol/L时, 3, 4-亚甲二氧基-3', 4', 5, 9, 9'-五甲氧基木脂素(niranthin, 1)具有最强的抗HBsAg活性(抑制率: 74.3%); 3, 4∶3', 4'-双亚甲二氧基木脂素(hinokinin, 2)具有最强抗HBeAg活性(抑制率: 68.1%)(图1和表1). 但认为其中的黄酮类、糅花酸和短叶苏木酚酸甲酯对两类抗原均无抑制作用.
Kuo et al[8]测定了日本南五味子(Kadsura japonica)中6种新的C18环辛二烯木脂素(C18-dibenzocycloocta-dienelignans)schizanrins I, J, K, L, M, N和4种已知C19均木脂素(C19 homolignans)taiwanschirins A, B, C和heteroclitin F对HBV抗原的抑制作用. 结果表明taiwanschirins A(12)和B(13)在25 mg/L时对HBsAg具有强抑制作用(抑制率分别为: 52.8%和50.9%), 对HBeAg具中等强度抑制作用(抑制率分别为: 42.8%和31.8%). 初步构效关系研究发现在C9位上无取代基的化合物对HBV呈现抑制作用, 而C9位上有取代基的化合物对HBV无抑制作用.
Huang et al[9]测定了胡椒属植物风藤(Piper kadsura)中7种化合物对MS-G2分泌HBV抗原的抑制率为57.8%-76.0%[HBsAg, 以meso-galgravin(14)最大]和6.8%-33.9%[HBeAg, 以(-)-galbelgin(15)最大]. 同时发现futoquinol(16)、(-)-galbelgin和meso-galgravin在浓度为25 μmol/L 时, 能有效抑制HBV表面抗原和e-抗原的产生, piperenone(17)仅在高浓度(50 μmol/L)时抑制e-抗原的产生.
Shin et al[10]研究发现, 从叶下珠中得到的糅花酸(ellagic acid, 18)在体外能有效阻断HepG2.2.15细胞的HBeAg的分泌, IC50为0.07 μg/mL, 但是对HBsAg和HBV DNA聚合酶无效. 仲英 et al[11]从叶下珠中分离出的多酚类成分去氢诃子次酸甲酯(19)和短叶苏木酚酸甲酯(20)具有抗HBsAg活性. 孔庚星 et al[12]报道青果中的没食子酸(21)是抗HBsAg、HBeAg成分之一. 李荣芷 et al[13]经特异免疫沉淀法和对2.2.15细胞株的HBsAg, HBeAg的抑制实验, 以阿糖腺苷为阳性对照, 从104种中草药中优选出单味中药 (912)对HBV DNA、HBsAg和HBeAg抑制率高达90%左右, 并认为其抗HBV活性与多元酚(鞣质)密切相关.
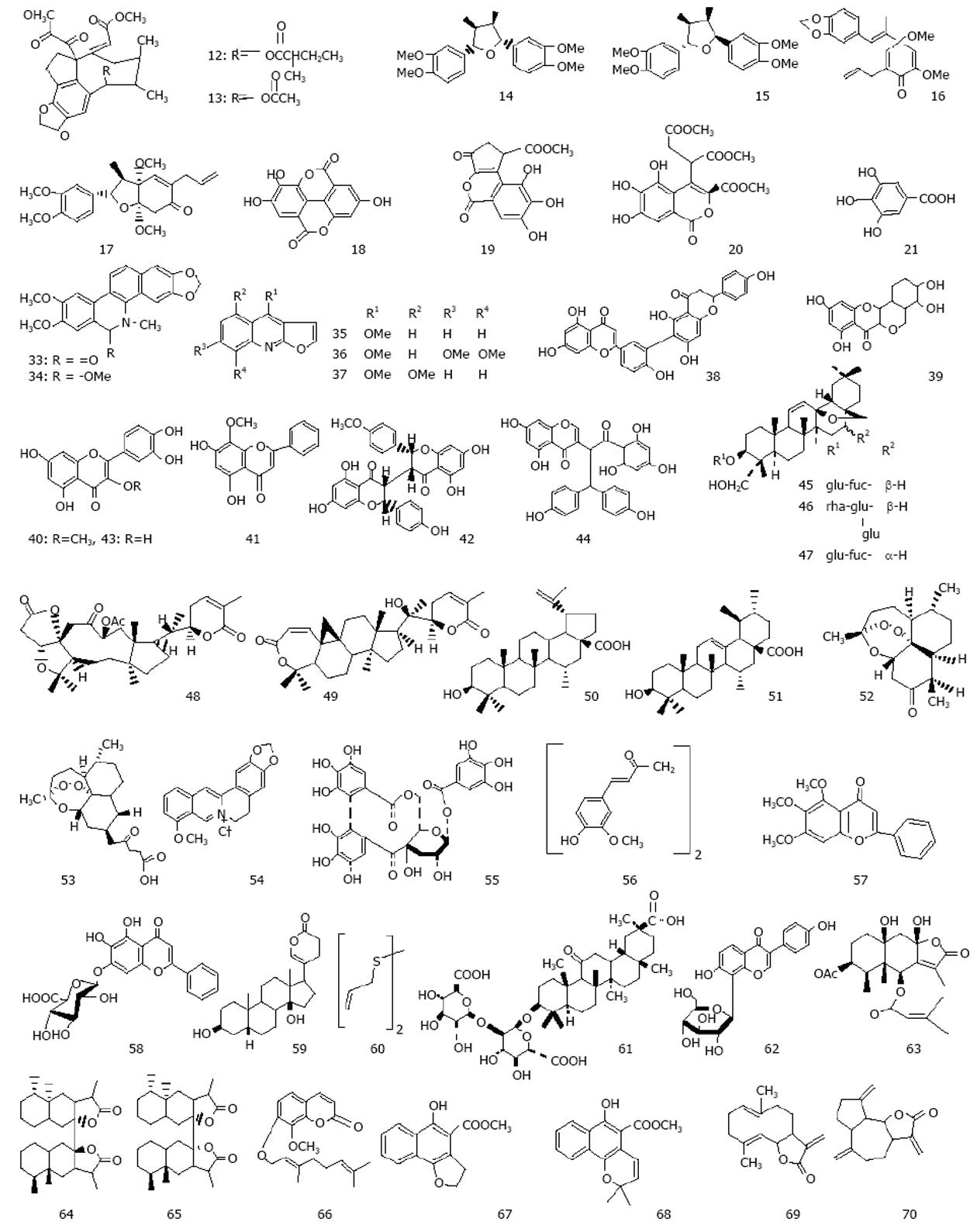
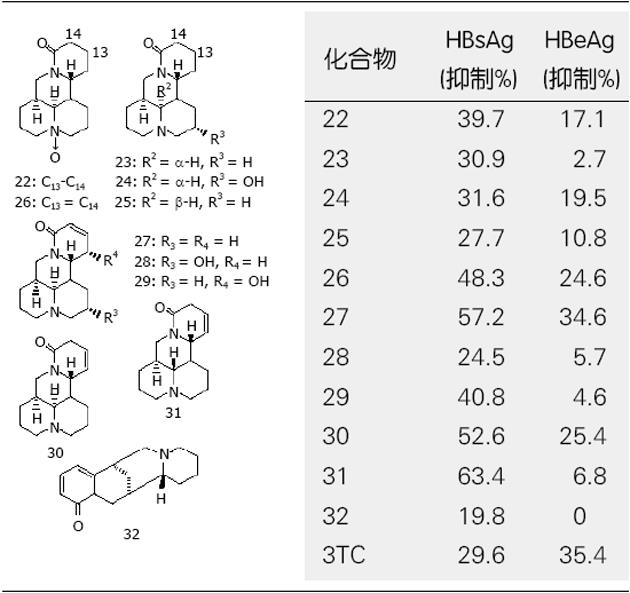
我国科学家对中药苦参(Sophora flavescens Ait)治疗乙肝的基础和临床进行了大量的研究工作, 已经开发有相关制剂. 新近Ding et al[14]比较研究了包括氧化苦参碱(oxymatrine, 22)等11种苦参生物碱, 即苦参碱[(+)-matrine (23)], (+)-9α-羟基苦参碱[(+)-9α-hydroxymatrine(24)], 别苦参[(+)-allomatrine (25)], (+)-氧化槐果碱[(+)-oxysophocarpine (26)], (-)-槐果碱[(-)-sophocarpine (27)], (-)-9α-羟基槐果碱[(-)-9α-hydroxysophocarpine (28)], (+)-12α-羟基槐果[(+)-12α-hydroxysophocarpine (29)], (+)-lehmannine (30), (-)-13, 14-去氢槐果碱[(-)-13, 14-dehydrosophoridine(31)]和(-)-anagyrine (32)的体外抗HBV活性. 在0.2 μmol/L时, 化合物26, 27, 30, 31具有明显的抗HBV活性, 对HBV表面抗原(HBsAg)分泌的抑制强度为48.3%-63.4%, 对e-抗原(HBeAg)分泌的抑制强度为24.6%-34.6%. 这些化合物的活性多强于拉米夫啶(3TC), 并讨论了其构效关系. 研究发现化合物26-27和29-31的抗HBsAg活性(0.2 μmol/mL)比现用的苦参碱和氧化苦参碱强的多(图3). Chang et al[15]从Zanthoxylum schinifolium中得到的oxynitidine (33)的HBID50为30.8 μg/mL.
杨国红[16]测定了两面针中的异喹宁生物碱6-甲氧基-5, 6-二氢两面针碱(6-methoxy-5, 6-dihydro-nitidine, 34)和三种呋喹宁生物碱白藓碱(dictamnine, 35)、茵芋碱(skimmianine, 36)、5-甲氧基-白藓碱(5-methoxy-dictamnine, 37)的抗HBV活性, 其中HBsAg的抑制率在18.6%-49.3%, HBeAg的抑制率在6.81%-43.2%, 以5-甲氧基-白藓碱(5-methoxy-dictamnine)的活性最大, 母核上甲氧基的位置和个数对活性有较大影响.
Zembower et al[17]发现自漆树科野漆(Rhus succedameu)分离得到的双黄酮(Robustatlavone, 38)具有强烈抑制HBV DNA复制作用, 其半数有效浓度为(EC50)0.25 μmol/L, 选择性指数(SI, IC50/EC50)153. 其六醋酸酯的EC50为0.73 μmol/L. 与拉米夫定(lamivudine, 3TC)和喷昔洛韦(penciclovir)具有明显协同抗HBV作用. 由Lin et al[18]得自Ophioglossum petiolatum的黄酮类化合物Ophioglonol (39)和槲皮素-3-O-甲醚(40)在25 μmol/L时具有轻微抑制MS-G2肝癌细胞HBsAg的作用(抑制率在25%-35%之间). Huang et al[19]通过测定对该细胞的HBV DNA聚合酶的作用, 认为黄芩(Scutellaria baicalensis)中的汉黄芩素(wogonin, 41)能抑制HBsAg.
杨国红[16]测定了瑞香狼毒(Stellera chamae-jasme)中的黄酮类化合物雁皮素A(sikokianin, 42)、槲皮素(quercetin, 43)和狼毒色原酮 (chamaechromone, 44)对HepG2 2.2.15细胞分泌的HBsAg的抑制率较高, 分别为71.9%、64.3%、34.0%(3TC为29.6%), 但是对HBeAg的抑制率较低, 其中雁皮素无作用, 后二者分别25.8%和5.84%(3TC为35.4%).
1.4.1 皂苷(saponins): Chiang et al[20]测定了柴胡属(Bupleurum)植物的柴胡皂苷a(45), c(46)和d(47)的细胞毒及其抗HBV活性. 除a、d外, c具有明显减低HBeAg的作用, c还能抑制HBV DNA的复制, 其作用与细胞毒无关; d虽有细胞毒作用, 但是不能抑制HBV DNA的复制, 所以, c具有抗HBV作用而d具有强烈细胞毒作用. 考察三种皂苷的结构发现, 在D-环上的羟基为反式者(d)具有细胞毒作用, 而抗HBV活性与连在A-环上的糖链结构有关. 蔡光明 et al[21]研究表明, 鹅绒委陵菜总皂苷具有明显抑制HBsAg、HBeAg和HBV DNA作用. 高士奇 et al[22]用丁香总皂苷作用于2.2.15细胞, 发现对分泌的HBsAg和HBeAg有抑制作用. 刘厚佳[23]测得齐墩果酸对HBsAg、HBeAg(80 mg/L)和HBV DNA(20 mg/L)的抑制率分别为47.7%、15.6%和29.3%.
1.4.2 三萜及三萜内酯: Shen et al[24]测定了kadsu-philactone A(48)和B(49)的细胞毒和抗HBV作用. 体外B抑制HBsAg的IC50是6 mg/L. 陈斌[25]测定了白桦脂酸(50)和熊果酸(51)对HepG细胞分泌HBV抗原在浓度为0.0125 mmol/L时的抑制率分别为47.0%和39.9%.
1.4.3 二萜和倍半萜: 朱宇同 et al[26]研究指出对得自云南红豆杉(Taxus yunnanensis)的紫杉烷二萜类化合物TD-1在体内外具有抑制HBsAg作用(IC50为4.24 mg/L), 但对HBeAg无效.
Romero et al[27]考察了得自传统中药青蒿中青蒿素(artemisinin, 52)、其衍生物(artesunate, 53)和包括上述多种结构类型的中药成分对HBV的抗病毒活性. 将药物(0.01-100 μmol/L)与转染细胞HepG2 2.2.15接触21 d后, 测定了该细胞产生的HBV标志物HBsAg、HBV DNA和药物对寄主细胞的毒性. 结果分为(1)无效: 即药物对病毒产生无效, 包括(daidzein, daidzin, isonardosinon, nardofuran, nardosinon, tetrahydronardosinon和quercetin); (2)低效: 能明显减低病毒产生, 但是对寄主有细胞毒作用, 包括小檗碱(berberine, 54)和单宁酸(tannic acid, 55)或是对寄主无细胞毒作用但对病毒产生有中等效果(curcumin, baicalein, baicalin, bufalin, diallyl disulphide, glycyrrhizic acid和puerarin, 56-63); (3)高效: 对寄主无细胞毒浓度下能对病毒产生强抑制效果(artemisinin和artesunate). 另外, artesunate与拉米夫啶(lamivudine)合用有协同抗HBV作用. Li et al[28]从千里光属植物Senecio tsoongianus中分离得到的倍半萜内酯(64-66)在浓度为250 μmol/L以上有抑制HBsAg、HBeAg的作用, 结果还提示与其他抗病毒药有协同作用.
Chang et al[15]测定了花椒属植物Zanthoxylum schinifolium中的萜基取代香豆素collinin(67)的抗HBV活性, 其对HBV DNA复制的50%抑制率(HBID50)为17.1 mg/L.
Ho et al[29]得自钩毛茜草(Rubia cordifolia)根的两个萘氢醌类成分furomollugin (68), mollugin(69)对人肝癌Hep3B细胞分泌的HBsAg具有强抑制活性, 其IC50均为2.0 mg/L, 且只有轻微细胞毒性. 构效关系揭示C6位羟基及呋喃或吡喃环与抑制活性有关. Chen et al[30]得自凤毛菊属植物(Saussurea lappa)根中的两个内酯成分costunolide(70)和dehydrocostus lactone(71)对Hep3B细胞的HBsAg有抑制而细胞毒轻微, 其IC50分别为1.0和2.0 μmol/L. 刘厚佳 et al[31]测定了原儿茶酸对HBsAg、HBeAg和HBV DNA的抑制率(70 μg/mL)分别为38.2%、47.2%和46.5%. 一些植物多糖的抗HBV活性也有过报道.
虽然早在1980年初就有印度学者报道植物药叶下珠的抗HBV作用, 但其后的10余年抗HBV植物药成分的筛选并未有多大进展, 这可能与研究者对于抗爱滋病毒HIV药物的研究更为重视有关, 也可能是由于缺乏可行的活性筛选模型. 如Perez总结了1950-2000 40年植物抗病毒活性成分共344种, 其中多数为抑制HIV成分, 仅有wogonin等少数成分涉及肝炎病毒[32]. 自1990年代初开始, 国内郑明实 et al率先将2.2.15细胞模型用于对我国中草药提取物的广泛筛选, 其后的近10年来, 特别是进入新世纪后, 我国学者的抗HBV天然药物活性成分研究取得了可喜的进步. 尽管如此, 药用植物抗HBV作用的基础与临床研究的广度和深度还远远不够, 我国1万多种药用植物中仅对少数品种如叶下珠、水飞蓟(Silybum mrianum)、苦参、甘草(Glycyrrhiza glabra)、柴胡、绿茶(Camellia siniesis)等作过系统的研究[33-34]. 充分应用植物化学技术, 并结合植物化学分类学的观点和现代生物技术, 研究新型筛选模型, 从植物次生代谢产物中筛选高效、低毒的抗HBV活性成分、扩大药源, 其前景是非常广阔的.
由上述可见, 与目前临床上所用的以核苷类似物为主的单一抗病毒药物结构类型相比, 业已证明常见结构类型的药用植物次生代谢产物都具有抗HBV活性. 从体外筛选方法来看, 肝癌转染细胞系HepG 2.2.15细胞由于具有稳定分泌HBV颗粒的特性而被广泛采用. HBV感染的源头(表面抗原和e-抗原)就存在于病毒颗粒中, 所以, 研究能清除HBV抗原的有效药物就显得至关重要. 与其他病毒一样, HBV没有独立的细胞结构, 其在宿主体内的复制需要借助宿主细胞才能完成. 植物药有效成分抗HBV的实用价值必须首先排除对宿主的细胞毒性. 上述各类抗HBV活性成分均没有细胞毒性或毒性轻微. 考虑到病毒生长复制的一些共同特征, 借鉴抑制HIV等其他病毒活性成分研究的成果, 有助于筛选抗HBV活性目标化合物和开发新的治疗药物. 如最初以抑制HIV逆转录酶为目的的拉米夫定, 后来发现对HBV逆转录酶更为有效并成为治疗乙肝的药物.
除抑制HBV抗原外, 植物药抗HBV的机制还有抑制HBV DNA聚合酶、抑制HBV DNA等. HBV感染宿主细胞主要经过吸附、穿入、脱壳、基因及蛋白的复制、装配和释放等过程, 理论上凡能阻断这些过程中任何一个环节, 均具有抗HBV作用[35]. 另外, 针对共价闭合环状DNA(cccDNA) 的目标化合物的发现将有利于克服当前抗HBV药物的耐药性, 减少复发. 药用植物复杂而特殊的化学成分使其除了对HBV直接的抑制作用外,还能对HBV感染后导致的肝脏功能和器质性病变有多重作用, 如调节机体免疫功能、保肝降酶、抑制肝纤维化、抗氧化和清除自由基等. 上述成分类别中的皂苷、生物碱、黄酮、木脂素和多酚等成分均具有此作用[36]. Liu et al[37]认为传统中药的许多生物活性与其中存在的皂苷和多酚类成分有很大关系, 其抗HBV作用也不例外. 植物抗HBV活性成分与化学合成抗HBV药物的协同作用也为中西药联合治疗乙肝提供了依据, 这有助于克服西药副作用大、机制单一和耐药性的缺点. 由于生物种属差异和机体内环境的复杂性, 体外抗病毒有效的活性成分在体内作用也存在各种差异, 同时, 单一植物成分的提取分离工艺复杂、提纯量有限, 造成体外筛选的有效成分进行体内验证的困难. 探索新的高效提取分离方法, 研究有效成分组如总皂苷、总黄酮、总生物碱、总木脂素及研究高活性成分的化学合成与结构改造等, 加强抗HBV体内外研究的结合, 将更利于植物抗HBV活性成分的开发利用.
经过自然界漫长的生存竞争, 作为一种特殊的病原体, 虽然HBV巧妙地寄生于人体肝细胞, 给人类健康带来了棘手的难题. 但是, 大自然同时也赋予人类抵抗HBV有用的药用植物资源. 充分重视植物次生代谢产物抑制HBV的基础与临床研究, 从药用植物中获取抗病毒有效成分并开发抗HBV药物, 其前途应该是可行的和乐观的.
针对当前乙型病毒性肝炎的流行趋势, 借鉴和应用抗病毒化学和生物学研究的成果, 加强抗乙肝病毒天然有效成分的筛选, 开发抗乙肝天然药物, 是当前药物化学工作者的一项重要任务.
抗病毒治疗是控制乙肝感染的关键, 寻找抑制乙肝抗原的特异天然活性先导化合物, 深入研究其抗病毒作用的分子机制, 可弥补化学合成药物结构单一的不足并克服其耐药性弊端.
当前国际我国对传统天然药物在抗病毒研究上日趋重视, 本文较新, 有意义.
电编: 张敏 编辑:张海宁
| 1. | EASL International Consensus Conference on Hepatitis B. 13-14 September, 2002: Geneva, Switzerland. Consensus statement (short version). J Hepatol. 2003;38:533-540. [PubMed] |
| 3. | Fabricant DS, Farnsworth NR. The value of plants used in traditional medicine for drug discovery. Environ Health Perspect. 2001;109 Suppl 1:69-75. [PubMed] [DOI] |
| 4. | Jassim SAA, Naji MA. Novel antiviral agents: a medicinal plant perspective. J Appl Microb. 2003;95:412-427. [DOI] |
| 6. | Thyagarajan SP, Thiruneelakantan K, Subramanian S, Sundaravelu T. In vitro inactivation of HBsAg by Eclipta alba Hassk and Phyllanthus niruri Linn. Indian J Med Res. 1982;76 Suppl:124-130. [PubMed] |
| 7. | Huang RL, Huang YL, Ou JC, Chen CC, Hsu FL, Chang C. Screening of 25 compounds isolated from Phyllanthus species for anti-human hepatitis B virus in vitro. Phytother Res. 2003;17:449-453. [PubMed] [DOI] |
| 8. | Kuo YH, Wu MD, Huang RL, Kuo LM, Hsu YW, Liaw CC, Hung CC, Shen YC, Ong CW. Antihepa-titis activity (anti-HBsAg and anti-HBeAg) of C19 homolignans and six novel C18 dibenzocyclooc-tadiene lignans from Kadsura japonica. Planta Med. 2005;71:646-653. [PubMed] [DOI] |
| 9. | Huang RL, Chen CF, Feng HY, Lin LC, Chou CJ. Anti-hepatitis B virus of seven compounds isolated from piper kadsura (choisy) ohwi. J Chin Med. 2001;12:179-190. |
| 10. | Shin MS, Kang EH, Lee YI. A flavonoid from medicinal plants blocks hepatitis B virus-e antigen secretion in HBV-infected hepatocytes. Antiviral Res. 2005;67:163-168. [PubMed] [DOI] |
| 11. | 仲 英, 左 春旭, 李 风琴, 丁 杏苞, 姚 庆强, 吴 克霞, 张 琴冈, 王 志玉, 周 玲, 王 菊. 叶下珠化学成分及其抗乙肝病毒活性的研究. 中国中药杂志. 1998;23:363-364. |
| 12. | 孔 庚星, 张 鑫, 陈 楚城, 段 文军, 夏 志祥, 郑 民实. 青果中抗HBsAg/HBeAg成分的研究. 解放军医学高等专科学校学报. 1998;26:5-7. |
| 14. | Ding PL, Liao ZX, Huang H, Zhou P, Chen DF. (+)-12alpha-Hydroxysophocarpine, a new quinoli-zidine alkaloid and related anti-HBV alkaloids from Sophora flavescens. Bioorg Med Chem Lett. 2006;16:1231-1235. [PubMed] [DOI] |
| 15. | Chang CT, Doong SL, Tsai IL, Chen IS. Coumarins and anti-HBV constituents from zanthoxylum schinifolium. Phytochemistry. 1997;45:1419-1422. [DOI] |
| 16. | 杨 国红. 瑞香狼毒等三种药用植物的生物活性成分. 复旦大学博士学位论文. 2005;81-84. |
| 17. | Zembower DE, Lin YM, Flavin MT, Chen FC, Korba BE. Robustaflavone, a potential non-nucleoside anti-hepatitis B agent. Antiviral Res. 1998;39:81-88. [PubMed] [DOI] |
| 18. | Lin YL, Shen CC, Huang YJ, Chang YY. Homofla-vonoids from Ophioglossum petiolatum. J Nat Prod. 2005;68:381-384. [PubMed] [DOI] |
| 19. | Huang RL, Chen CC, Huang HL, Chang CG, Chen CF, Chang C, Hsieh MT. Anti-hepatitis B virus effects of wogonin isolated from Scutellaria baicalensis. Planta Med. 2000;66:694-698. [PubMed] [DOI] |
| 20. | Chiang LC, Ng LT, Liu LT, Shieh DE, Lin CC. Cytotoxicity and anti-hepatitis B virus activities of saikosaponins from Bupleurum species. Planta Med. 2003;69:705-709. [PubMed] [DOI] |
| 21. | 蔡 光明, 赵 燕玲, 袁 海龙, 张 新全, 刘 峰群, 贺 承山, 汤 春玲, 李 壮. 鹅绒委陵菜有效部位(总皂苷)的分离与抗鸭乙肝病毒(DHBV-DNA)作用. 中南药学. 2003;1:17-21. |
| 24. | Shen YC, Lin YC, Chiang MY, Yeh SF, Cheng YB, Liao CC. Kadsuphilactones A and B, Two Novel Triterpene Dilactones from Kadsura philippinensis. Org Lett. 2005;7:5348. [PubMed] [DOI] |
| 25. | 陈 斌. 蓝桉果实活性成分的研究. 第二军医大学博士学位论文. 2002;65-66. |
| 26. | 朱 宇同, 胡 英杰, 邓 学龙, 刘 妮, 沈 小玲, 方 宏勋, 容 秉培, 王 新华, 郭 兴伯, 李 国桥. 紫杉烷二萜化合物抗乙型肝炎病毒作用的实验研究. 中华医学杂志. 1999;79:384-385. |
| 27. | Romero MR, Efferth T, Serrano MA, Castano B, Macias RI, Briz O, Marin JJ. Effect of artemisinin/artesunate as inhibitors of hepatitis B virus production in an "in vitro" replicative system. Antiviral Res. 2005;68:75-83. [PubMed] [DOI] |
| 28. | Li HB, Zhou CX, Zhou LF, Chen Z, Yang LX, Bai H, Wu XM, Peng H, Zhao Y. In vitro antiviral activity of three enantiomeric sesquiterpene lactones from Senecio species against hepatitis B virus. Antiviral Chem Chemother. 2005;16:277-282. [DOI] |
| 29. | Ho LK, Don MJ, Chen HC, Yeh SF, Chen JM. Inhibi-tion of hepatitis B surface antigen secretion on human hepatoma cells. Components from Rubia cordifolia. J Nat Prod. 1996;59:330-333. [PubMed] [DOI] |
| 30. | Chen HC, Chou CK, Lee SD, Wang JC, Yeh SF. Active compounds from Saussurea lappa Clarks that suppress hepatitis B virus surface antigen gene expression in human hepatoma cells. Antiviral Res. 1995;27:99-109. [PubMed] [DOI] |
| 32. | Perez GRM. Antiviral activity of compounds isolated from plants. Pharm Biol. 2003;41:107-157. [DOI] |
| 33. | Luper SND. A review of plants used in the treat-ment of liver disease: part 1. Altern Med Rev. 1998;3:410-421. |
| 34. | Luper SND. A review of plants used in the treat-ment of liver disease: part two. Altern Med Rev. 1999;4:178-189. |
| 36. | 程 书权, 孔 淑敏. 中草药活性成分治疗慢性肝病的现代研究. 国外医学中医中药分册. 2004;26:209-213. |
| 37. | Liu J, Henkel T. Traditional Chinese medicine (TCM): are polyphenols and saponins the key ingredients triggering biological activities? Curr Med Chem. 2002;9:1483-1485. [PubMed] [DOI] |