修回日期: 2006-03-01
接受日期: 2006-03-20
在线出版日期: 2006-04-28
目的: 探讨大肠癌中TP和DPD的表达与临床病理特征的关系.
方法: 采用ELISA和免疫组织化学技术检测54例大肠癌肿瘤及邻近正常组织中TP和DPD的表达, 比较酶表达水平与临床病理特征之间的关系.
结果: 大肠癌肿瘤组织中TP含量显著高于正常组织(1026±492 vs 387±226 μkat/g protein, P<0.01), DPD蛋白含量在肿瘤与正常组织间无显著差别(P = 0.510); TP表达与淋巴结转移程度(P = 0.003)和Dukes分期(P = 0.026)密切相关, 而DPD在男性患者(P = 0.023)、有黏液腺癌成分者偏高(P = 0.013). 免疫组化检测大肠癌组织中TP表达阳性率为53.7%(29/54), DPD阳性率为44.4%(24/54); TP倾向表达于有淋巴结转移(P = 0.016)和Dukes分期较晚(P = 0.075)的病例中, DPD表达与性别关系显著(P = 0.044).
结论: 大肠癌肿瘤组织中TP水平显著高于正常组织, 与临床分期密切相关, 而DPD水平在肿瘤与正常组织间无明显差异, 女性患者的DPD表达水平低于男性.
引文著录: 马韬, 叶正宝, 纪玉宝, 刘炳亚, 朱正纲, 尹浩然, 林言箴. 大肠癌TP及DPD表达与临床特征的关系. 世界华人消化杂志 2006; 14(12): 1183-1187
Revised: March 1, 2006
Accepted: March 20, 2006
Published online: April 28, 2006
AIM: To investigate the expression levels and their clinical significances of thymidine phosphorylase (TP) and dihydropyrimidine dehydrogenase (DPD) in colorectal carcinoma.
METHODS: Enzyme linked immunosorbent assay (ELISA) and immunohistochemistry were used to detect the expression of TP and DPD protein in 54 cases of colorectal carcinoma and the corresponding cancer-adjacent tissues, and the correlations between TP/DPD expression and clinicopathological features were statistically analyzed.
RESULTS: The level of TP expression was significantly higher in cancer tissues than that in cancer-adjacent tissues (1026 ± 492 vs 387 ± 226 μkat/g protein, P < 0.01), but DPD expression was not markedly different between cancer and cancer-adjacent tissues (P = 0.510). ELISA showed that TP contents were correlated with lymph node metastasis (P = 0.003) and Dukes stages (P = 0.026), whereas DPD tended to be highly expressed in males (P = 0.023) and mucinous adenocarcinoma (P = 0.013). Immunohistochemistry showed that the positive rates of TP and DPD expression were 53.70%(29/54) and 44.44%(24/54), respectively, in colorectal carcinoma and TP seemed to be highly expressed in patients with lymph node metastasis (P = 0.016) and late Dukes stages (P = 0.075), while DPD expression had significant correlation with the gender (P = 0.044).
CONCLUSION: TP level is higher in colorectal cancer tissues than that in normal ones and it is correlated with clinical staging. DPD level has no difference between colorectal cancer tissues and normal tissues, but it is highly expressed in males.
- Citation: Ma T, Ye ZB, Ji YB, Liu BY, Zhu ZG, Yin HR, Lin YZ. Expression and clinical significance of thymidine phosphorylase and dihydropyrimidine dehydrogenase in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(12): 1183-1187
- URL: https://www.wjgnet.com/1009-3079/full/v14/i12/1183.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i12.1183
化学治疗是大肠癌综合治疗的重要组成部分, 但长期以来, 其治疗效果却备受质疑. 绝大多数化疗药物单药治疗的疗效不超过20%, 其中, 5-FU是治疗大肠癌的首选和基本用药, 近年随着亚甲基四氢叶酸(leucovorin, LV)等生化调节剂的应用, 使用小型化疗泵静脉持续灌注的开展, capecitabine, S-1等口服氟尿嘧啶制剂的推出, 以草酸铂、伊立替康等新药为组成部分的强效化疗方案FOLFOX与FOLFIRI的临床实践, 5-FU的临床地位愈发重要[1-4]. 但5-FU的疗效和毒副反应不够稳定, 个体间差异很大, 寻求该药敏感性的预测指标, 将有利于临床个体化治疗的开展. 有研究显示, 肿瘤内氟尿嘧啶类药物代谢酶水平是决定5-FU化疗有效性的重要因素[5-6]. 我们检测了5-FU代谢途径中的关键酶, 胸苷磷酸化酶(thymidine phosphorylase, TP)和二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPD)在大肠癌组织中的表达情况, 并探讨上述指标与临床病理学特征的关系.
2002-07/2004-01手术切除证实的大肠癌54例, 术前未经放化疗. 男37例, 女17例, 中位年龄59(30-85)岁; 右半结肠癌10例(盲肠、升结肠和横结肠中动脉以右部分), 左半结肠癌14例(乙状结肠、降结肠和横结肠中动脉以左部分), 直肠癌30例; Dukes A期13例, B期21例, C期16例, D期4例. 标本离体后立即取材, 选取肿瘤边缘生长活跃、无坏死的部分, 同时取距肿瘤边缘5 cm以上的远切端正常组织作为对照, 储存于-80 ℃, 留作抽提蛋白质; 另一部分置于40 g/L甲醛缓冲液内固定, 石蜡包埋备用. 小鼠抗人TP mAb(迈新, 福州), 工作浓度1:100; 大鼠抗人DPD mAb(Roche, Germany), 工作浓度1:200; 兔抗大鼠连接抗体(Dako, Denmark), 工作浓度1:100; Envision两步法试剂(Dako, Denmark).
1.2.1 ELISA检测TP/DPD酶水平: 高速匀浆器将组织充分匀浆, 4 ℃, 25000 r/min高速离心1 h, 吸取上清, BCA法测定总蛋白浓度. 双抗体夹心ELISA(Roche, Germany)严格按照说明书操作, 以TP和DPD的蛋白含量代表酶水平, 用每g总蛋白所含酶活性单位数(kat/g protein)表示: 每16.67 nkat/g protein TP等价于1 h内催化产生1 μg 5-FU所需的量, 而16.67 nkat/g protein DPD相当于每分钟分解1 pmol 5-FU所需的量. 设2复孔, 取平均值.
1.2.2 免疫组织化学: 石蜡包埋的组织4 μm连续切片; 二甲苯脱蜡, 乙醇逐级水化; 30 mL/L H2O2甲醇室温下作用30 min, 以阻断内源性过氧化物酶活性; EDTA缓冲液抗原修复; 正常羊血清室温下封闭20 min; 一抗4 ℃孵育过夜; PBS冲洗后, 加入Envision二抗室温下孵育30 min(为检测DPD, 尚需连接抗体37 ℃先行孵育30 min); DAB光镜控制下显色, 苏木素复染和封片. 随机选取5个高倍视野(200×)计数1000个细胞, 参考染色肿瘤细胞百分比的均数判断是否阳性表达. TP以染色肿瘤细胞数超过10%以上为阳性, DPD则以染色肿瘤细胞数超过20%以上者为阳性.
统计学处理 采用SPSS11.0软件, 组间比较采用Wilcoxon检验及Kruskal-Wallis检验, 率的比较使用卡方检验或Fisher确切概率法, 相关性分析采用Spearman检验. P<0.05认为差别具有统计学意义.
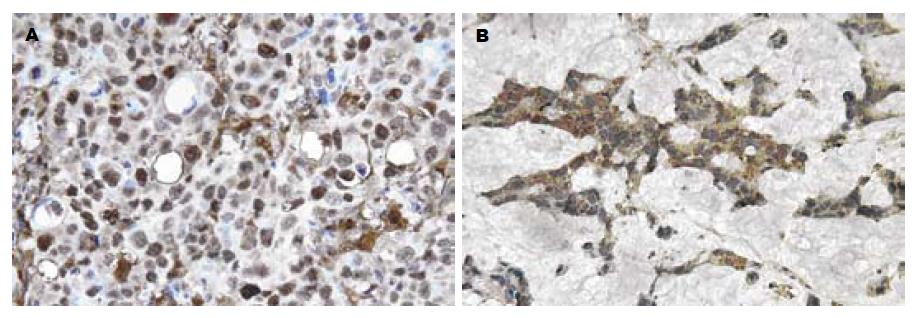
肿瘤组织中TP酶活性为1026±492 μkat/g protein(172-2292, 中位数1043), 明显高于对应正常组织的387±226 μkat/g protein(49-966, 中位数391), 差别具有高度统计学意义(P<0.01); 而肿瘤和正常组织中的DPD酶活性分别为215±95 μkat/g protein(58-522, 中位数196)和202±93 μkat/g protein(47-564, 中位数174), 差别无统计学意义(P = 0.510). TP表达阳性率为53.7% (29/54), 肿瘤细胞的胞质和胞核中均阳性表达(图1A), 也强表达于间质的单个核细胞中, 正常肠黏膜细胞未见表达; DPD阳性率为44.4% (24/54), 表达于肿瘤细胞的胞质中, 细胞核内无表达(图1B), 正常肠黏膜细胞也有少量呈阳性染色.
TP酶的活性与淋巴结转移程度(P = 0.003)和Dukes分期(P = 0.026)密切相关, 有淋巴结转移或Dukes分期晚者, TP蛋白表达水平也高; 而DPD表达与性别(P = 0.023)和肿瘤内有无黏液腺癌成分(P = 0.013)有关, 表现为女性患者偏低、病理学检查发现肿瘤组织内有黏液腺癌成分者表达含量高, 免疫组化与ELISA结果相仿, TP倾向表达于有淋巴结转移(P = 0.016)和Dukes分期较晚(P = 0.075)的病例中, 而与性别、年龄、肿瘤部位及大小, 有无黏液成分等无关; 女性患者DPD表达偏低(P = 0.044), 具有黏液腺癌成分的肠癌患者DPD阳性表达率(8例, 61.5%)高于无黏液成分者(16例, 39.0%), 但差别无显著意义(P = 0.155, 表1). Spearman检验证实TP ELISA与免疫组化结果之间具有显著相关性(rs = 0.526, P = 0.029), DPD亦然(rs = 0.658, P = 0.016).
| 临床病理特征 | n | TP | DPD | |||
| 酶活性(μkat/g protein) | 阳性率(%) | 酶活性(μkat/g protein) | 阳性率(%) | |||
| 性别 | 男 | 37 | 1096±550 | 18(48.6) | 248±124 | 20(54.1) |
| 女 | 17 | 1094±357 | 11(64.7) | 183±81a | 4(23.5)a | |
| 年龄(岁) | <59 | 27 | 1115±441 | 15(55.6) | 283±137 | 12(44.4) |
| ≥59 | 27 | 1076±550 | 14(51.9) | 217±91 | 12(44.4) | |
| 肿瘤部位 | 右半结肠 | 10 | 1266±647 | 6(60.0) | 243±125 | 5(50) |
| 左半结肠 | 14 | 1160±430 | 9(64.3) | 223±165 | 4(28.6) | |
| 直肠 | 30 | 1009±462 | 14(46.7) | 225±85 | 15(50) | |
| 肿瘤大小(cm) | <5 | 31 | 1143±524 | 18(58.1) | 220±99 | 13(41.9) |
| ≥5 | 23 | 1031±454 | 11(47.8) | 238±137 | 11(47.8) | |
| 黏液腺癌成分 | 无 | 41 | 1102±505 | 23(56.1) | 205±94 | 16(39.0) |
| 有 | 13 | 1074±476 | 6(46.2) | 298±151a | 8(61.5) | |
| 淋巴结转移 | 无 | 34 | 928±402 | 14(41.2) | 219±95 | 16(47.1) |
| 有 | 20 | 1379±514b | 15(75.0)a | 243±146 | 8(40) | |
| Dukes分期 | A | 13 | 925±499 | 5(38.5) | 203±64 | 5(38.5) |
| B | 21 | 931±343 | 9(42.9) | 229±110 | 11(52.4) | |
| C | 16 | 1342±526a | 11(68.8) | 202±94 | 5(31.3) | |
| D | 4 | 1528±508 | 4(100) | 404±218 | 3(75) | |
5-FU结构类似尿嘧啶, 作为一种前体药物, 在体内须经合成代谢转化为核苷酸类似物才能发挥细胞毒作用, 其具体机制为: (1)经TP转化为FdUMP, 后者与胸苷酸合成酶(TS)、5,10-亚甲基四氢叶酸形成三联复合物, 阻碍dTMP的从头合成; (2)以FUTP的形式参与RNA的合成, 破坏RNA的结构和功能; (3)以FdUTP的形式掺入DNA分子中, 引起DNA链断裂. DPD是嘧啶类(包括尿嘧啶、胸腺嘧啶和5-氟尿嘧啶)分解代谢的起始和限速酶, 其活性在肝脏中最高. 5-FU进入体内后仅有10%-20%以原形从尿中排泄, 80%以上在肝脏和其他组织中被DPD分解代谢[5,7].
通过对大肠癌TP和DPD的检测, 发现此二种酶的表达个体间差异显著, 分别相差13.3倍和9.0倍. 肿瘤组织内的TP蛋白含量也明显高于正常组织, 多项研究已有类似报道[8-9], 这也是新型口服氟尿嘧啶类药物doxifluridine和capecitabine应用于临床的理论依据, 因为这两种口服制剂均为5-FU前体药物, 需要经肿瘤组织内高表达的TP选择性激活转化为5-FU, 由于正常组织内TP含量较低, 因而可达到提高疗效, 减少毒副作用的靶向性治疗目的[10-12]. 而大肠癌组织的DPD含量仅略高于正常组织, 差别无显著性(P = 0.510), 治疗剂量的5-FU在大肠癌肿瘤及正常组织中的分解速度相仿, 若能选择性抑制肿瘤内的DPD活性而不影响到正常组织, 可达到减毒增效的目的, 值得进一步探讨.
5-FU本身无活性, 主要经胸苷磷酸化酶(TP)催化为FdUMP起效[5]. 将TP cDNA转导入肿瘤细胞可明显增加对5-FU的敏感性[13], 也有临床报道表明TP水平可反映氟尿嘧啶类药物的化疗疗效和预后[14], 但我们此前进行的细胞实验未能得出相同结论[15]. TP与氟尿嘧啶类药物敏感性的关系有待进一步研究. 与不同临床病理特征比较, 发现TP在有淋巴结转移的晚期肿瘤中显著升高, 可能系晚期大肠癌代谢旺盛, DNA合成增加所致; 而研究发现TP与血小板源性内皮细胞生长因子(platelet-derived endothelial cell growth factor, PD-ECGF)为同一物质, 具有促进内皮细胞趋化移动, 刺激血管生成的作用, 与肿瘤进展有关[16-18]; Arima et al[19]对于膀胱移行细胞癌的研究也证实TP是一独立预后因素, 表达阴性者生存率优于阳性者, TP有可能成为反映大肠癌侵袭程度的标志之一. Ishikawa et al[20]发现, 胃癌组织内的DPD mRNA水平与5-FU化疗敏感性呈负相关. 若能在化疗前经纤维肠镜活检等方法测定肿瘤内DPD活性, 可预测病人对5-FU的敏感性, 将该药剂量个体化, 从而达到既保证化疗疗效, 又避免发生严重毒副反应的目的; 对于那些肿瘤内DPD活性过高, 估计对5-FU化疗不敏感者, 可加用一类新型生化调节剂-DPD抑制剂[21-22], 如尿嘧啶、5-ethynyluracil等抑制DPD活性, 以增强5-FU疗效, 或改用其他抗癌新药, 如草酸铂、伊立替康、cetuximab[23]及bevacizumab[24]等. 在探讨DPD与临床病理特征关系的过程中, 还发现DPD在含黏液成分的腺癌中表达较高, 黏液腺癌系大肠癌的组织学亚型之一, 在病理学检查中, 可表现为单纯黏液腺癌, 或管状腺癌合并部分黏液腺癌, 均以肿瘤腺腔产生大量细胞外黏液为特点, Consorti et al[25]发现, 黏液腺癌较管状腺癌生长更快, 易于扩散转移, 对5-FU化疗不敏感, 预后也较差. 另外, 结肠癌DPD表达的另一特点为: 女性患者表达水平显著低于男性, ELISA和免疫组化结果均显示DPD表达具有性别差异. 已有临床研究显示, 性别是影响结直肠癌的独立预后因素, 在接受含5-FU的辅助化疗的患者中, 女性生存期显著长于男性, 这可能与前者DPD表达偏低有关[26], 而Yamashita et al[27]也证实, 女性的DPD表达水平明显低于男性. 对于DPD与临床病理特征关系的研究, 将有助于了解大肠癌中影响DPD表达的因素, 对临床合理应用5-FU及选用DPD抑制剂进行生化调节等都有一定的指导作用.
此外, 我们使用ELISA和免疫组化2种方法检测了TP和DPD的表达情况, 其测量结果之间具有显著相关性, 与临床病理特征比较所得结论亦相仿. ELISA与免疫组化两种方法均易于操作, 简便省时, 值得在临床进一步推广应用, 如通过外科切除标本或活检病理组织进行TP和DPD检测, 将有助于制定更为合理的方案用于大肠癌化疗.
5-FU是大肠癌化疗的首选和基本用药, 但该药效果不够稳定, 个体间差异很大, 研究影响5-FU化疗敏感/耐药性的预测因子, 用以指导临床合理用药实属必要. 5-FU激活酶-胸苷磷酸化酶(TP)和分解代谢的限速酶-二氢嘧啶脱氢酶(DPD)决定了肿瘤区域的药物浓度和作用, 且与5-FU的化疗敏感性有一定相关性.
针对5-FU代谢过程中发挥重要作用的TP酶和DPD酶, 分别研发了相应的抑制剂, 并均进入临床试验; 而TP和DPD作为具有研究前景的靶点, 采用何种手段进行干扰增效, 已引起了越来越多的关注.
本文检测了TP酶和DPD酶与大肠癌临床病理特征的关系, 将有助于了解大肠癌中影响其表达的因素, 对临床合理应用5-FU亦有一定指导作用; 从方法学上, 本文通过免疫组化及ELISA两种方法检测了TP和DPD两种酶的表达, 两种方法基本一致.
检测TP与DPD表达的目的是为了指导临床用药, 最终实现个体化治疗. 目前临床上DukesB期以上的大肠癌患者手术后均接受以5-FU为主的辅助化疗, 对这些病人进行随访, 探讨TP和DPD表达与生存的关系, 具有更深刻的临床意义.
胸苷酸合成酶(TS): 细胞内TS可催化dUMP还原为dTMP, 这是dTMP从头合成的唯一途径. TS是氟脲嘧啶类药物及新型化疗药物如raltitrexed, pemetrexed等的主要作用靶点, 该酶活性受抑可干扰细胞内DNA合成所必须的核苷酸储备, 导致细胞凋亡.
本文探讨TP和DPD在大肠癌中的表达, 及其与临床病理特征的关系, 有利于寻求5-FU敏感性的预测指标及临床个体化治疗的开展, 具有一定可读性及学术价值.
编辑: 潘伯荣 电编:李琪
| 1. | Goetz MP, Grothey A. Developments in combination chemotherapy for colorectal cancer. Expert Rev Anticancer Ther. 2004;4:627-637. [PubMed] |
| 2. | Ohtsu A, Baba H, Sakata Y, Mitachi Y, Horikoshi N, Sugimachi K, Taguchi T. Phase II study of S-1, a novel oral fluorophyrimidine derivative, in patients with metastatic colorectal carcinoma. S-1 Cooperative Colorectal Carcinoma Study Group. Br J Cancer. 2000;83:141-145. [PubMed] |
| 3. | Comella P, Natale D, Farris A, Gambardella A, Maiorino L, Massidda B, Casaretti R, Tafuto S, Lorusso V, Leo S. Capecitabine plus oxaliplatin for the first-line treatment of elderly patients with metastatic colorectal carcinoma: final results of the Southern Italy Cooperative Oncology Group Trial 0108. Cancer. 2005;104:282-289. [PubMed] |
| 4. | Colucci G, Gebbia V, Paoletti G, Giuliani F, Caruso M, Gebbia N, Carteni G, Agostara B, Pezzella G, Manzione L. Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell'Italia Meridionale. J Clin Oncol. 2005;23:4866-4875. [PubMed] |
| 5. | Diasio RB, Johnson MR. The role of pharmacogenetics and pharmacogenomics in cancer chemotherapy with 5-fluorouracil. Pharmacology. 2000;61:199-203. [PubMed] |
| 6. | Maring JG, Groen HJ, Wachters FM, Uges DR, de Vries EG. Genetic factors influencing pyrimidine-antagonist chemotherapy. Pharmacogenomics J. 2005;5:226-243. [PubMed] |
| 7. | Mattison LK, Soong R, Diasio RB. Implications of dihydropyrimidine dehydrogenase on 5-fluorou-racil pharmacogenetics and pharmacogenomics. Pharmacogenomics. 2002;3:485-492. [PubMed] |
| 8. | Ikeguchi M, Makino M, Kaibara N. Thymidine phosphorylase and dihydropyrimidine dehydrogenase activity in colorectal carcinoma and patients prognosis. Langenbecks Arch Surg. 2002;387:240-245. [PubMed] |
| 9. | Morita T, Matsuzaki A, Tokue A. Quantitative analysis of thymidine phosphorylase and dihydropyrimidine dehydrogenase in renal cell carcinoma. Oncology. 2003;65:125-131. [PubMed] |
| 10. | Ebi H, Sigeoka Y, Saeki T, Kawada K, Igarashi T, Usubuchi N, Ueda R, Sasaki Y, Minami H. Pharmacokinetic and pharmacodynamic comparison of fluoropyrimidine derivatives, capecitabine and 5'-deoxy-5-fluorouridine (5'-DFUR). Cancer Chemother Pharmacol. 2005;56:205-211. [PubMed] |
| 11. | Kim JS, Kim JS, Cho MJ, Yoon WH, Song KS. Comparison of the efficacy of oral capecitabine versus bolus 5-FU in preoperative radiotherapy of locally advanced rectal cancer. J Korean Med Sci. 2006;21:52-57. [PubMed] |
| 12. | Folprecht G, Kohne CH. Drug Insight: Metastatic colorectal cancer-oral fluoropyrimidines and new perspectives in the adjuvant setting. Nat Clin Pract Oncol. 2005;2:578-587. [PubMed] |
| 13. | Marchetti S, Chazal M, Dubreuil A, Fischel JL, Etienne MC, Milano G. Impact of thymidine phosphorylase surexpression on fluoropyrimidine activity and on tumour angiogenesis. Br J Cancer. 2001;85:439-445. [PubMed] |
| 14. | Saito H, Tsujitani S, Oka S, Kondo A, Ikeguchi M, Maeta M, Kaibara N. The expression of thymidine phosphorylase correlates with angiogenesis and the efficacy of chemotherapy using fluorouracil derivatives in advanced gastric carcinoma. Br J Cancer. 1999;81:484-489. [PubMed] |
| 15. | Ma T, Zhu ZG, Ji YB, Zhang Y, Yu YY, Liu BY, Yin HR, Lin YZ. Correlation of thymidylate synthase, thymidine phosphorylase and dihydropyrimidine dehydrogenase with sensitivity of gastrointestinal cancer cells to 5-fluorouracil and 5-fluoro-2'-deoxyuridine. World J Gastroenterol. 2004;10:172-176. [PubMed] |
| 16. | Griffiths L, Stratford IJ. Platelet-derived endothelial cell growth factor thymidine phosphorylase in tumour growth and response to therapy. Br J Cancer. 1997;76:689-693. [PubMed] |
| 17. | Mainou-Fowler T, Angus B, Miller S, Proctor SJ, Taylor PR, Wood KM. Micro-vessel density and the expression of vascular endothelial growth factor (VEGF) and platelet-derived endothelial cell growth factor (PdEGF) in classical Hodgkin lymphoma (HL). Leuk Lymphoma. 2006;47:223-230. [PubMed] |
| 18. | Perez-Perez MJ, Priego EM, Hernandez AI, Camarasa MJ, Balzarini J, Liekens S. Thymidine phosphorylase inhibitors: recent developments and potential therapeutic applications. Mini Rev Med Chem. 2005;5:1113-1123. [PubMed] |
| 19. | Arima J, Imazono Y, Takebayashi Y, Nishiyama K, Shirahama T, Akiba S, Furukawa T, Akiyama S, Ohi Y. Expression of thymidine phosphorylase as an indicator of poor prognosis for patients with transitional cell carcinoma of the bladder. Cancer. 2000;88:1131-1138. [PubMed] |
| 20. | Ishikawa Y, Kubota T, Otani Y, Watanabe M, Teramoto T, Kumai K, Takechi T, Okabe H, Fukushima M, Kitajima M. Dihydropyrimidine dehydrogenase and messenger RNA levels in gastric cancer: possible predictor for sensitivity to 5-fluorouracil. Jpn J Cancer Res. 2000;91:105-112. [PubMed] |
| 22. | Schmoll HJ. Dihydropyrimidine dehydrogenase inhibition as a strategy for the oral administration of 5-fluorouracil: utility in the treatment of advanced colorectal cancer. Anticancer Drugs. 2003;14:695-702. [PubMed] |
| 23. | Vincenzi B, Santini D, Rabitti C, Coppola R, Beomonte Zobel B, Trodella L, Tonini G. Cetuximab and irinotecan as third-line therapy in advanced colorectal cancer patients: a single centre phase Ⅱtrial. Br J Cancer. 2006;94:792-797. [PubMed] |
| 24. | Kabbinavar FF, Schulz J, McCleod M, Patel T, Hamm JT, Hecht JR, Mass R, Perrou B, Nelson B, Novotny WF. Addition of bevacizumab to bolus fluorouracil and leucovorin in first-line metastatic colorectal cancer: results of a randomized phase II trial. J Clin Oncol. 2005;23:3697-3705. [PubMed] |
| 25. | Consorti F, Lorenzotti A, Midiri G, Di Paola M. Prognostic significance of mucinous carcinoma of colon and rectum: a prospective case-control study. J Surg Oncol. 2000;73:70-74. [PubMed] |
| 26. | Wichmann MW, Muller C, Hornung HM, Lau-Werner U, Schildberg FW. Gender differences in long-term survival of patients with colorectal cancer. Br J Surg. 2001;88:1092-1098. [PubMed] |
| 27. | Yamashita K, Mikami Y, Ikeda M, Yamamura M, Kubozoe T, Urakami A, Yoshida K, Kimoto M, Tsunoda T. Gender differences in the dihydropyrimidine dehydrogenase expression of colorectal cancers. Cancer Lett. 2002;188:231-236. [PubMed] |