修回日期: 2006-03-01
接受日期: 2006-03-03
在线出版日期: 2006-04-18
目的: 探讨不同大肠癌细胞株的形貌结构差异与其转移特性的相关性.
方法: 对3种遗传背景一致, 具有不同转移特性的大肠癌细胞株SW620(淋巴道转移)、SW480(血道和淋巴道转移)SW480/M(肝转移)细胞的形态结构进行原子力显微镜和光镜观察, 以及应用免疫组化技术检测CEA、CD44、Fascin、PCNA在3种细胞的表达.
结果: 3个细胞系主要由4种形态细胞构成, 包括类圆形细胞、单极细胞、纤维母细胞样细胞及瘤巨细胞. SW620瘤细胞纤维母细胞样细胞较多, 表面有较多的微细绒毛和细长胞突, 瘤细胞间黏附不紧密. SW480/M细胞具有上皮细胞分化的特点, 主要由类圆形和单极细胞构成, 细胞与细胞连接紧密, 胞质融合, 细胞膜表面特化结构不明显. SW480细胞形态介于SW620和SW480/M之间. CEA在3种细胞均低表达; CD44和PCNA在SW480/M的表达强度明显高于SW620和SW480, 差异显著(CD44v5: 26.023±2.394 vs 10.554±1.955, 14.411±4.826, P<0.001; PCNA: 93% vs 37%, 40%, P<0.001), Fascin表达在SW620与SW480/MS之间差异明显(26.507±2.471 vs 19.157±3.563, P<0.05), 而在SW620和SW480之间无差异.
结论: 3种大肠癌细胞固有的表面形貌和免疫表型存在差异, 可能与肿瘤细胞转移特性有关.
引文著录: 余力, 刘莉, 张艳菲, 蔡颍谦, 李祖国, 丁彦青. 转移特性不同的大肠癌细胞形貌结构的差异分析. 世界华人消化杂志 2006; 14(11): 1097-1102
Revised: March 1, 2006
Accepted: March 3, 2006
Published online: April 18, 2006
AIM: To investigate the correlation between the different property of metastasis and the variance of morphological architecture in human colorectal carcinoma (HCC) cell lines.
METHODS: The morphological architectures of three HCC cell lines with the identical genetic background and different property of metastasis, including SW620 (lymphatic metastasis), SW480 (hematogenous and lymphangitic metastasis) and SW480/M (hepatic metastasis), were observed by light microscopy and atomic force microscopy (AFM), and the expression of carcinoembryonic antigen (CEA), CD44v5, Fascin and proliferating cell nuclear antigen (PCNA) in those cell lines were detected by immunohistochemical method.
RESULTS: There were four types of cells, shaping as round-like, monopole, fibroblast-like, and giant, in all the three cell lines. In SW620 cell line, there were more fibroblast-like cells with many microvillus and pseudopodia on the cell surface and loose inter-cells conjunction. SW480/M consisted of round-like and monopole cells principally, which had the characteristics of epithelial differentiation. The cytoplasm margin was unclearly like plasmogamy and the specialized structure on cell membrane was unobvious. The morphology of SW480 cell was showed between SW620 and SW480/M. The level of CEA expression in all the three cell lines was lower. The expression of CD44v5 and PCNA in SW480/M were significantly higher than those in SW620 and SW480 (CD44v5: 26.023 ± 2.394 vs 10.554 ± 1.955, 14.411 ± 4.826, P < 0.001; PCNA: 93% vs 40%, 37%, P < 0.001). The expression of fascin in SW620 was significantly higher than that in SW480/M (26.507 ± 2.471 vs 19.157 ± 3.563, P < 0.05). However, fascin expression was not markedly different between SW620 and SW480.
CONCLUSION: Morphological architecture and immunophenotypes are different in the three types of cultivated cells, which may be related to their property of metastasis.
- Citation: Yu L, Liu L, Zhang YF, Cai YQ, Li ZG, Ding YQ. Distinction analysis for variance of morphological architecture and different property of metastasis in human colorectal carcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(11): 1097-1102
- URL: https://www.wjgnet.com/1009-3079/full/v14/i11/1097.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i11.1097
虽然目前大肠癌的治疗手段和患者的预后有较大的改善, 但术后局部复发与继发的淋巴道转移、肝转移仍是严重威胁患者生命的主要因素[1]. 大肠癌的发生、发展是多步骤、多种因素参与的极复杂过程. 不同转移潜能的肿瘤细胞系是研究转移机制的常用的模型, 通过比较细胞形态、生物学特性、表达基因及蛋白差异等, 可探讨其与侵袭、转移的关系和作用机制. 由于不同转移特性癌细胞存在膜表面分子种类和数量等的差异, 其超微结构的形貌也必然存在或多或少的差异. 为此我们对同一亲本, 分别具有不同转移特性3种人大肠癌细胞株进行了形貌结构的观察, 以求从形态学角度探讨常规培养条件下肿瘤细胞的原始的形貌差异与其转移特性的相关性.
SW620、SW480和SW480/M人大肠癌细胞株来自同一亲本, 遗传背景一致, 分别具有不同转移潜能. SW620(ATCC号: CCL227)具有高选择淋巴道转移的特性, SW480(ATCC号: CCL228)血道和淋巴道转移, SW480/M是南方医科大学肿瘤研究所用体内连续传代方法, 以SW480细胞株在裸鼠盲肠反复接种, 筛选获得的具有高选择肝脏转移特性的亚系.
1.2.1 细胞培养: 先将盖玻片等分成4块, 用纯水反复冲洗, 高压消毒后, 置入6孔培养板中待用; 载玻片用1 g/L多聚赖氨酸包被晾干、高温消毒后备用. 将3种人大肠癌细胞株悬液接种在培养板中盖玻片和湿盒内的载玻片上, 50 mL/L CO2、37 ℃进行常规培养. 培养基为RPMI 1640和100 mL/L小牛血清, 24 h后更换1次培养液, 2 d后取出待用.
1.2.2 标本处理和形态学观察: 长有细胞载玻片用PBS轻洗两遍后25 g/L戊二醛固定20 min, PBS轻洗后, 常规HE染色及免疫组化检测, 光镜观察. 另将载有细胞的盖玻片用PBS轻洗2遍, 用25 g/L戊二醛固定20 min, 用PBS和纯水各轻洗晾干后置于原子力显微镜(atomic force microscope, AFM)内观察. AFM型号SPM-9500J3(岛津公司, 日本), 接触模式, 悬臂弹性系数2 N/m, 针尖曲率半径为20 nm, 水平最大扫描范围为125 μm ×125 μm. 先应用附带光镜随机找到肿瘤细胞, 移动针尖至扫描范围内, 接触压力调整好后对细胞膜表面进行3000-10000倍分辨率的三维形貌逐层扫描检测, 利用随机附带分析软件对细胞的形态、细胞表面粗糙度(Ra)等指标进行分析.
1.2.3 免疫组化检测: 鼠抗人CEA、CD44、Fascin、PCNA即用型单克隆抗体以及SP试剂盒均购自福建迈新生物有限公司. 磷酸盐高压抗原修复, SP法染色, 染色操作步骤按照试剂盒说明书进行, 以PBS替代一抗设立阴性对照, 以已知的阳性组织片作为阳性对照. 免疫组化结果判定, CEA、CD44、Fascin阳性细胞棕黄色颗粒定位于细胞质或细胞膜, PCNA阳性定位于细胞核; 应用CMIAS图像分析系统免疫组化测量模块, 测量CEA、CD44、Fascin阳性细胞的阳性值(PU值): 每个细胞系随机选择7个高倍视野, 每个视野描记测量不少于20个阳性细胞. PCNA在高倍视野下计数200个细胞, 计算阳性细胞数, 换算为阳性百分比.
统计学处理 使用SPSS10.0专业软件, 应用统计学方法包括t检验, χ2检验等, 结果以mean±SD表示.
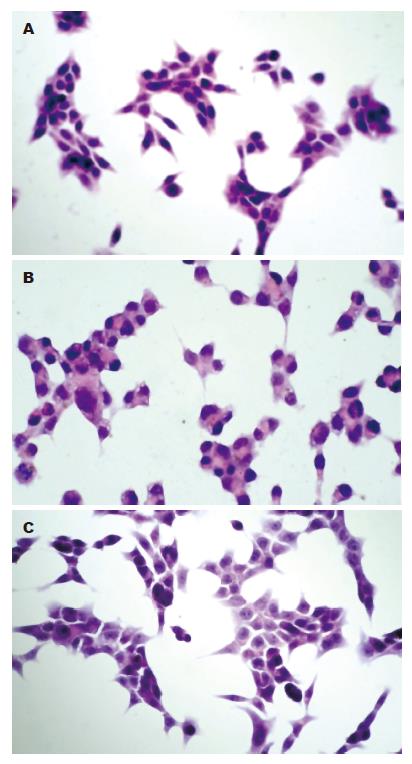
三个细胞系载玻片上细胞形态主要为四种类型: (1)纤维母细胞样(双极)细胞, 细胞核椭圆形, 胞突尖细; (2)类圆形细胞, 细胞核圆形µ染, 有1-2个核仁; (3)单极细胞, 细胞核圆形浓染, 偏位, 一极有尖细的胞质; (4)瘤巨细胞, 细胞核大, 畸形浓染, 胞质丰富, µ红染. SW620细胞成簇平铺分布, 排列错落有致, 细胞界限清, 细胞簇中央为类圆形细胞, 周边有较多的纤维母细胞样细胞, 散在或相互胞突相连形成链状(图1A). SW480/M细胞集聚成簇或呈链状分布, 细胞与细胞连接紧密、界限不清呈融合状, 单极细胞位于周边, 胞突细长(图1B), 纤维母细胞样细胞罕见. SW480细胞分布与排列与SW620细胞类似, 但具有核仁的类圆形细胞明显比SW620多, 部分区域细胞间界限不清呈融合状(图1C). 三个细胞系均见有瘤巨细胞散在分布, 以SW480/M最多, 核分裂相易见.
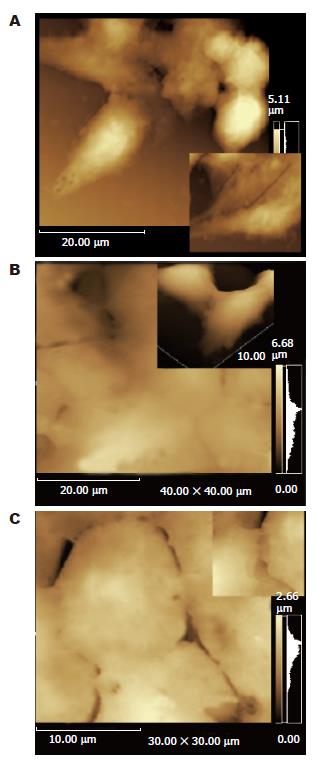
可见多个成簇排列的肿瘤细胞, 相邻细胞存在明确的连接缝隙或紧密连接呈融合状, 连接缝隙处可以清晰地观察到胞质伸出的细丝状或片状的连接物质或缝隙不明显融合状. 纤维母细胞样细胞多呈游离状, 其纵轴长径约30 μm, 横径为8.49 μm, 表面有较多的微细绒毛, 两端可见较粗的伪足, 呈卷曲状, 逐渐变细呈绒毯状附着于玻片上; 纤维母细胞样细胞与其他细胞之间可见伸出的伪足相连或灶性紧密相连(图2A). 类圆形细胞直径约为11 μm, 表面微细绒毛稀疏, 可见粗短胞突; RA值(nm,平均值): 纤维母细胞样细胞2100, 单极细胞1116, 类圆形细胞为183. SW620纤维母细胞样细胞多见, 细胞与细胞连接缝隙清晰, 有局灶的胞质融合. SW480/M细胞集聚层叠, 细胞与细胞连接紧密, 连接处胞质融合, 表面微细绒毛不明显(图2B). SW480细胞表面微细绒毛相对SW620密度减少, 细胞与细胞连接缝隙模糊, 有灶片状的胞质融合(图2C). 3种细胞株形态和测量参数比较(表1).
PCNA在SW480、SW620和SW480/M的表达阳性率分别是37%, 40%和93%, SW480/M与其他2组比较差异显著(P<0.001); CEA、CD44、Fascin的表达结果(表2). CEA表达值在3个细胞系弱表达, 3组之间两两比较有差异(P<0.05), 以SW480/M表达最强; Fascin在SW480、SW620的表达无差异, 以SW620表达最强, 与SW480/M比较差异明显(P<0.05); CD44在3组之间两两比较有差异(P<0.05), 在SW480/M的表达强度明显高于SW480和SW620, 差异显著(P<0.001).
| 细胞系 | CEA | CD44 | Fascin |
| SW480 | 4.936±1.004 | 14.411±4.826 | 27.267±6.070 |
| SW620 | 3.350±0.760 | 10.554±1.955 | 26.507±2.471 |
| SW480/M | 6.399±2.069 | 26.023±2.394 | 19.157±3.563 |
癌细胞运动能力是癌细胞转移的基础, 细胞表面结构的改变、细胞膜的凸起和伪足形成与细胞黏附、渗透压的变化以及细胞固有的骨架结构等有关, 在细胞靶向性移动中具有重要作用, 是癌细胞侵袭转移的形态学基础[2]. 由于肿瘤细胞黏附、扩散、迁移依赖于与细胞外基质接触的动态形成和松解, 因附着基质成分不同, 细胞形态变化不同[3], 来源于同一个体结肠癌不同亚系细胞, 虽然在倍增时间、染色体数目、染色体缺陷相似, 但细胞表面表达黏附分子不同, 体外培养的细胞形态和侵袭和转移能力也存在差异[4]. 因此, 本实验为保持细胞的原始状态, 我们采用多聚赖氨酸包被的玻片[5]和无任何处理载玻片作为培养细胞的附着物, 使黏附对细胞的形态影响减低到最小程度. 在此条件下对同源性不同细胞株固有的细胞形貌特征的观察可以一定程度上了解癌细胞的形态与转移特性的相关性. 同时, 为了了解细胞的基本状态, 我们对3个细胞系进行了CEA、CD44、Fascin、PCNA免疫组化定量检测. 结果表明, 作为细胞分化指标CEA在3种细胞低表达, 说明细胞分化程度均较低[10]; CD44和PCNA在SW480/M的表达显著高于另外两种细胞, 具有高增殖活性和与周围细胞或基质的黏附能力, 说明SW480/M细胞更具有侵袭性[6-7].
许多研究表明大肠癌的组织细胞形态、侵袭生长方式和免疫表型等与肿瘤转移的部位有关[8], 为了解肿瘤细胞固有的形貌结构与器官转移特性的相关性, 我们应用光镜和最新的表面成像技术-AMF对培养同一亲本, 分别具有不同转移特性的SW620、SW480和SW480/M大肠癌细胞进行了形态和表面超微结构观测. 结果显示3个细胞系细胞各具有不同形态特点, 构成的细胞形态多样, 从类圆形细胞、单极细胞到纤维母细胞样细胞, 微细绒毛、伪足形成数量明显增多, 测量Ra值在变形细胞明显大于类圆形细胞, 达5-50倍, 以纤维母细胞样细胞为最大; 类圆型细胞中, Ra值SW480/M细胞明显高于其余2种细胞. Ra值是指样品表面上具有较小间距的峰谷所组成的微观集合形状特性, Ra值越小, 被测表面越光滑, 反之, Ra值越大, 被测表面越粗糙, Ra值可作为描述细胞表面形貌特性的指标, 其形成原因很可能是膜表面蛋白单体、聚集体,以及膜表面的突起和微绒毛等特化结构所致[9]. 说明同源性细胞系不同形态的细胞的形成很可能是细胞生长分化不同阶段的结果. 而同一细胞系的不同亚系细胞的形态不同, 其表型及迁移能力不同, Solimene et al[10]观察大肠癌肝转移筛选出的LISP-I细胞系内的亚系细胞形态和行为特征的关系, LISP-A10细胞表现出上皮分化且表达CEA和桥粒核心糖蛋白, LISP-E11为纤维母细胞样, 低地表达CEA; 与层黏蛋白和纤维连接素的黏附作用和移动趋向性, LISP-E11高于LISP-A10. 说明同一细胞系存在细胞转移能力的异质性. Kubens et al[11]对活体大肠癌细胞的观察发现自发移动的细胞都具有伸长胞突的细胞, 而不活动的细胞为圆形, 提示变形瘤细胞变异越大, 特别是纤维母细胞样细胞, 迁移能力越强,肿瘤的特异性转移是一个非随机事件, 依赖于特定的肿瘤细胞与特定的组织或器官提供的生长环境并与之相适应[12-13], 在同源性肿瘤细胞之间存在黏附内皮和实质细胞能力的差异, 对器官特异生长因子和抑制因子的反应存在差异[14]. SW480/M是具有高选择肝脏转移特性的亚细胞系, 形态特征是类圆细胞, 细胞与细胞连接紧密, 胞质融合, 细胞膜表面特化结构不明显, 提示瘤细胞自发运动的能力低且细胞之间黏附紧, 具有上皮细胞分化的特点. 单从形态特点来看, SW480/M不具备肿瘤细胞侵袭运动的形态基础. 但由于SW480/M高表达CD44, 在肿瘤生长过程中能够连接细胞外基质成分, 通过与细胞骨架蛋白相结合, 参与细胞伪足的形成, 引起细胞的形态和游动性改变, 易于与血管内皮黏附, 促进浸润和转移[15-16]. 袁辉生et al[17]临床研究发现高分化大肠癌的肝转移率比低分化癌高, 认为高分化癌尽管恶性度低, 但就肝转移而言, 并不意味其预后较好, 究其原因可能是低分化癌脱落的肿瘤细胞浸润能力、运动力均强, 常呈单个状态进入肝脏, 易被肝脏的Kupffer细胞所吞噬, 而高分化癌的肿瘤脱落多呈瘤栓状,可嵌在肝窦中, 形成肝转移. 这个结果可以解释SW480/M细胞之间黏附紧密的形态特点. 依据SW480/M细胞的转移特性, 其侵袭转移方式可能为瘤组织侵袭破坏静脉, 成片细胞脱落进入血道, 进而与血管黏附、侵袭和着床生长而发生肝转移.
Fascin是一种50-55 kDa的细胞骨架蛋白, 可与F-肌动蛋白结合, 定位于细胞质张力纤维和细胞膜皱褶边缘的丝状伪足、微棘的核心肌动蛋白束中, Fascin的高表达引起胞膜表面突起增多, 肌动蛋白骨架重建, 细胞运动性增强, 细胞侵袭能力增加[18-19]. SW620细胞具有较高的淋巴结转移的选择性, Fascin表达增高, 其形态特点是瘤细胞变形明显, 纤维母细胞样细胞多, 形成的细胞伪足明显, 提示细胞阿米巴运动能力较强; CD44表达较低提示瘤细胞间黏附不紧, 可使癌细胞失去"束缚", 获得一定的"自由", 易于脱离癌细胞团, 说明大肠癌的淋巴道转移与细胞的自身运动能力明显相关, 癌细胞可通过主动侵蚀、变形进入淋巴管, 导致淋巴结转移. SW480细胞形态特征和免疫表型介于SW620和SW480/M之间, 兼具有两者的形态特点, 提示其瘤细胞异质性明显, 而易形成淋巴和血道转移.
大肠癌术后局部复发与继发的淋巴道转移、肝转移仍是严重威胁患者生命的主要因素, 许多研究表明大肠癌的组织细胞形态、侵袭生长方式和免疫表型等与肿瘤转移的部位有关, 作为研究转移机制常用的不同转移潜能的肿瘤细胞系, 由于癌细胞存在膜表面分子种类和数量等的差异, 其超微结构的形貌也必然存在或多或少的差异.
本文应用光镜和最新的表面成像技术-AMF对培养同一亲本, 分别具有不同转移特性的SW620(淋巴道转移)、SW480(血道和淋巴道转移)、SW480/M(肝转移)大肠癌细胞进行了形态和表面超微结构观测. 发现这3种细胞存在形貌结构的不同, 从形态学角度分析了形貌结构的差异与转移特性的相关性, 为大肠癌转移机制的研究提供新的线索.
本文应用光镜和最新的表面成像技术-原子力显微镜技术对培养的三个大肠癌细胞系进行了形态和表面超微结构观测, 发现同一亲本, 遗传背景一致, 分别具有不同转移特性的大肠癌细胞具有不同的形态特点, 并分析了其间的关系. 研究方法科学, 形态观察细致, 结果分析可信.
编辑: 潘伯荣 电编:李琪
| 1. | Chedid AD, Villwock Mde M, Chedid MF, Rohde L. Prognostic factors following liver resection for hepatic metastases from colorectal cancer. Arq Gastroenterol. 2003;40:159-165. [PubMed] |
| 2. | You J, Aznavoorian S, Liotta LA, Dong C. Responses of tumor cell pseudopod protrusion to changes in medium osmolality. J Cell Physiol. 1996;167:156-163. [PubMed] |
| 3. | Lehnert D, Wehrle-Haller B, David C, Weiland U, Ballestrem C, Imhof BA, Bastmeyer M. Cell behaviour on micropatterned substrata: limits of extracellular matrix geometry for spreading and adhesion. J Cell Sci. 2004;117:41-52. [PubMed] |
| 4. | Kotanagi H, Saito Y, Yoshioka T, Koyama K. Characteristics of two cancer cell lines derived from metastatic foci in liver and peritoneum of a patient with colon cancer. J Gastroenterol. 1998;33:842-849. [PubMed] |
| 5. | McElfresh M, Baesu E, Balhorn R, Belak J, Allen MJ, Rudd RE. Combining constitutive materials modeling with atomic force microscopy to understand the mechanical properties of living cells. Proc Natl Acad Sci USA. 2002;99:6493-6497. [PubMed] |
| 6. | Hanley WD, Napier SL, Burdick MM, Schnaar RL, Sackstein R, Konstantopoulos K. Variant isoforms of CD44 are P- and L-selectin ligands on colon carcinoma cells. FASEB J. 2006;20:337-339. [PubMed] |
| 7. | Karadag A, Fedarko NS, Fisher LW. Dentin matrix protein 1 enhances invasion potential of colon cancer cells by bridging matrix metalloproteinase-9 to integrins and CD44. Cancer Res. 2005;65:11545-11552. [PubMed] |
| 8. | Nakamura T, Mitomi H, Kikuchi S, Ohtani Y, Sato K. Evaluation of the usefulness of tumor budding on the prediction of metastasis to the lung and liver after curative excision of colorectal cancer. Hepatogastroenterology. 2005;52:1432-1435. [PubMed] |
| 9. | Bolshakova AV, Kiselyova OI, Filonov AS, Frolova OY, Lyubchenko YL, Yaminsky IV. Comparative studies of bacteria with an atomic force microscopy operating in different modes. Ultramicroscopy. 2001;86:121-128. [PubMed] |
| 10. | Solimene AC, Carneiro CR, Melati I, Lopes JD. Functional differences between two morphologically distinct cell subpopulations within a human colorectal carcinoma cell line. Braz J Med Biol Res. 2001;34:653-661. [PubMed] |
| 11. | Kubens BS, Zanker KS. Differences in the migration capacity of primary human colon carcinoma cells (SW480) and their lymph node metastatic derivatives (SW620). Cancer Lett. 1998;131:55-64. [PubMed] |
| 12. | Ponta H, Sherman L, Herrlich PA. CD44: from adhesion molecules to signalling regulators. Nat Rev Mol Cell Biol. 2003;4:33-45. [PubMed] |
| 13. | Kopfstein L, Christofori G. Metastasis: cell-autonomous mechanisms versus contributions by the tumor microenvironment. Cell Mol Life Sci. 2006;63:449-468. [PubMed] |
| 14. | Vogel I, Shen Y, Soeth E, Juhl H, Kremer B, Kalthoff H, Henne-Bruns D. A human carcinoma model in athymic rats reflecting solid and disseminated colorectal metastases. Langenbecks Arch Surg. 1998;383:466-473. [PubMed] |
| 15. | 徐 钊, 张 霞, 房 殿春, 晋 华源, 罗 元辉, 阎 晓初, 王 东旭. 结肠癌患者癌组织中CD44v6和Ⅳ型胶原的表达及血清中HA和Ⅳ型胶原的定量检测. 世界华人消化杂志. 2004;12:2312-2315. [DOI] |
| 18. | Buda A, Pignatelli M. Cytoskeletal network in colon cancer: from genes to clinical application. Int J Biochem Cell Biol. 2004;36:759-765. [PubMed] |
| 19. | Jawhari AU, Buda A, Jenkins M, Shehzad K, Sarraf C, Noda M, Farthing MJ, Pignatelli M, Adams JC. Fascin, an actin-bundling protein, modulates colonic epithelial cell invasiveness and differentiation in vitro. Am J Pathol. 2003;162:69-80. [PubMed] |