修回日期: 2006-01-01
接受日期: 2006-01-13
在线出版日期: 2006-04-18
目的: 探讨槲皮素(Qu)对结肠癌HT-29细胞增殖和凋亡影响的分子机制.
方法: 以40×10-6, 80×10-6, 160×10-6 mol/L的槲皮素作用结肠癌HT-29细胞, 以溶剂为对照组, 采用MTT试验、流式细胞分析、免疫细胞化学和RT-PCR等方法观察槲皮素对结肠癌细胞增殖, 细胞周期, 细胞凋亡, 及Caspase-3蛋白表达、Caspase-3、bcl-2、bax mRNA表达的影响.
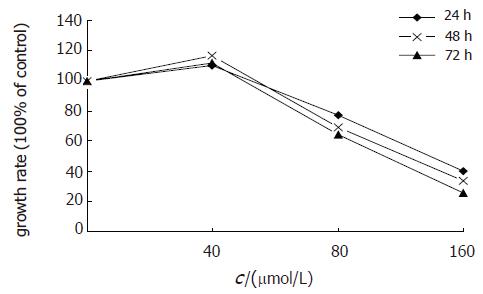
结果: 40×10-6 mol/L Qu明显促进HT-29细胞增殖(P<0.05), 80×10-6, 160×10-6 mol/L Qu明显抑制细胞增殖(P<0.05或P<0.01), 呈时间-效应. 40×10-6, 80×10-6, 160×10-6 mol/L 槲皮素作用HT-29细胞72 h, 其增殖率分别为111.8%±9.6%, 64.6%±8.3%和26.1%±5.7%, G0/G1期细胞分别为32.7%±5.4%、58.1%±18.3%和71.6%±20.8%, S期细胞分别为48.6%±17.5%、27.4%±13.4%和15.4%±10.1%, 细胞凋亡率分别为7.0%±1.3%、15.6%±3.6%和26.4%±6.2%, 80×10-6, 160×10-6 mol/L能明显提高G0/G1期细胞(P<0.01), 明显降低S期细胞(P<0.01), 细胞凋亡明显增加(P<0.01). 80×10-6, 160×10-6 mol/L的Qu增加细胞中bax mRNA, Caspase-3 mRNA及其蛋白的表达, 降低bcl-2 mRNA的表达. 40×10-6 mol/L的Qu增加Caspase-3 mRNA表达, 但其蛋白表达未见明显增加, 细胞增殖明显增加.
结论: 槲皮素能促进结肠癌HT-29细胞增殖, 也能诱导细胞凋亡, 其机制可能是通过上调Caspase-3和bax表达, 降低bcl-2表达来实现的.
引文著录: 严兴耘, 彭俊华, 张华欣, 张峰, 卞晓红, 王海忠, 赵涛. 槲皮素对结肠癌HT-29细胞增殖及周期的影响. 世界华人消化杂志 2006; 14(11): 1071-1076
Revised: January 1, 2006
Accepted: January 13, 2006
Published online: April 18, 2006
AIM: To investigate the effect of quercetin on the proliferation and apoptosis of colon carcinoma cell line HT-29 and its molecular mechanism.
METHODS: HT-29 cells were treated with different concentrations of quercetin (40×10-6, 80×10-6 and 160×10-6 mol/L) for 72 h. HT-29 cells treated with DMSO vehicle were used as the controls. MTT assay, flow cytometry, immunocytochemistry and reverse transcription polymerase chain reaction (RT-PCR) was used to observe the changes of cell proliferation, cell cycle, Caspase-3 protein expression, and bax, bcl-2, and Caspase mRNA expression in HT-29 cells, respectively.
RESULTS: Quercetin at a concentration of 40×10-6 mol/L promoted the proliferation of HT-29 cells (P < 0.05), while it significantly inhibited the proliferation of HT-29 cells at the concentrations of 80×10-6 and 160×10-6 mol/L (P < 0.05 or P < 0.01), showing a time-dependent manner. After treatment with 40×10-6, 80×10-6 and 160×10-6 mol/L quercetin for 72 h, the proliferation ratio of HT-29 cells were 111.8% ± 9.6%, 64.6% ± 8.3% and 26.1% ± 5.7%, respectively; the percentages of HT-29 cells at period G0/G1 were 32.7% ± 5.4%, 58.1% ± 18.3% and 71.6% ± 20.8% respectively, and those of HT-29 cells at period S were 48.6% ± 17.5%, 27.4% ± 13.4% and 15.4% ± 10.1%, respectively; the apoptosis rates of HT-29 cells were 7.0% ± 1.3%, 15.6% ± 3.6% and 26.4% ± 6.2% respectively. 80×10-6. 160×10-6 mol/L quercetin acted on HT-29 cell, the cells at period G0/G1 and the apoptosis rates were significantly increased (P < 0.01), and the cells at period S were significantly decreased (P < 0.01) after 80×10-6 and 160×10-6 mol/L quercetin treatment. Quercetin at concentrations of 80×10-6 and 160×10-6 mol/L increased the expression of Caspase-3 and bax mRNA and Caspase-3 protein, but decreased the expression of bcl-2 mRNA. Quercetin at a concentration of 40×10-6 mol/L increased Caspase-3 mRNA expression and the proliferation of HT-29 cells, but not Caspase-3 protein expression.
CONCLUSION: Quercetin at lower concentrations can promote the proliferation of colon carcinoma cell line HT-29 while it can inhibit the proliferation and induce apoptosis of HT-29 cells at higher concentrations. The mechanism may be associated with up-regulation of Caspase-3 and bax and down-regulation of bcl-2 expression.
- Citation: Yan XY, Peng JH, Zhang HX, Zhang F, Bian XH, Wang HZ, Zhao T. Effects of quercetin on proliferation and cell cycle of colon carcinoma cell Line HT-29. Shijie Huaren Xiaohua Zazhi 2006; 14(11): 1071-1076
- URL: https://www.wjgnet.com/1009-3079/full/v14/i11/1071.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i11.1071
槲皮素(quercetin, Qu)是一种天然的黄酮类化合物, 广泛存在于苹果、洋葱、茶叶[1-2]及银杏、款冬花、高良姜、侧柏叶、桑寄生、田基黄等中药中, 能诱导多种癌细胞凋亡[3-6], 抑制肝肿瘤细胞生长[7], 能促进结肠癌HT-29细胞凋亡[8-9], 但其作用分子机制未见报道. 我们将槲皮素作用于结肠癌HT-29细胞, 通过MTT实验、流式细胞仪、免疫组化、RT-PCR等方法观察HT-29细胞的增生、凋亡和Caspase-3, bcl-2, bax的改变, 探讨槲皮素影响HT-29细胞凋亡的可能分子机制.
槲皮素, 纯度>98%, Sigma产品. 小鼠抗人Caspase-3抗体, 1:75稀释, 羊抗兔S-P试剂盒及DAB显色试剂盒, 北京中杉产品. RT-PCR试剂盒, 上海Sangon产品. 人结肠癌HT-29细胞由中科院上海细胞所提供, HT-29细胞在RPMI 1640中37 ℃, 50 mL/L CO2培养, 常规传代.
实验分为4组: Con(对照)组, 给予DMSO; Qu40组, 40×10-6 mol/L的Qu; Qu80组, 80×10-6 mol/L的Qu; Qu160组, 160×10-6 mol/L的Qu.
1.2.1 MTT试验: 参见文献[10], 以492 nm波长测定活细胞的吸光度(A), 增生率(PR) = 实验组A值/溶剂对照组A值×100%.
1.2.2 细胞周期相及凋亡检测: 实验各组细胞处理72 h, 收获细胞, 700 mL/L冷乙醇固定, RNase消化, 碘化丙啶(PI)染色, 流式细胞仪检测.
1.2.3 Caspase-3的蛋白检测: 细胞生长于小盖玻片上, 多聚甲醛固定, 血清封闭, 加一抗于37 ℃孵育50 min, 按SABC试剂盒操作, DAB显色, 脱水、透明, 显微镜观察并照相及数据分析.
1.2.4 RT-PCR检测Caspase-3、bax、bcl-2 mRNA: 实验各组细胞处理72 h, 收获细胞, 用Turipure试剂一步法提取各组细胞总RNA, 逆转录为cDNA置-80 ℃备用. 引物由上海生工生物公司合成, Caspase-3: 上游5'-CAAACTTTTTCAGAGGGGATCG-3', 下游5'-GCATACTGTTTCAGCATGGCAC-3', 扩增产物272 bp; bcl-2: 上游5'-TGTGGCCTTCTTTGAGTTCG-3', 下游5'-TCACTTGTGGCTCAGATAAGC-3', 扩增产物280 bp; bax: 上游5'-TCCACCAAGAAGCTGAGCGA-3', 下游5'-GTCCAGCCCATGATGGTTCT-3', 扩增产物257 bp; β-actin: 上游5'-ATCCATCCGACATTGAAGT-3', 下游5'-CTCTAAGTTGCCAGCCCT-3', 扩增产物449 bp. 取样本总cDNA 3 μL、上游和下游引物各1.5 μL, 依次加入试剂盒其他成分. 反应条件: 94 ℃灭活40 s, 60 ℃退火40 s, 72 ℃延伸40 s, 22个循环, 20 g/L琼脂糖电泳, 照相、分析.
统计学处理 采用SPSS10.0软件进行单因素方差分析.
40×10-6 mol/L的Qu能促进HT-29细胞增生; 80×10-6 mol/L 的Qu能抑制细胞增生; 160×10-6 mol/L 的Qu对细胞增生的抑制作用更明显(表1). 40×10-6, 80×10-6, 160×10-6 mol/L 的Qu作用72 h, HT-29细胞的增生率分别为111.8%, 64.6%, 26.0%, 80×10-6, 160×10-6 mol/L Qu抑制HT-29细胞增生呈现时间-效应关系(图1).
流式细胞分析结果显示, Qu作用HT-29后, 40×10-6 mol/L Qu对HT-29结肠癌的细胞周期影响不大, 但80×10-6 和160×10-6 mol/L Qu主要将HT-29结肠癌细胞阻滞于G0/G1期, 并且细胞凋亡明显增加(表2).
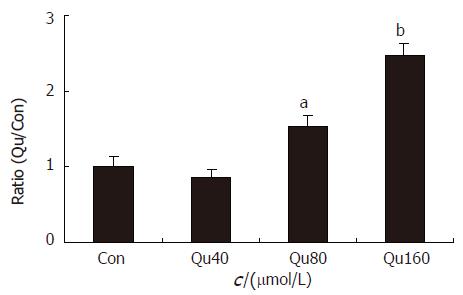
80×10-6和160×10-6 mol/L Qu能促进HT-29结肠癌细胞中Caspase-3蛋白表达, 并呈剂量-效应关系, 但40×10-6 mol/L 对HT-29结肠癌细胞中Caspase-3蛋白表达影响不大(图2, 3).
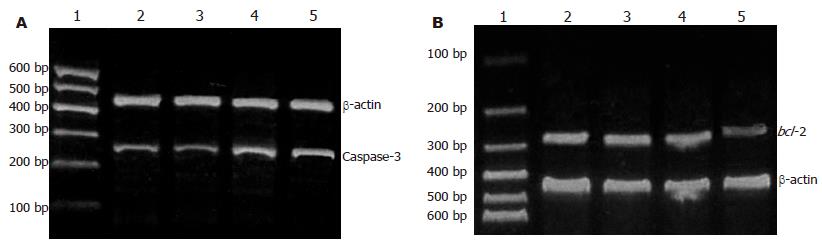
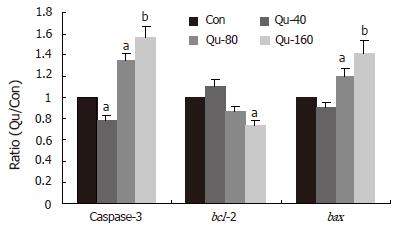
40×10-6 mol/L槲皮素能降低HT-29细胞Caspase-3的表达, 但80×10-6, 160×10-6 mol/L槲皮素能激活细胞中Caspase-3和bax mRNA表达, 并呈剂量-效应关系(图4A, B).
RT-PCR的半定量分析以凝胶成像系统的分析软件Q1来分析其灰度值, 每实验重复3次, 设Control组目的条带/β-actin为I0, Qu组的目的条带/β-actin值为I, 以I/I0值为半定量结果, 各组间进行单因素方差分析, 结果显示, 40×10-6 mol/L槲皮素能明显降低HT-29细胞中Caspase-3的表达, 但80×10-6 mol/L和160×10-6 mol/L槲皮素能明显激活细胞中Caspase-3和bax mRNA表达, 明显降低bcl-2的表达, 并呈剂量-效应关系(图5).
结肠癌是消化道常见的恶性肿瘤, 发病年龄多见于40-70岁, 其发病率在我国仅次于胃癌和食管癌. 结肠癌发病率在北美、西欧较高, 美国结肠癌占全部癌死亡原因的第二位. 近年来的调查结果显示, 结肠癌的患者逐渐增多, 尤其是城市患者数量迅速上升, 因此, 研究结肠癌的防治具有非常重要的实用价值. 槲皮素是广泛存在于水果、蔬菜、种子、核桃、茶和红酒中的一种天然黄酮类化合物, 具有雌激素效应[1-2,11-13]. 研究表明Qu能诱导肺腺癌A549[4,14]、白血病K562细胞及HL-60细胞凋亡[2,15], 抑制肺癌A549、乳腺癌MCF-7增生[9,14], 有逆转胃癌多药耐药性的效应[16], Qu通过下调HT-29细胞中MMP-7前蛋白的表达降低肿瘤的转移和侵袭活力[17], 也通过下调EGFR和cyclinD1的表达影响细胞增生的信号传导, 抑制细胞的增生[18-19]. 但也有不同报道, Qu对HT-29细胞的增生表现出双向性, 低浓度(<70×10-6 mol/L)时能促进结肠癌HT-29和乳腺癌MCF-7细胞增生, 但高浓度(>80×10-6 mol/L)却抑制HT-29和MCF-7细胞的增生[9].
细胞增生依赖于细胞周期的顺利进行, 该过程受G1/S、G2/M两个关健点调控. 本结果显示, 40×10-6 mol/L的Qu能促进HT-29细胞的增生, 但Qu对细胞周期相和细胞凋亡的影响均不大. 低浓度的槲皮素能促进HT-29结肠癌细胞增生[1], 可能与其具有弱雌激素活性相关, 因为低浓度的槲皮素、三羟异黄酮能促进乳腺癌MCF-7细胞的增生[12], 而且进食富含黄酮类化合物的大豆食品具有促乙状结肠细胞增生作用[20]. 80×10-6 mol/L和160×10-6 mol/L的Qu则抑制HT-29的增生, 细胞阻滞于G0/G1期, 且结肠癌HT-29细胞出现明显的亚G0/G1峰(凋亡峰), 细胞凋亡明显增加, 这些结果与槲皮素联合阿霉素作用MCF-7移植瘤将细胞阻滞于G1/S节点, 最终抑制移植瘤细胞增生相一致[21]. 但与Qu作用肺癌NCI-H209细胞及前列腺癌PC-3细胞, 将细胞阻滞于G2/M节点不同, 这可能与采用的细胞株不同有关[22-23]. 高浓度的的槲皮素、三羟异黄酮能抑制乳腺癌MCF-7细胞的增生[9]. 上述结果表明槲皮素对HT-29结肠癌细胞作用具有双向性.
肿瘤的生长是由于细胞的增生和凋亡失衡而造成的, Qu能通过影响结肠癌细胞中调控细胞生长、分化和凋亡过程中的多种基因和蛋白的表达, 调节肿瘤的发生和发展. bcl-2和bax属于bcl-2家族, 共同调控细胞的凋亡过程, 其中bcl-2为抗凋亡基因, bax为促凋亡基因. Caspase-3是介导细胞凋亡过程最早出现改变的一类蛋白水解酶, 是细胞凋亡执行的重要效应因子, 其量增加会促进细胞凋亡. 当细胞中bax表达增高、bcl-2表达降低, 导致Caspase-3表达增加, 细胞凋亡增加. 结肠癌中Caspase-3, bcl-2和bax均呈高表达, 其增加表达与组织分级相关. 研究报道茶多酚和茶色素通过明显抑制人肝癌HepG2细胞中bcl-2表达, 诱导bax表达, 促进细胞凋亡[24]. 中药复方剂肠复康通过提高移植瘤中Caspase-3的表达和bax/bcl-2表达比值, 诱导人结肠癌HT-29裸鼠移植瘤细胞的凋亡[25]. Quercetin通过诱导白血病K562细胞使细胞呈现出明显的核固缩、核凝集等细胞凋亡形态学改变, Caspase-3酶活性明显升高, 最终导致细胞凋亡增加[4]. Qu通过下调bcl-2、bcl-x的表达, 上调bax和Caspase-3的表达, 增加肺癌NCI-H209细胞及前列腺癌PC-3细胞的凋亡[22-23]. 本结果显示80×10-6 mol/L和160×10-6 mol/L 的Qu通过明显增加HT-29细胞中bax mRNA的表达, 降低bcl-2 mRNA的表达, 激活肠癌HT-29细胞中Caspase-3 mRNA和蛋白的表达, 诱导细胞凋亡明显增加, 最终表现出抗肿瘤效应. 40×10-6 mol/L的Qu虽然能增加Caspase-3 mRNA的表达, 但其蛋白的表达未见明显增加, 最终导致HT-29细胞凋亡改变不明显, 这与Qu能降低HT-29细胞中bcl-2表达, 增加细胞中Caspase-3蛋白表达水平相一致[26]. bax mRNA表达增加, 但Bax蛋白表达并没有明显改变, 这可能是由于Qu对HT-29细胞中bax的转录水平影响较大, 而对Bax蛋白的翻译过程影响不大.
总之, 80×10-6和160×10-6 mol/L的Qu能明显增加bax mRNA的表达, 降低bcl-2 mRNA的表达, 激活Caspase-3 mRNA和蛋白的表达, 细胞阻滞于G0/G1, 最终抑制癌HT-29细胞的增生, 细胞凋亡增加, 表现出抗肿瘤效应. 40×10-6 mol/L的Qu能促进HT-29细胞的增生, 其机制是否与槲皮素的雌激素活性相关, 有待进一步研究.
高浓度Qu能抑制多种肿瘤细胞的增生, 通过影响Caspase-3, bcl-2, bax, EGFR等mRNA及其蛋白的表达从而诱导多种肿癌细胞凋亡. Qu能促进结肠癌HT-29细胞凋亡, 其分子机制不十分清楚.
本文观察了Qu对HT-29细胞增生、凋亡的影响, 特别是观察了Caspase-3, bcl-2, bax mRNA及其蛋白的表达的改变, 从凋亡转录水平探讨Qu影响细胞凋亡的可能分子机制.
应进一步从体内证实Qu对结肠癌增生和凋亡的影响, 为含Qu的食物或药物防治结肠癌提供充实的理论依据.
编辑: 潘伯荣 电编:韩江燕
| 1. | Wenzel U, Herzog A, Kuntz S, Daniel H. Protein expression profiling identifies molecular targets of quercetin as a major dietary flavonoid in human colon cancer cells. Proteomics. 2004;4:2160-2174. [PubMed] |
| 2. | Sampson L, Rimm E, Hollman PC, de Vries JH, Katan MB. Flavonol and flavone intakes in US health professionals. J Am Diet Assoc. 2002;102:1414-1420. [PubMed] |
| 6. | Pawlikowska-Pawlega B, Jakubowicz-Gil J, Rzymowska J, Gawron A. The effect of quercetin on apoptosis and necrosis induction in human colon adenocarcinoma cell line LS180. Folia Histochem Cytobiol. 2001;39:217-218. [PubMed] |
| 8. | Chen YC, Shen SC, Chow JM, Ko CH, Tseng SW. Flavone inhibition of tumor growth via apoptosis in vitro and in vivo. Int J Oncol. 2004;25:661-670. [PubMed] |
| 9. | van der Woude H, Gliszczynska-Swiglo A, Struijs K, Smeets A, Alink GM, Rietjens IM. Biphasic modulation of cell proliferation by quercetin at concentrations physiologically relevant in humans. Cancer Lett. 2003;200:41-47. [PubMed] |
| 11. | Leung LK, Po LS, Lau TY, Yuen YM. Effect of dietary flavonols on oestrogen receptor transactiva-tion and cell death induction. Br J Nutr. 2004;91:831-839. [PubMed] |
| 12. | van der Woude H, Ter Veld MG, Jacobs N, van der Saag PT, Murk AJ, Rietjens IM. The stimulation of cell proliferation by quercetin is mediated by the estrogen receptor. Mol Nutr Food Res. 2005;49:763-771. [PubMed] |
| 13. | Virgili F, Acconcia F, Ambra R, Rinna A, Totta P, Marino M. Nutritional flavonoids modulate estro-gen receptor alpha signaling. IUBMB Life. 2004;56:145-151. [PubMed] |
| 14. | Nguyen TT, Tran E, Nguyen TH, Do PT, Huynh TH, Huynh H. The role of activated MEK-ERK pathway in quercetin-induced growth inhibi-tion and apoptosis in A549 lung cancer cells. Carcino-genesis. 2004;25:647-659. [PubMed] |
| 15. | Shen SC, Chen YC, Hsu FL, Lee WR. Differential apoptosis-inducing effect of quercetin and its glyco-sides in human promyeloleukemic HL-60 cells by alternative activation of the Caspase 3 cascade. J Cell Biochem. 2003;89:1044-1055. [PubMed] |
| 17. | Kawabata K, Murakami A, Ohigashi H. Nobiletin, a citrus flavonoid, down-regulates matrix metallo-proteinase-7 (matrilysin) expression in HT-29 human colorectal cancer cells. Biosci Biotechnol Biochem. 2005;69:307-314. [PubMed] |
| 18. | Kern M, Tjaden Z, Ngiewih Y, Puppel N, Will F, Dietrich H, Pahlke G, Marko D. Inhibitors of the epidermal growth factor receptor in apple juice extract. Mol Nutr Food Res. 2005;49:317-328. [PubMed] |
| 19. | Kaneuchi M, Sasaki M, Tanaka Y, Sakuragi N, Fujimoto S, Dahiya R. Quercetin regulates growth of Ishikawa cells through the suppression of EGF and cyclin D1. Int J Oncol. 2003;22:159-164. [PubMed] |
| 20. | Adams MR, Golden DL, Williams JK, Franke AA, Register TC, Kaplan JR. Soy protein containing isoflavones reduces the size of atherosclerotic plaques without affecting coronary artery reacti-vity in adult male monkeys. J Nutr. 2005;135:2852-2856. [PubMed] |
| 22. | Yang JH, Hsia TC, Kuo HM, Chao PD, Chou CC, Wei YH, Chung JG. Inhibition of lung cancer cell growth by quercetin glucuronides via G2/M arrest and induction of apoptosis. Drug Metab Dispos. 2006;34:296-304. [PubMed] |
| 23. | Vijayababu MR, Kanagaraj P, Arunkumar A, Ilan-govan R, Aruldhas MM, Arunakaran J. Querc-etin-induced growth inhibition and cell death in prostatic carcinoma cells (PC-3) are associated with increase in p21 and hypophosphorylated retinoblas-toma proteins expression. J Cancer Res Clin Oncol. 2005;131:765-771. [PubMed] |
| 26. | Kim WK, Bang MH, Kim ES, Kang NE, Jung KC, Cho HJ, Park JH. Quercetin decreases the expres-sion of Erbb2 and Erbb3 proteins in HT-29 human colon cancer cells. J Nutr Biochem. 2005;16:155-162. [PubMed] |