修回日期: 2005-12-05
接受日期: 2005-12-24
在线出版日期: 2006-04-18
目的: 探讨ASC(apoptosis-associated speck-like protein containing a Caspase recruitment domain)在胰腺炎肺损伤发病机制中的作用及中药清胰汤对胰腺炎肺损伤大鼠ASC及其相关的细胞因子表达的影响.
方法: SD大鼠40只, 随机分4组: 假手术组、胰腺炎肺损伤组、清胰汤治疗组、善宁治疗组. 采用15 g/L去氧胆酸钠逆行注入胰胆管诱发胰腺炎肺损伤模型. 通过自动生化分析仪检测大鼠血清淀粉酶; 采用ELISA法测定血清IL-1β水平; RT-PCR检测肺组织ASC mRNA的表达; 免疫组织化学法检测肺组织和胰腺组织ASC蛋白的表达. 通过检测肺组织髓过氧化物酶(MPO)活性、肺湿/干质量比值和肺组织病理切片判定肺损伤程度.
结果: 胰腺炎肺损伤组血清淀粉酶和IL-1β水平较假手术组显著升高(77632±5934 nkat/L vs 16303±1450 nkat/L, P<0.01和386.26±50.54 ng/L vs 99.11±18.43 ng/L, P<0.01). 清胰汤治疗组血清淀粉酶(17420±1867 nkat/L)和IL-1β(105.23±20.21 ng/L)水平较肺损伤组血清淀粉酶(77632±5934 nkat/L, P<0.01)和IL-1β水平(386.26±50.54 ng/L, P<0.01)明显下降. 善宁治疗组血清淀粉酶(20437±123 nkat/L)和IL-1β水平(109.63±19.98 ng/L)较肺损伤组血清淀粉酶(77632±5934 nkat/L, P<0.01)和IL-1β水平(386.26±50.54 ng/L, P<0.01)明显下降. 假手术组肺组织内ASC mRNA表达较弱. 胰腺炎肺损伤组肺组织及胰腺组织内ASC蛋白表达较假手术组显著上调, 其灰度值有显著性差异(24.86±5.23 vs 54.12±7.91, P<0.01和25.46±4.21 vs 52.32±8.10, P<0.01), 清胰汤治疗组两者表达显著下调(48.97±7.45 vs 24.86±5.23, P<0.01和49.48±8.13 vs 25.46±4.21, P<0.01). 善宁治疗组两者的表达亦显著下调(48.69±5.87 vs 24.86±5.23, P<0.01和49.11±6.41 vs 25.46±4.21, P<0.01). 清胰汤治疗组和善宁治疗组肺组织MPO活性减低(5.33±0.50 nkat/L vs 18.67±1.17 nkat/L, P<0.01和5.16±0.83 nkat/L vs 18.67±1.17 nkat/L, P<0.01), 肺湿/干质量比值下降(7.02±0.34 vs 9.98±0.47, P<0.01和6.78±0.33 vs 9.98±0.47, P<0.01), 肺组织损害程度明显减轻.
结论: ASC在大鼠胰腺炎肺损伤发病机制中起到一定的作用, 中药清胰汤通过下调ASC及其相关细胞因子IL-1β的表达起到治疗胰腺炎肺损伤的作用.
引文著录: 任双义, 陈海龙. ASC在大鼠胰腺炎肺损伤发病中的作用及中药清胰汤对其表达的影响. 世界华人消化杂志 2006; 14(11): 1058-1063
Revised: December 5, 2005
Accepted: December 24, 2005
Published online: April 18, 2006
AIM: To study the pathogenesis of ASC (apop-tosis-associated speck-like protein containing a Caspase recruitment domain) in acute lung injury (ALI) induced by severe acute pancreatitis (SAP) and the effect of Chinese medicine Qingyitang on the expression of ASC and cytokines in rats.
METHODS: Forty Sprague Dawley (SD) rats were randomized into four groups: sham operation group (SHAM, n = 10), ALI models (ALI, n = 10), ALI + Sandostatin (SS, n = 10), ALI + Qingyitang (QYT, n = 10). ALI during SAP was induced by retrograde infusion of 15 g/L sodium deoxycholate into the bili-pancreatic duct in SD rats. All the rats were killed 24 hours after operation and treatment. Serum amylase was measured by an automated HITACHI analyzer. The level of myeloperoxidase (MPO) in pulmonary tissues was measured by enzyme chemistry assay. Serum interleukin-1β (IL-1β) protein was measured by enzyme-linked immunosorbent assay (ELISA). The expression of ASC mRNA and protein in pulmonary and pancreatic tissues were detected by reverse transcription polymerase chain reaction (RT- PCR) and immunohistochemistry, respectively. The severity of pulmonary injuries was evaluated by MPO, the ratio of wet to dry lung tissues and pathological changes of rat pulmonary tissues.
RESULTS: The serum amylase and IL-1β protein levels were increased significantly in group ALI in comparison with those in SHAM group, respectively (77632 ± 5934 nkat/L vs 16303 ± 1450 nkat/L and 386.26 ± 50.54 ng/L vs 99.11 ± 18.43 ng/L, both P < 0.01), but they were decreased significantly in QYT group (17420 ± 1867 nkat/L vs 77632 ± 5934 nkat/L, 105.23 ± 20.21 ng/L vs 386.26 ± 50.54 ng/L, both P < 0.01) and group SS (20437 ± 123 nkat/L vs 77632 ± 5934 nkat/L and 109.63 ± 19.98 ng/L vs 386.26 ± 50.54 ng/L, both P < 0.01) as compared with those in ALI group. The expression of ASC mRNA and protein were highly up-regulated in ALI group as compared with those in SHAM group (24.86 ± 5.23 vs 54.12 ± 7.91, P < 0.01), but they were down-regulated in QYT group (49.48 ± 8.13 vs 24.86 ± 5.23, P < 0.01) and SS group (48.69 ± 5.87 vs 24.86 ± 5.23, P < 0.01). The level of MPO (18.67 ± 1.17 nkat/g vs 4.68 ± 0.33 nkat/g, P < 0.01), the ratio of wet to dry lung tissues (9.98 ± 0.47 vs 6.32 ± 0.28, P < 0.01) and pathological changes of rat pulmonary tissues were increased significantly in ALI group in comparison with those in SHAM group, correlating with the severity of SAP, but they were decreased in QYT group (5.33 ± 0.50 nkat/g vs 18.67 ± 1.17 nkat/g and 7.02 ± 0.34 vs 9.98 ± 0.47, both P < 0.01) and group SS (5.16 ± 0.83 nkat/g vs 18.67 ± 1.17 nkat/g and 6.78 ± 0.33 vs 9.98 ± 0.47, both P < 0.01).
CONCLUSION: The expression of ASC plays an important role in the pathogenesis of ALI induced by SAP. Qingyitang can protect lung from ALI induced by SAP by decreasing the expression of ASC and release of IL-1β in rats.
- Citation: Ren SY, Chen HL. Role of apoptosis-associated speck-like protein containing a Caspase recruitment domain in pathogenesis of lung injury induced by severe acute pancreatitis in rats and effect of Qingyitang on its expression. Shijie Huaren Xiaohua Zazhi 2006; 14(11): 1058-1063
- URL: https://www.wjgnet.com/1009-3079/full/v14/i11/1058.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i11.1058
重症急性胰腺炎(severe acute pancreatitis, SAP)合并急性肺损伤(acute lung injury, ALI)的死亡率较高[1-2], 其发病机制尚未完全明了. 研究证明, 其发病机制与细胞因子特别是白介素-1β(IL-1β)的过度产生有重要关系[3-4], 而IL-1β的产生依赖于半胱氨酸蛋白酶-1(又称IL-1转化酶, Caspase-1/ICE)[5-7], Caspase-1的活化有赖于ASC(apoptosis-associated speck-like protein containing Caspase recruitment domain)[8-12], ASC是否在SAP时ALI的发病机制中起一定的作用, 目前尚未见报道. 我们应用大鼠制成SAP诱发ALI模型, 探讨ASC在SAP诱发ALI时的发病机制, 并应用中药清胰汤对胰腺炎肺损伤大鼠进行治疗, 通过观察ASC表达的变化, 探讨清胰汤治疗胰腺炎肺损伤的机制, 为临床更好的应用清胰汤治疗胰腺炎肺损伤奠定理论基础.
健康SD大鼠40只(大连医科大学实验动物中心提供), 雌雄不限, 清洁级, 体质量220-250 g. 随机分为4组, 每组10只大鼠: 假手术组(SHAM组), 胰腺炎肺损伤组(ALI组), 中药清胰汤治疗组(QYT), 善宁治疗组(SS). 以15 g/L去氧胆酸钠逆行注入胰胆管诱发胰腺炎肺损伤模型. 术前动物禁食12 h, 不禁水. 用20 g/L氯胺酮(100 mg/kg)腹腔注射麻醉. 无菌条件下正中切口入腹, 在十二指肠乳头对侧肠壁插入1 mL 小注射器针头经胆胰管十二指肠乳头开口入胆胰管, 同时在胆管出肝门处用小动脉夹夹闭, 逆行注入15 g/L去氧胆酸钠(1 mL/kg)30 s注射完毕. SHAM组剖腹后只翻动胰腺, 不注射药物. 清胰汤治疗组在造模后立即灌胃给清胰汤(清胰汤组成: 茵陈20 g、栀子20 g、大黄20 g、芒硝20 g、木香15 g、柴胡5 g、元胡15 g、白芍15 g、甘草6 g、当归15 g、双花20 g、连翘20 g, 由大连医科大学附属第二医院中药制剂室制成浓度为1 kg/L, 灭菌处理后置瓶装冰箱存放). 造模后12 h再次灌胃1次剂量: 10 mL/kg. 善宁治疗组: 分别于造模后立即皮下注射1次及造模后12 h再次皮下注射1次, 剂量: 20 μg/kg; 在制模后24 h, 下腔静脉采血3-4 mL, 离心(4000 r/min, 10 min), 获血清, 置-70 ℃冷藏备用. 取右肺下叶肺组织和相同部位胰腺组织行RT-PCR检测. 另取胰腺组织和右上叶肺组织甲醛固定、石蜡包埋.
1.2.1 肺湿/干质量比值测定: 动物放血致死后取左肺叶称湿质量, 置60 ℃烤箱连续烘烤24 h, 去除水分称肺干质量. 肺湿质量系数 = (肺湿质量-肺干质量)/肺干质量×100%.
1.2.2 肺组织MPO活性测定: 采用酶化学法, 按试剂盒(南京建成生物工程研究所提供)操作程序进行.
1.2.3 血清淀粉酶水平测定: 采用酶法, 由HITACHI自动生化分析仪测定.
1.2.4 RT-PCR检测肺组织ASC表达: 采用Trizol试剂(GibcoBRL公司提供)抽提大鼠新鲜肺组织总RNA. RT-PCR反应采用一步法(试剂盒由大连宝生物工程公司提供). PCR反应条件: 94 ℃预变性1 min, 98 ℃变性10 s, 55 ℃退火30 s, 72 ℃延伸70 s, 循环30次, 72 ℃延伸70 s, 最后降至4 ℃结束反应. ASC引物由大连宝生物公司合成, 引物序列如下: ASC(526 bp): 上游: 5'-CACGAGATGCCATCCTGGAC-3'; 下游: 5'-AAGGCCTCAAGGAACAAGT-3'. 将PCR产物在琼脂糖凝胶中电泳后采用凝胶成像系统摄影.
1.2.5 胰腺和肺组织ASC蛋白免疫组织化学检测采用S-P法: 用PBS代替一抗作为阴性对照. 结果判定标准: 每只大鼠胰腺和肺组织标本取两张切片置于Olympus多功能显微镜(Olympus BX51, Japan)观察并摄像. 在0.5 cm×1.0 cm的样品截面上, 每张切片随机选择5个高倍视野, 应用CA6300彩色图像分析系统进行定量灰度扫描, 求出给定面积内的灰度值. 染色愈深, 在监视器上愈暗, 灰度值愈小.
1.2.6 血清IL-1β定量测定: 采用ELISA法, 按试剂盒(B&C公司提供)操作程序进行.
统计学处理 所有数据以mean±SD表示. 通过SPSS11.0统计软件, 采用单因素方差分析对各组均数进行显著性检验, P<0.05具有显著性差异.
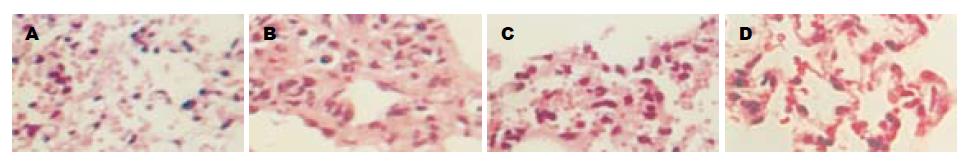
光镜下SHAM组肺组织正常, 而ALI组肺泡壁增厚, 肺间质水肿, 大量炎性细胞浸润. ALI模型组可见肺间质高度充血, 大部分肺泡间隔明显增宽, 肺泡腔部分融合, 部分萎缩. 肺间质大量中性粒细胞浸润, 尤以小静脉和小支气管周围多见. 部分小支气管上皮细胞脱落腔内有红细胞. 两治疗组肺组织炎症反应明显减轻(图1).
ALI组肺湿/干质量比值明显增加, 与对照组比有显著性差异(P<0.01), 两治疗组与ALI组比较有显著性差异(P<0.01), 而两组之间无明显差异(P>0.05, 表1).
| 组别 | n | 血淀粉酶(nkat/L) | 肺湿/干质量比 | ASC胰腺(灰度) | ASC肺脏(灰度) | 肺MPO(nkat/g) | IL-1β(pg/mL) |
| SHAM组 | 10 | 16 303±1450 | 6.32±0.28 | 52.32±8.10 | 54.12±7.91 | 4.68±0.33 | 99.11±18.43 |
| ALI组 | 8 | 77 632±5934d | 9.98±0.47d | 25.46±4.21d | 24.86±5.23d | 18.67±1.17d | 386.26±50.54d |
| QYT组 | 9 | 17 420±1867b | 7.02±0.34b | 48.97±7.45b | 49.48±8.13b | 5.33±0.50b | 105.23±20.21b |
| SS组 | 8 | 20 437±123b | 6.78±0.33b | 49.11±6.41b | 48.69±5.87b | 5.16±0.83b | 109.63±19.98b |
ALI组MPO活性明显增高, 与SHAM组比较差异有显著性(P<0.01). 而两治疗组明显下降, 与ALI组比较差异有显著性(P<0.01). 两治疗之间无显著性差异(表1).
SHAM组血清淀粉酶水平较低; ALI组血清淀粉酶水平显著升高, 与SHAM组相比, 其差异有显著性(P<0.01). 两治疗组血清淀粉酶水平较ALI组明显降低(P<0.01, 表1).
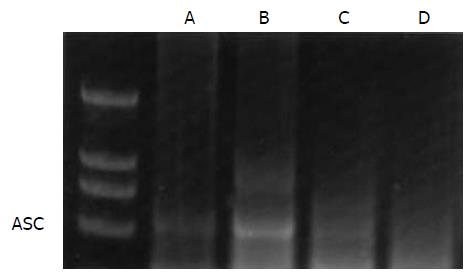
SHAM组肺组织内ASC mRNA表达较弱; ALI组肺组织内ASC mRNA的表达明显上调, 而两治疗组与ALI组比较表达明显下调, 两治疗组间ASC mRNA表达无明显差异(图2).
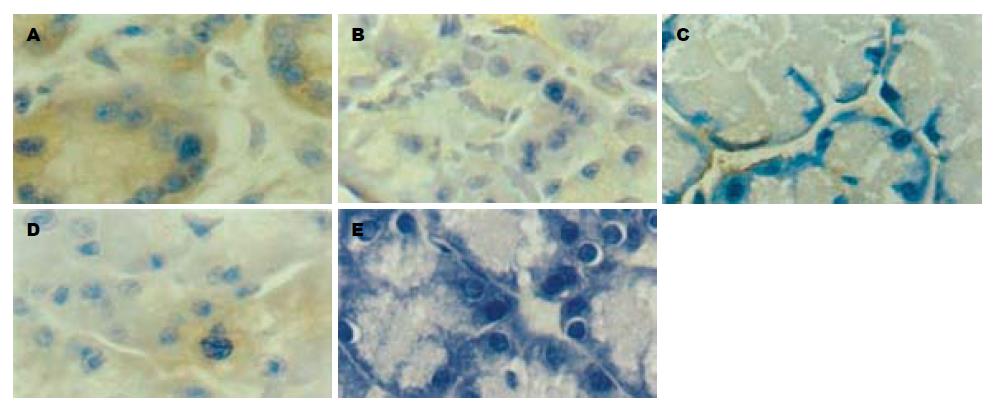
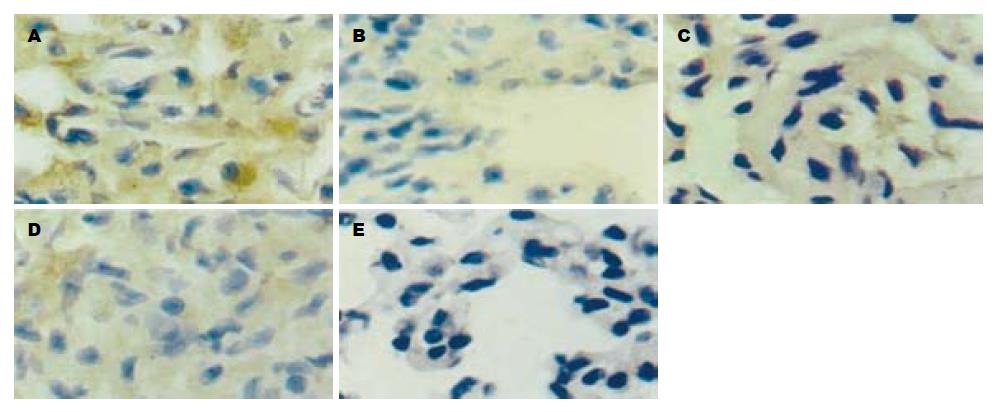
SHAM组胰腺组织和肺组织内可见ASC蛋白表达; ALI组胰腺和肺组织内ASC蛋白的表达明显上调, 与SHAM组比较, 其灰度值差异均具有显著性(P<0.01), 而两治疗组与ALI组比较差异有显著性(P<0.01), 两组间ASC蛋白表达的差异无显著性意义(P>0.05, 图3, 图4, 表1).
SHAM组血清IL-1β水平较低; ALI组血清IL-1β水平升高, 与SHAM组相比, 其差异有显著性(P<0.01). 两治疗组血清IL-1β水平较ALI组明显降低(P<0.01), 而两组之间无显著差异. 两治疗组与SHAM组之间无显著差异(表1).
SAP合并ALI的发病机制尚未完全明了. 目前认为, 重症急性胰腺炎实质上是一种严重的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 其机制是由于不同的致病因子引起胰腺腺泡细胞的损伤, 引发活性胰酶的释放和单核巨噬细胞的激活, 过度激活中性粒细胞和巨噬细胞, 释放大量炎症介质包括细胞因子, 再通过这些炎症介质网络, 引起连锁和放大效应, 即所谓的级联效应(cascades), 导致多器官损害, 特别是肺功能的损害. 在众多的炎症细胞因子中, IL-1β和TNF-α在SAP发病过程中起着重要的作用[3], IL-1β是SAP时导致肺损伤重要的细胞因子, 而IL-1β的活化有赖于半胱氨酸蛋白酶-1(又称白介素-1转化酶, Caspase-1/ICE). Caspase-1的主要功能之一是将分子量为31 kDa的IL-1β前体裂解为分子量为17 kDa的具有生物活性形式的IL-1β, 从而造成炎症反应. Caspase-1的这种参与炎症反应的功能已被很多学者证明, 特别是在急性胰腺炎中, 并且应用Caspase-1抑制物治疗炎症已取得了一定的效果[5-7]. Caspase-1作为炎症反应中的重要信号传导物质, 也具有活化形式和非活化形式, 在炎症反应过程中, Caspase-1前体转变成有活性的Caspase-1依赖于他的上游传导物质ASC[8-12]. ASC是近几年发现的新的蛋白质, 他能诱导Caspase-1的活化, 从而与炎症反应有关. 许多上皮细胞和白细胞、毛囊、外周血淋巴细胞都表达ASC. 在严重的炎症部位, 中性粒细胞表达ASC升高. ASC在Caspase-1信号途径中发挥活化因子的作用. 而IL-1β的分泌是Caspase-1活化的结果之一, ASC通过直接与Caspase-1前体或其CARD(Caspase-1 recruitment domain)作用, 增加IL-1β的分泌.
大量的实验证明了ASC能诱导Caspase-1的活化, 从而证明了他参与炎症反应过程. 但是, ASC是否在胰腺炎肺损伤发病机制中起一定的作用, 尚未见报道. 本文即是基于上述原理推测ASC在急性胰腺炎肺损伤发病机制中起到一定的作用, 因而设计了上述实验. 实验结果显示, ASC在胰腺炎肺损伤大鼠肺组织和胰腺组织中较假手术组表达明显增强, 同时伴有IL-1β和肺组织内MPO以及血清淀粉酶和肺湿/干质量比值明显增高, 从而证明了ASC在胰腺炎肺损伤发病机制中起到一定的作用. 通过15 g/L去氧胆酸钠逆行注入胰胆管诱发胰腺炎肺损伤模型发现, 血清IL-1β水平明显升高; 胰腺和肺组织ASC的表达显著增强, 同时, 血清淀粉酶水平增高. 免疫组化结果显示ASC染色阳性细胞主要位于胰腺组织坏死区域和肺内炎性细胞浸润区. 提示ASC的激活、IL-1β分泌增加与SAP时肺损伤有密切关系. 结合肺组织MPO水平及胰腺组织的病理形态学改变, 推测ASC裂解IL-1β前体使之分泌增加在SAP诱发肺损伤发病过程中均起到一定的作用. 具有活性的IL-1β发病早期在胰腺和肺组织内释放和合成, 是介导中性粒细胞和巨噬细胞引起组织损伤的重要炎症介质, 同时由于SAP的发生导致全身炎症反应综合征的出现, 诱使肺组织内浸润大量的中性粒细胞和巨噬细胞, 因而产生了大量的细胞因子, 特别是IL-1β的大量产生, 是导致肺损伤的重要因素之一. 因而, SAP时IL-1β产生的高低是判定胰腺炎肺损伤严重程度的重要指标.
临床上SAP的治疗是个难点, 目前通常采用个体化的综合治疗方案, 其中, 中医中药治疗SAP是一个很重要的方面, 临床上已有了肯定的疗效, 特别是中药清胰汤治疗胰腺炎, 经过广大中西医结合急腹症外科的临床科研工作者的不懈努力, 已经证实了清胰汤在治疗SAP方面的有效作用[13-14]. 中医理论认为, 肺与大肠相表里. 若肺气被邪毒所遏, 失其宣肃, 则急促息数. 传入阳明与肠道糟粕搏结, 肺气不通而浊气又不能从下而出, 扰乱了肺与大肠相表里的生理状态而出现急满症. 而清胰汤可泻下热结, 荡涤积滞, 通畅腑气. 其通腑利肠泻肺实, 使肺气得以宣发肃降. 清胰汤具有通里攻下的作用, 这在治疗SAP时具有积极的治疗效果. 他可以通过改善胃肠道的功能, 促进内毒素的排泄减少炎性介质和细胞因子的产生和吸收, 从而减轻全身重要器官的损害, 达到治疗目的. 中药清胰汤治疗胰腺炎肺损伤有报道[15], 但是其治疗机制研究较少. 清胰汤是否可以通过影响ASC及其激活的细胞因子达到治疗胰腺炎肺损伤的作用, 尚未见报道. 既然ASC在胰腺炎肺损伤发病中具有一定的作用, 那么应用中药清胰汤是否可以下调ASC的表达, 从而达到治疗胰腺炎的作用呢? 我们采用临床上常用的中药清胰汤方剂对胰腺炎肺损伤大鼠进行治疗, 通过设立阴性对照组(假手术组)和阳性对照组(善宁治疗组)观察以上指标来判定中药清胰汤是否可以通过减少细胞因子来治疗胰腺炎肺损伤, 判定其是否对ASC及其相关的细胞因子具有影响, 从而达到治疗胰腺炎肺损伤的目的. 善宁即生长抑素衍生物, 其化学名称奥曲肽, 具有通过影响细胞因子治疗SAP肺损伤的作用[16], 因而作为阳性对照组具有可靠性. 为了判定肺损伤程度, 我们通过测定肺组织内MPO活性和肺湿/干质量比值这两项反映肺损伤程度的指标来判定肺损伤程度是否与血清内IL-1β、肺组织内ASC mRNA和ASC蛋白的表达相平行, 并且通过检测肺组织病理切片来判定肺损伤程度是否与细胞因子的测定值具有一致性. 结果表明, 肺损伤的严重程度与血清IL-1β测得值以及肺组织内ASC mRNA和ASC蛋白的表达程度相平行, 并与血清内淀粉酶活性相一致, 并且肺组织内和胰腺组织内ASC蛋白表达相一致. 从实验结果看, 中药清胰汤可以减少血清内IL-1β, 下调肺组织内ASC mRNA和肺及胰腺组织内ASC蛋白的表达, 并且与降低肺组织内MPO活性和肺湿/干质量比值相平行. 从而提示, 减少血清内IL-1β, 下调肺组织内ASC mRNA和ASC蛋白的表达是中药清胰汤治疗胰腺炎肺损伤的重要机制之一.
急性胰腺炎肺损伤的发病机制与IL-1β大量释放关系密切, IL-1β的释放与Caspase-1有关, ASC具有激活Caspase-1的作用, 这一炎症反应过程已被实验证实. 但是, ASC是否通过激活Caspase-1增加IL-1β的释放导致胰腺炎肺损伤尚未见报道.
本文通过动物实验证实了ASC与胰腺炎肺损伤有关, 并通过药物干预探讨对胰腺炎肺损伤的治疗.
本研究为今后在治疗胰腺炎肺损伤中, 能够对炎症反应过程中早期阻断炎症反应通路(如ASC抑制物的研究)提供部分参考.
ASC: 含有Caspase补充结构域的、与凋亡有关的斑点样蛋白, 是炎症小体的重要组成部分. 他可以使无活性的Caspase-1前体转化为有活性的Caspase-1;
Caspase-1: 半胱氨酸蛋白酶又名白介素-1转化酶, 他可以使IL-1β前体转化为有活性的IL-1β, 参与炎症反应.
编辑: 张海宁 电编:张敏
| 1. | Mayerle J, Hlouschek V, Lerch MM. Current management of acute pancreatitis. Nat Clin Pract Gastroenterol Hepatol. 2005;2:473-483. [PubMed] |
| 2. | Surbatovic M, Jovanovic K, Radakovic S, Filipovic N. Pathophysiological aspects of severe acute pancreatitis-associated lung injury. Srp Arh Celok Lek. 2005;133:76-81. [PubMed] |
| 3. | Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respira-tory distress syndrome. J Pathol. 2004;202:145-156. [PubMed] |
| 4. | Mozo G, del Olmo ML, Caro-Paton A, Reyes E, Manzano L, Belmonte A, Alvarez-Mon M. Lung changes and cytokine levels in a model of experimental acute pancreatitis. Rev Esp Enferm Dig. 2002;94:53-66. [PubMed] |
| 5. | Paszkowski AS, Rau B, Mayer JM, Moller P, Beger HG. Therapeutic application of caspase 1/interleukin-1beta-converting enzyme inhibitor decreases the death rate in severe acute experimen-tal pancreatitis. Ann Surg. 2002;235:68-76. [PubMed] |
| 6. | Norman J, Yang J, Fink G, Carter G, Ku G, Denham W, Livingston D. Severity and mortality of experimental pancreatitis are dependent on interleukin-1 converting enzyme (ICE). J Interferon Cytokine Res. 1997;17:113-118. [PubMed] |
| 7. | Rau B, Paszkowski A, Lillich S, Baumgart K, Moller P, Beger HG. Differential effects of caspase-1/interleukin-1beta-converting enzyme on acinar cell necrosis and apoptosis in severe acute experimental pancreatitis. Lab Invest. 2001;81:1001-1013. [PubMed] |
| 8. | Srinivasula SM, Poyet JL, Razmara M, Datta P, Zhang Z, Alnemri ES. The PYRIN-CARD protein ASC is an activating adaptor for caspase-1. J Biol Chem. 2002;277:21119-21122. [PubMed] |
| 9. | Stehlik C, Lee SH, Dorfleutner A, Stassinopoulos A, Sagara J, Reed JC. Apoptosis-associated speck-like protein containing a caspase recruitment domain is a regulator of procaspase-1 activation. J Immunol. 2003;171:6154-6163. [PubMed] |
| 10. | Yu JW, Wu J, Zhang Z, Datta P, Ibrahimi I, Tanigu-chi S, Sagara J, Fernandes-Alnemri T, Alnemri ES. Cryopyrin and pyrin activate caspase-1, but not NF-kappaB, via ASC oligomerization. Cell Death Differ. 2006;13:236-249. [PubMed] |
| 11. | Yamamoto M, Yaginuma K, Tsutsui H, Sagara J, Guan X, Seki E, Yasuda K, Yamamoto M, Akira S, Nakanishi K. ASC is essential for LPS-induced activation of procaspase-1 inde-pendently of TLR-associated signal adaptor mole-cules. Genes Cells. 2004;9:1055-1067. [PubMed] |
| 12. | Bruey JM, Bruey-Sedano N, Newman R, Chandler S, Stehlik C, Reed JC. PAN1/NALP2/PYPAF2, an inducible inflammatory mediator that regulates NF-kappaB and caspase-1 activation in macrophages. J Biol Chem. 2004;279:51897-51907. [PubMed] |
| 13. | Li ZL, Wu CT, Lu LR, Zhu XF, Xiong DX. Traditio-nal Chinese medicine Qing Yi Tang alleviates oxygen free radical injury in acute necrotizing pan-creatits. World J Gastroenterol. 1998;4:357-359. [PubMed] |
| 14. | Li YY, Li XL, Yang CX, Zhong H, Yao H, Zhu L. Effects of Tetrandrine and QYT on ICAM-1 and SOD gene expression in pancreas and liver of rats with acute pancreatitis. World J Gastroenterol. 2003;9:155-159. [PubMed] |
| 16. | Paran H, Mayo A, Paran D, Neufeld D, Shwartz I, Zissin R, Singer P, Kaplan O, Skornik Y, Freund U. Octreotide treatment in patients with severe acute pancreatitis. Dig Dis Sci. 2000;45:2247-2251. [PubMed] |