修回日期: 2005-11-23
接受日期: 2005-12-02
在线出版日期: 2006-01-08
目的: 研究肝门阻断后大鼠肠道肌间神经丛内一氧化氮合酶(NOS)神经元表达的变化, 以探讨肝门阻断对肠道功能影响的神经机制.
方法: SD大鼠分成实验组(根据阻断时间分为肝门阻断20 min 组、40 min组及60 min组)和对照组, 取各组相同部位的小肠和结肠, 制作肠肌间神经丛标本行NADPH-d组化染色, 观察和比较各组NOS阳性神经元的分布密度和染色情况.
结果: 与对照组比较, 实验组小肠(28.89±5.49, 32.22±7.03, 36.89±8.58 vs 21.78±4.56, P<0.01)和结肠(34.22±8.82, 39.39±8.91, 44.61±9.94 vs 25.94±5.59, P<0.01)的肠肌间神经丛内NOS阳性神经元数量增多, 胞体大而染色深; 实验组之间比较, 肝门阻断60 min组的NOS阳性神经元数量多于肝门阻断20 min组(小肠: 36.89±8.58 vs28.89±5.49; 结肠: 44.61±9.94 vs 34.22±8.82, P<0.05), 肝门阻断60 min组和40 min组的NOS阳性神经元胞体较大, 染色较深, 但节间束NOS阳性神经纤维稀少.
结论: 肝门阻断会影响或损伤肠神经系统的NO能神经, 这可能是术后肠道运动功能障碍发生的神经机制.
引文著录: 张军明, 任艳华, 刘芬, 雷亚宁, 张婵, 钱旭. 肝门阻断对大鼠肠道肌间神经丛内NOS阳性神经元的影响. 世界华人消化杂志 2006; 14(1): 87-91
Revised: November 23, 2005
Accepted: December 2, 2005
Published online: January 8, 2006
AIM: To explore the nervous mechanism of intestinal function disorder after portal triad clamping through observing the changes of nitric oxide synthase (NOS) positive neuron expression in myenteric plexus of rat intestinal tract.
METHODS: Sprague Dawley rats were divided into experimental groups (portal triad clamping 20, 40, and 60 min group) and the control group. Then the specimens of intestinal myenteric plexus of small intestines and colons were collected and stained by nicotinamide adenine dinucleotide phosphate-diaphorase (NADPH-d) histochemistry.
RESULTS: In comparison with the control group, the numbers of NOS positive neurons of small intestinal (28.89 ± 5.49, 32.22 ± 7.03, 36.89 ± 8.58 vs 21.78 ± 4.56, P < 0.01) and colonic (34.22 ± 8.82, 39.39 ± 8.91, 44.61 ± 9.94 vs 25.94 ± 5.59, P < 0.01) myenteric plexus were significantly increased in the experimental groups, and the soma of NOS positive neurons were big and deeply stained. In the experimental groups, as compared with those in the 20 min group, the numbers of NOS positive neurons were significantly increased in the 60 min group (small intestine: 36.89 ± 8.58 vs 28.89 ± 5.49; colon: 44.61 ± 9.94 vs 34.22 ± 8.82, P < 0.05), and the soma of NOS positive neurons were bigger and more deeply stained in the 60 min group than that in the 40 min group, but the nerve fibers between ganglions were fewer in 60 min and 40 min group.
CONCLUSION: Intestinal motor dysfunction resulting from portal triad clamping is related to the nervous damage of entric nervous system.
- Citation: Zhang JM, Ren YH, Liu F, Lei YN, Zhang C, Qian X. Effects of portal triad clamping on nitric oxide synthase positive neurons in myenteric plexus of rat intestinal tract. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 87-91
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/87.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.87
大量研究表明, 一氧化氮合酶(NOS)广泛分布于胃肠道, 其产物一氧化氮(NO)是一种神经递质和信使分子, 具有多重生理功能, 在神经传导、胃肠保护、内分泌调节和宿主防御机制中起重要作用, 广泛参与胃肠生理功能[1,2]. NO是以左旋精氨酸为底物, 由NOS催化生成, 还原型尼克酰胺腺嘌呤二核苷酸黄递酶(NADPH-d)组织化学方法是一种简单易行的显示NOS神经的有效方法[3,4]. 肝门阻断是肝脏外科手术中常用的有效止血方法, 肝门阻断后可使肝脏及全身各脏器产生一系列病理生理改变, 在以往的研究中, 多集中在肝门阻断后对肝脏的损伤, 而由于缺血再灌注损伤和血液动力学障碍所造成的肝外多器官损伤的研究相对较少[5-8], 尤其是有关肠神经系统(enteric nervous system, ENS)的影响未见报道. 我们应用NADPH-d组织化学技术, 观察肝门阻断后大鼠肠道肌间神经丛内NOS的变化, 来探讨肝脏外科手术后肠道运动功能障碍形成的神经机制.
♂SD大鼠(温州医学院实验动物中心提供, 清洁级)24只, 质量165-202 g. 将大鼠随机分为对照组(n = 6)和实验组(n = 18), 实验前禁食16 h, 自由饮水. 实验组大鼠10 g/L水合氯醛(0.2 mL/100 g)腹腔注射麻醉后, 固定四肢, 无菌条件下取腹部正中切口约2 cm, 钝性分离肝门十二指肠韧带, 用微型血管钳夹闭门静脉, 切口用无菌37 ℃湿润生理盐水纱布覆盖, 根据阻断时间分为肝门阻断20 min组、肝门阻断40 min组、肝门阻断60 min组, 每组6只; 正常对照组只游离肝门十二指肠韧带, 不阻断肝门.
1.2.1 取材与制片: 各组大鼠手术后, 按37 ℃ 9 g/L氯化钠溶液、4 ℃含10 g/L氯化钙的40 g/L甲醛液顺序心脏灌流固定, 迅速剖腹取距幽门约2 cm的一段长约3 cm的小肠(代表上消化道)和距回盲部2 cm的一段长约3 cm的结肠(代表下消化道), 用生理盐水冲去肠内容物, 用丝线结扎肠管两端, 肠腔内注入10 g/L氯化钙的40 g/L甲醛液使之稍扩张, 再置于该液4 ℃中固定约10 h后取出, 用0.01 mol/L PBS(pH7.4)冲洗, 切取标本的近端段肠管长约1 cm, 将一粗细合适的玻璃棒插入肠管, 然后用眼科镊子在肠系膜附着处沿肠管纵轴划痕, 用镊尖沿划痕轻轻剥离纵肌层(神经丛附着其上), 制成肌间神经丛铺片标本, 保存于0.01 mol/L PBS中待染;标本的远端段做常规HE染色的切片.
1.2.2 NOS组织化学染色: NADPH-黄递酶(NADPH-diaphorase, NDP)组化染色[9]基本过程如下: 将已经制作好的各组肠外纵肌全层铺片标本用0.01 mol/L PBS(pH7.4)漂洗3次后, 移入由0.1 mol/L PB(pH8.0)配制的新鲜孵育液中, 内含1 g/L β-NADPH(购自Sigma公司)、0.2 g/L氯化硝基四氮唑蓝(NBT)、3 g/L TritionX-100, 37 ℃孵育45 min, 0.01 mol/L PBS(pH7.4)洗3次, 贴片、铺平、牵拉率小于1:1.1, 晾干后逐级酒精脱水, 二甲苯透明, 中性树胶封片. 设对照实验, 孵育液中不加入β-NADPH.
1.2.3 结果观察: OLympus光学显微镜下观察: 肝门阻断后肠壁的组织学改变, 各组NOS阳性神经的染色强弱, 同时也计数每组标本18个200倍视野内NOS阳性神经元的数量, 以比较各组NOS阳性神经元的分布密度.
统计学处理 数据以mean±SD表示, 多组间比较采用完全随机设计方差分析, 进一步采用均数间两两比较的LSD法. SPSS10.0统计软件包计算机处理.
实验组在肝门阻断前肠道颜色红润, 血流阻断后逐渐从红润变为紫红色, 并随阻断时间的延长, 颜色加深. HE染色的切片观察表明, 对照组为正常肠道管壁结构, 实验组肠壁各层有比较明显的淤血、出血, 小肠绒毛固有层水肿, 黏膜上皮有脱落坏死, 并随阻断时间的延长而加重.
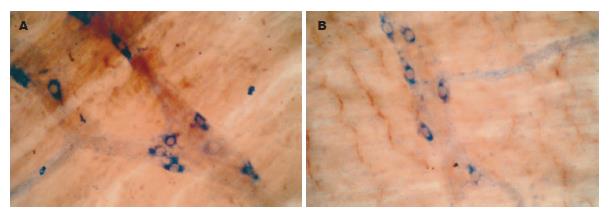
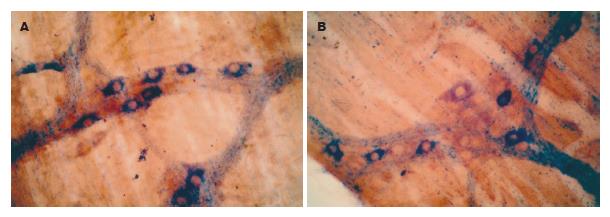
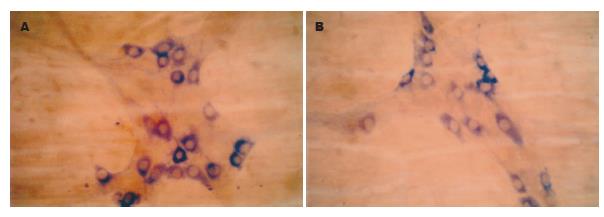
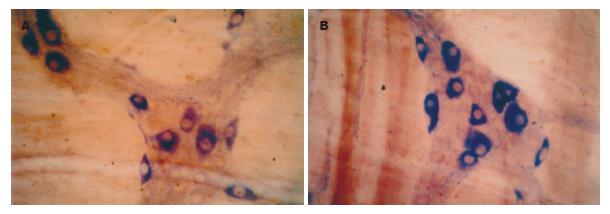
NADPH-d染色的阳性产物为蓝色沉淀, 阳性神经元胞质蓝色, 胞核不着色, 对照实验结果为阴性. 肌间神经丛由神经节、节间束及神经纤维纵横交织组成, 染色呈蓝色, 神经节多为星形、长带形或不规则形, 大小不等, 一般与纵肌相垂直, 呈网格状排列, NOS阳性神经元的胞体大小不等, 形态多样, 有卵圆形、梭形或不规则形. 正常对照组的小肠和结肠, 其壁内NOS阳性神经元体积较小, 节间束的NOS阳性神经纤维纤细而较清晰(图1A-B); 实验组中, 肝门阻断20 min组, 大鼠的肠肌间神经丛内NOS阳性神经元的胞体大而染色深, 节间束的NOS阳性神经纤维粗大而明显(图2A-B), 肝门阻断40 min组和60 min组的NOS阳性神经元的胞体较大, 染色较深, 但节间束NOS阳性神经纤维稀少, 使节间束变稀疏而不明显(图3A-B, 图4A-B).
各实验组与对照组比较, 大鼠小肠和结肠壁内NOS神经元数量增多(P<0.01), 差异有统计学意义(表1); 各实验组比较, 随阻断时间延长, NOS阳性神经元数量呈增多趋势, 其中肝门阻断60 min组比肝门阻断20 min组增加明显, 差异有统计学意义(P<0.05)(表1).
| 组别 | 小肠 (个/200倍视野) | 结肠 (个/200倍视野) |
| 正常对照组 | 21.78±4.56 | 25.94±5.59 |
| 肝门阻断 20 min | 28.89±5.49b | 34.22±8.82b |
| 肝门阻断 40 min | 32.22±7.03b | 39.39±8.91b |
| 肝门阻断 60 min | 36.89±8.58ab | 44.61±9.94ab |
| F值 | 16.217 | 15.875 |
胃肠运动功能是消化道最重要的功能之一, 其调节机制非常复杂, 包括中枢神经系统的作用、肠神经系统的作用以及众多神经递质及神经调节物的调节, 其中ENS起主要作用. ENS的神经元相互连接形成独立的具有与脑和脊髓类似的整合和处理信息功能机制的神经系统, 自然选择在消化道进化形成了一个壁内的"微型脑"以就近控制和调节分布于数米长的胃肠道中的效应系统, 而不是将这些神经控制都交给中枢, ENS中的NOS神经元释放的NO是胃肠道最主要的抑制性神经递质, 能引起胃肠道平滑肌松弛, 参与调节胃肠运动功能和内脏感觉[2,10,11]. 研究表明, 肠动力疾病的肠壁内NOS神经的表达异常[3,12], 能促进或改善肠道氮能神经功能的方法可以改善胃肠动力障碍的状况[13,14], 胃壁肌间神经丛内NOS增多或过少均可导致明显的胃电节律失常[15].
肝门阻断可以减少肝脏外科术中的出血, 但同时也会造成肝脏缺血和门静脉回流受阻所导致的内脏器官淤血, 肝门阻断对小肠的影响及其造成的肠源性毒物对机体的作用, 可使心、肝、肺、肾等多器官功能发生损害, 引起多器官系功能障碍和衰竭, 直接影响到术后效果及生存率, 由于肠道结构、功能及内容物的特殊性, 其与肝脏外科术后并发症的关系越来越受到重视[16-18]. 本实验的研究结果表明, 肝门阻断后导致的肠道淤血症状明显, 并随阻断时间的延长而逐渐加重, 肠壁的组织学改变与文献[8,18]报道一致. NOS是NO的合成酶, NDP组化染色是目前常用的显示NOS的方法, NOS活性增强则代表NO合成增加, 表明NO释放也增加, NO能神经兴奋性增高. 结合本实验的研究结果, 肝门阻断后, 小肠和结肠壁内的NOS阳性神经元数量增多, 胞体增大, 阳性表达增强, 说明肝门阻断会造成ENS的NOS神经元功能异常, 使肠道最主要的抑制性神经递质NO释放量大大增加,发挥抑制性的功能增强, 而长时间的肝门阻断会造成NOS阳性神经纤维的数量减少, 提示NO释放途径受影响或损伤.
肝门阻断会造成ENS的NOS阳性神经元功能异常的可能机制是: 肝门阻断导致肠道淤血, 继而造成肠道缺血和缺氧的状态, 激发了ENS的氮能神经细胞大量合成和释放NO, NO能减少或清除氧自由基、抑制脂质过氧化反应, 抑制Ca2+超载现象的发生而使黏膜损伤降低, 起一定的肠道保护作用[1,19], 但持续的肠道淤血引起的缺氧和肠道代谢产物、毒素等的堆积, 尤其是过量的NO的持续释放[20], 可能影响或损伤了NO能神经细胞的神经纤维, 导致其数量减少. 因此, 肝门阻断会造成ENS的NOS神经元的功能异常、及NO释放途径的障碍, 影响了术后肠道运动功能和内脏感觉功能的及时恢复, 导致相关并发症的发生, 这可能是肝脏外科手术后导致肠道功能障碍的神经机制.
胃肠运动功能是消化道最重要的功能之一, 其调节机制非常复杂, 其中肠神经系统(ENS)起主要作用, 是消化管壁内的"微型脑", ENS的NOS神经元释放的NO是胃肠道最主要的抑制性神经递质, 在胃肠功能方面起重要的调节作用. 肝门阻断后可使肝脏及全身其他脏器产生一系列病理生理改变, 目前较多的研究多集中在肝门阻断后对肝脏的损伤, 而由于缺血再灌注损伤和血液动力学障碍所造成的肝外器官损伤的研究相对较少, 尤其是有关ENS的影响未见报道. 因此探讨肝门阻断后NO神经的改变有非常积极的意义.
本研究表明: 肝门阻断会造成ENS的NOS神经元的功能异常、及NO释放途径的障碍, 影响了术后肠道运动功能和内脏感觉功能的及时恢复, 导致相关并发症的发生, 这可能是肝脏外科手术后导致肠道功能障碍的神经机制. 因此, 研究肝门阻断导致肠神经系统功能异常的机理, 可以提高对肝外科手术后的肠道运动功能障碍的认识, 以便采取有效的方法来预防其发生和改善其症状.
本文探讨了肝门阻断在肠道运动功能障碍中的作用. 提出NOS水平的变化在肠道运动中起作用. 该研究对阐明肝外科手术中操作导致的术后胃肠运动功能障碍机制有参考价值.
电编: 李琪 编辑:菅鑫妍 审读:张海宁
| 1. | 彭 曦, 汪 仕良. 一氧化氮合酶在胃肠道的分布规律及意义. 国外医学生理、病理科学与临床分册. 1997;17:258-261. |
| 4. | 吴 红金, 林 传友, 曹 福元, 胡 道松, 殷 光甫, 茹 立强. 大鼠肠道内NOS与AchE、VIP阳性神经元的分布关系研究. 中国组织化学与细胞化学杂志. 2000;9:187-189. |
| 5. | Liu DL, Jeppsson B, Hakansson CH, Odselius R. Multiple-system organ damage resulting from prolonged hepatic inflow interruption. Arch Surg. 1996;131:442-447. [PubMed] |
| 9. | Dawson TM, Bredt DS, Fotuhi M, Hwang PM, Snyder SH. Nitric oxide synthase and neuronal NADPH diaphorase are identical in brain and peripheral tissues. Proc Natl Acad Sci USA. 1991;88:7797-7801. [PubMed] |
| 10. | Guslandi M. Nitric oxide: an ubiquitous actor in the gastrointestinal tract. Dig Dis. 1994;12:28-36. [PubMed] |
| 19. | 贾 长库, 陈 玉强, 郑 常杰, 张 晓波, 王 薇. 外源性NO在大鼠小肠缺血再灌注损伤中作用的实验研究. 中国现代普通外科进展. 2001;4:31-36. |