修回日期: 2005-11-03
接受日期: 2005-11-26
在线出版日期: 2006-01-08
目的: 构建鼠反义转化生长因子βⅠ型受体(TβRⅠ)基因pcDNA3.1(+)真核表达质粒, 为进一步研究通过TβRⅠ干预肝纤维化的发生发展提供实验基础.
方法: 将取冰冻保存的大鼠肝组织, 应用TRIzol法提取总RNA, 琼脂糖凝胶电泳检测RNA完整性, 并用紫外分光核酸蛋白分析仪测定RNA浓度和纯度. 使用一步法逆转录聚合酶链反应(RT-PCR)试剂盒获得目的基因TβRⅠ cDNA片段, 采用巢式PCR扩增TβRⅠ基因片断. 用CaCl2法诱导感受态细胞. 将真核表达载体pcDNA3.1(+)在多克隆位点处用EcoRⅠ、XholⅠ双酶切线性化, 切胶纯化回收; TβRⅠ基因片断双酶切后切胶纯化回收; 将纯化回收的pcDNA3.1(+)线性化载体和TβRⅠ基因片段定向及反向连接, 构建以pcDNA3.1(+)为载体的反义TβRⅠ基因真核表达质粒. 转化JM109大肠杆菌. 酶切证实的阳性克隆行测序分析.
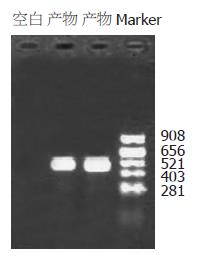
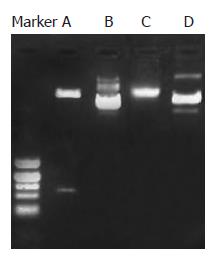
结果: 琼脂糖凝胶电泳检测RNA完整性, 见28S, 18S条带完整, 而且28S条带亮度为18S的1倍左右, 认为RNA完整性良好; 并用紫外分光核酸蛋白分析仪测定RNA纯度A260/A280 = 1.915 0, 认为RNA纯度良好; RNA浓度为770 mg/L. 阳性克隆质粒经双酶切后行10 g/L琼脂糖凝胶电泳在DNA Marker 430 bp和线性化纯化后pcDNA3.1(+), 5.3 kb附近可见两条明显条带, 与所需目的片段大小相符, 证实为阳性克隆, 重组质粒构建成功. DNA测序结果与预期目的片段序列一致.
结论: 鼠反义TβRⅠ/pcDNA3.1(+)真核表达重组质粒构建成功.
引文著录: 徐丽红, 郑勇, 周婷, 李睿, 陈莹. 鼠反义转化生长因子βⅠ型受体真核表达质粒的构建与鉴定. 世界华人消化杂志 2006; 14(1): 39-44
Revised: November 3, 2005
Accepted: November 26, 2005
Published online: January 8, 2006
AIM: To construct rat pcDNA3.1(+)-antisense TβRI (transforming growth factor beta receptor I) eukaryotic expressing plasmid, and to provide the experimental foundation for intervening the pathogenesis and development of liver fibrosis through TβRI.
METHODS: TRIzol assay was performed to obtain the total RNA from the rat liver tissues. The integrality, concentration and purity of total RNA were detected by ultraviolet spectrophotometry and agarose electrophoresis. The fragment of TβRI cDNA was obtained by reverse transcription polymerase chain reaction (RT-PCR), and then amplified by nest PCR. CaCl2 method was used to induce the susceptibility of cells. The eukaryotic expressing vector, at its multiple cloning sites, as well as the fragment of TβRI, was digested by EcoRⅠand Xhol, and then, was purified and retrieved by agarose electrophoresis separation. pcDNA3.1(+)-antisense TβRI eukaryotic expressing plasmid was constructed by a directional inverted joins with the purified linear pcDNA3.1(+) and the purified fragment of TβRI. This recombinant plasmid was transfected into E.coli JM109 by means of heat shock. The recombinant was identified by restriction endonuclease digestion and DNA sequence analysis.
RESULTS: Agarose electrophoresis showed that the strips of 18S and 28S were integral. Furthermore, the luminosity of the 28S strip was twice as high as 18S strip. So the total RNA was considered to be in integrity. The ratio of A260/A280 was 1.915 0, and the total RNA was considered to be in good purity. The concentration of total RNA was 770 mg/L. The two fragments digested from pcDNA3.1(+)-antisense TβRI by EcoRⅠand XholⅠrepresented 5.3 kb and 432 bp after agarose electrophoresis, indicating the successful construction of pcDNA3.1(+)-antisense TβRI. Sequence analysis showed the same sequence as expected.
CONCLUSION: The pcDNA3.1(+)-antisense TβRI eukaryotic expressing plasmid is constructed successfully.
- Citation: Xu LH, Zheng Y, Zhou T, Li R, Chen Y. Construction and identification of rat pcDNA3.1(+)-antisense TβRI eukaryotic expressing plasmid. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 39-44
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/39.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.39
在TGF-β信号转导过程中活化的TGF-β需与相应的细胞膜受体结合才能发挥作用. 肝星形细胞(HSC)活化合成的细胞外基质(ECM)是肝纤维化时ECM的主要来源[1,2]. 肝星形细胞活化后其细胞表面的TβRⅡ显著减少, 而TβRⅠ增加或保持不变[3]. 故推断TβRⅠ的表达下调在延缓肝纤维化的过程中可能有潜在的更重要的作用. 我们采用分子生物学方法构建鼠反义TβRⅠ真核表达质粒, 为通过抑制TβRⅠ的表达干预肝纤维化的发生发展提供了实验基础.
肝组织为石河子大学第一附属医院中心实验室-80 ℃冰冻保存的肝组织; pcDNA3.1(+)质粒为本课题组保留; 限制性核酸内切酶EcoRⅠ、XholⅠ均购自美国Promega公司; 大肠埃希菌JM109系石河子大学石河子医学院生化实验室所赠; Taq DNA多聚酶、UNIQ-10柱式PCR切胶回收试剂盒、UNIQ-10小剂量质粒抽提试剂盒、DEPC均购自上海Sangon公司; Triaol Reagent RNA分离液为美国Invitrogen公司的产品; 逆转录PCR一步法试剂盒为德国Qiagen公司的产品; T4DNA连接酶、琼脂糖为加拿大BBI公司的产品; 巢式PCR内、外引物两对, 均由上海Sangon公司合成, 序列为: 外引物: F1: 5'-ACAGGCGCAAACAGTGGCAG-3'; R1: 5'-AGTCTCGTAGCACAATGGTCC-3'; 内引物: F2: 5'-TTCACCTCGAGAGTGGCAGCGGGACC-3'; R2: 5'-CTACCGAATTCTGGACCATCAGCATAAG-3'. (黑体部分为添加的限制性内切酶XholⅠ和EcoRⅠ特异识别部分的核苷酸序列).
1.2.1 巢式逆转录聚合酶链反应(RT-PCR)获目的基因TβRⅠ cDNA片段: 肝组织中总RNA的提取, 取冰冻肝组织, 在组织切片机上切成5 mm薄片, 取10张放入0.1 mL/L DEPC水处理过的2.0的离心管中, 然后加入4 ℃预冷的Trizol 1 mL, 4 ℃冰箱放置1 h. 加入4 ℃预冷的氯仿200 mL, 剧烈振荡后静置5 min, 13 000 g 4 ℃离心15 min, 取上清液, 再次加入氯仿200 mL, 剧烈振荡后静置5 min, 13 000 g 4 ℃离心15 min, 取上清液加入等体积-20 ℃预冷异丙醇, 轻轻混匀, 置-20 ℃冰箱静置10 min, 13 000 g 4 ℃离心25 min, 倾倒上清液, 将沉淀用预冷、现配的750 mL/L酒精0.3 mL洗涤两次, 每次洗涤后13 000 g 4 ℃离心5 min, 第二次离心后倒去上清液, 空气晾干10 min, 即得RNA沉淀, 用30 mL 0.1 mL/L DEPC水处理过的无菌双蒸水溶解. 15 g/L琼脂糖凝胶电泳检测RNA完整性, 并用紫外分光核酸蛋白分析仪测定RNA浓度和纯度, -20 ℃保存RNA备用.
使用一步法RT-PCR试剂盒, 反应体系: 5×buffer 5.0 mL、dNTP 1.0 mL、引物F1 0.3 mL、引物R1 0.3 mL、Rnasein 0.1 mL、Enzyme mixed 1.0 mL、Rnase free water 15.3 mL、RNA模板 2.0 mL、总反应体积25 mL. 逆转录聚合酶链反应条件: (1)cDNA合成与预变性: 50 ℃ 30 min, 95 ℃ 15 min; (2)PCR扩增: 94 ℃ 30 s, 55 ℃ 45 s, 72 ℃ 1 min, 35个循环; (3)最后延伸: 72 ℃ 10 min, 产物经10 g/L琼脂糖凝胶电泳检测.
巢式PCR扩增TβRI基因片断: 反应体系50 mL, 含: 无菌双蒸水38.2 mL、10×buffer 4.9 mL、10 mmol/L dNTP 0.9 mL、引物F2 0.5 mL、引物R2 0.5 mL、25 mmol/L MgCl2 3.75 mL、Taq DNA聚合酶0.25 mL、RT-PCR产物1.0 mL. PCR反应条件: (1)预变性: 95 ℃ 4 min; (2)PCR扩增: 94 ℃ 30 s, 55 ℃ 45 s, 72 ℃ 1 min, 35个循环; (3)最后延伸: 72 ℃ 10 min, 巢式PCR的扩增产物经10 g/L琼脂糖凝胶电泳检测.
1.2.2 反义TβRⅠ/pcDNA3.1(+)真核表达重组质粒的构建: (1)感受态细菌的制备: 从冻存大肠埃希菌JM109菌液中沾取少量菌液分别接种于Amp(-)和Amp(+)的LB固体培养基平皿上, 37 ℃过夜, 从Amp(-)平皿中挑取单个菌落接种于LB培养液中, 37 ℃振摇过夜(120 r/min), 再从中取0.5 mL菌液接种于50 mL LB培养基中, 37 ℃剧烈振摇培养2 h(250 r/min), 用CaCl2法诱导感受态细胞. (2)pcDNA3.1(+)载体与目的片断的连接: 真核表达载体pcDNA3.1(+)在多克隆位点处用EcoRⅠ、XholⅠ双酶切线性化, 切胶纯化回收; TβRⅠ基因片断双酶切后切胶纯化回收; 将纯化回收的pcDNA3.1(+)线性化载体和TβRⅠ基因片段定向及反向连接, 重组后即为TβRⅠ/pcDNA3.1(+)真核表达重组质粒. pcDNA3.1(+)酶切反应体系: 第一次酶切, 灭菌双蒸水13.4 mL、BufferH 3 mL、BSA 0.6 mL、pcDNA3.1(+) 10 mL、EcoRⅠ3 mL, 总反应体积30 mL, 反应条件: 37 ℃水浴2 h; 行第二次酶切, 灭菌双蒸水9.4 mL、BufferD 5 mL、BSA 0.6 mL、XholⅠ5 mL, 总反应体积50 mL, 反应条件: 37 ℃水浴2 h. TβRⅠ基因片段酶切反应体系: 第一次酶切, 灭菌双蒸水5.2 mL、BufferH 2.5 mL、BSA 0.3 mL、纯化回收的TβRⅠ基因片断15 mL、EcoRⅠ 2.0 mL, 总反应体积 25 mL, 反应条件: 37 ℃水浴2.5 h; 行第二次酶切, 灭菌双蒸水8.2 mL、BufferD 2.5 mL、BSA 0.3 mL、XholⅠ 4 mL, 总反应体积30 mL, 反应条件: 37 ℃水浴2.5 h. 应用T4DNA连接酶, 载体DNA与插入DNA比例为3-7:1, 分别做了22 ℃连接2 h及14 ℃连接过夜. (3)细菌转化: 取已连接的质粒DNA 5 mL, 加入200 mL感受态细菌中, 冰浴30 min, 42 ℃水浴(热休克)90 s, 立即冰浴5 min, 将菌液移入装有预热至37 ℃的800 mL LB培养液的2 mL灭菌离心管中, 37 ℃ 120 r/min振摇1 h, 5 000 r/min离心1 min后, 弃上清液800 mL, 将剩余200 mL菌液平铺于Amp(+)的LB平皿上, 37 ℃恒温箱中平皿倒置培养16-20 h. 并同时设置阳性对照和阴性对照.
1.2.3 阳性克隆的筛选和鉴定: 平皿培养16-20 h后, 快速连接体系及过夜连接体系培养基上均可见有散在的单个菌落, 随机挑选单个菌落, 接种于5 mL Amp(+)的LB培养液中, 37 ℃ 250 r/min振摇过夜. 取出200 mL菌液+甘油冷藏作保存菌种外, 其余菌液用小剂量质粒抽提试剂盒按说明书行小剂量质粒提取. 取所得质粒5 mL于10 g/L琼脂糖凝胶电泳, 可见有质粒样双带, 认为是阳性克隆, 进一步作双酶切鉴定. 取样本10 mL用EcoRⅠ和XholⅠ双酶切后各取10 mL行10 g/L琼脂糖凝胶电泳检测酶切效果. 酶切证实的阳性克隆, 做LB培养基穿刺培养后送上海Sangon公司测序.
从鼠的肝组织中提取的总RNA, 电泳鉴定28S, 18S条带完整, 而且28S条带亮度为18S的1倍左右, 说明RNA无明显降解, 分光光度计测定A/A280 = 1.915 0, RNA浓度为770 mg/L. 经巢式RT-PCR扩增后, 10 g/L琼脂糖凝胶电泳, 在DNA Marker 440 bp附近可见明显条带, 与所需目的片段大小相符, 空白对照则无(图1).
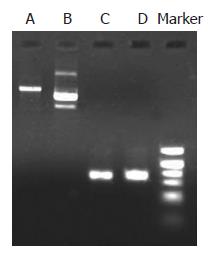
真核表达载体pcDNA3.1(+)双酶切线性化后切胶纯化回收及TβRⅠ基因片断双酶切后切胶纯化回收均可见单一清晰目的条带(图2).
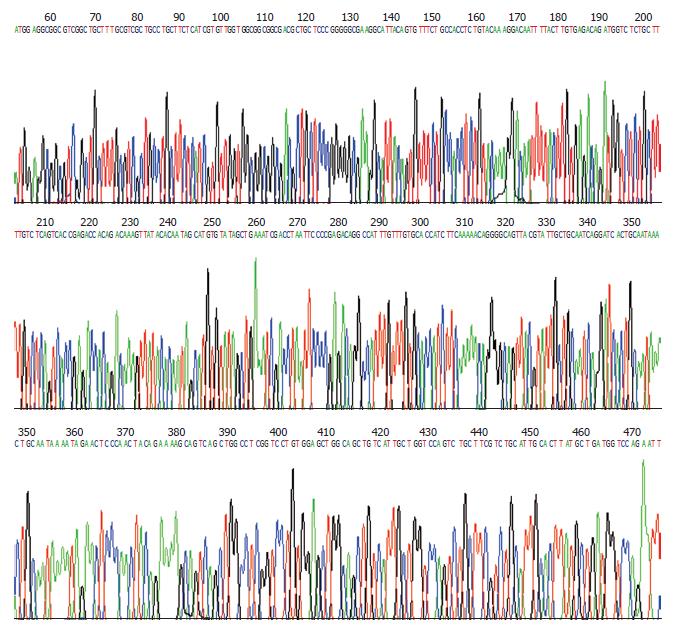
在Amp(+)LB培养基平皿上随机挑取单个菌落, 经增菌, 抽取质粒经双酶切后行10 g/L琼脂糖凝胶电泳在DNA Marker 430 bp和线性化纯化后pcDNA3.1(+)附近可见两条明显条带, 与所需目的片段大小相符, 证实为阳性克隆(图3). 由于F2、R2引物所带酶切位点与载体pcDNA3.1(+)所带的酶切位点方向相反, 故所得为反义TβRⅠ/pcDNA3.1(+)真核表达重组质粒. 阳性克隆质粒测序结果(图4)经blast对照(Gene ID: 29591)完全一致.
TGF-β是体内最有力分布最广泛的促纤维化介质, 其在体内的动态平衡的改变在肝纤维化的发生发展中发挥着重要作用[4-8]. 不少实验表明血清TGF-β1水平与肝纤维化指标和肝组织的病理关系具有相关性[9-11]. 亦有大量的实验表明阻断TGF-β信号传导能显著地抑制HSC的活化, 延缓肝纤维化的进程[12-15]. 现TGF-β信号传导过程已基本阐明, 活化的TGF-β必须与相应的细胞膜受体结合才能发挥作用, 这些受体包括TβRⅠ、TβRⅡ、TβRⅢ[16,17], 而TβRⅠ是唯一的直接将信号传递到细胞内的受体[18]. 近年来不同状态下细胞表面受体表达的不同和不同的受体表达对TGF-β信号传导的影响的研究不断得到深入. 目前许多研究均提示传导过程中TβRⅠ型受体可通过对Smad辨认[19-21]决定细胞内信号的特异性, 而这可能和细胞表面的endoglin受体表达变化有关[22]. 亦有报道表明TβRⅠ型受体对内皮素(endothelin-1, ET-1)的表达有调节作用[23,24], 而ET-1对肝损伤后纤维化的维持和门脉高压的形成具有重要的意义. Roulot et al[3]发现虽然绝大多数细胞都有TβRⅠ、TβRⅡ两种受体, 但比例并不相同, 对TGF-β的反应性也大不相同, 如肝HSC活化后其细胞表面的TβRⅡ显著减少, 而TβRⅠ增加或保持不变, 并认为这可能是HSC活化后功能改变的部分原因. 目前国内外通过不同方法抑制TβRⅡ的表达来延缓肝纤维化的进程的实验较多[25,15], 而通过抑制TβRⅠ的表达干预肝纤维化的发生发展的实验较少.
鼠TβRⅠ基因定位于鼠5q22, 含有9个外显子, 全基因长度约5.3 kb. 反义RNA技术是根据核酸杂交原理, 借助基因重组技术, 将特异的反义基因连接到特定的表达载体上(质粒, 病毒), 转录出反义RNA与相应的mRNA形成双链, 从而在核酸复制、转录及翻译水平高度抑制靶基因的表达[1]. 反义RNA作用机制包括与靶基因形成RNA:RNA二聚体, 阻止mRNA与核糖体的结合及移动抑制翻译或影响前体mRNA的加工, 这要求目的基因的选择最好从翻译起始点延伸0.5-3.0 kb长的片段,而且互补于5'和3'非翻译区的序列往往有较好的效果[26,27]; 或反义RNA结合启动子、操纵基因、弱化子及终止子单链抑制转录, 最终抑制靶基因表达. pcDNA3.1(+)是一个由人类巨细胞病毒启动子控制转录起始的表达质粒, 含有T7、BGH启动子, 为RNA聚合酶附着作用提供了特异性识别位点; 并含有高效增强子SV40, 为可促进基因转染活性的顺式调控元件; 这样使其调控的基因可在哺乳动物细胞中获得稳定表达并在一定程度上保证了目的基因的稳定遗传. 此外, pcDNA3.1(+)编码区还含有氨苄青霉素(Amp)抗性基因, 便于做阳性克隆筛选[28-31]. 采用嵌套引物策略, 采取巢式PCR技术进行两次扩增, 可减少非靶序列的扩增. 根据这些理论, 我们选取pcDNA3.1(+)作为载体, 从鼠肝组织中提取总RNA, 采用巢式RT-PCR技术扩增出约440 bp的TβRⅠ片段, 并将其插入到真核表达质粒pcDNA3.1(+)中. 重组的质粒经酶切鉴定与预期值大小相符, 测序分析证实为TβRⅠ全长编码序列中的基因片段, 片段长度432 bp, 基因序列与GenBank发表的序列完全一致, 表明成功构建了鼠反义TβRⅠ/pcDNA3.1(+)真核表达重组质粒. 这一工作的完成, 为后续的将反义TβRⅠ/pcDNA3.1(+)真核表达重组质粒导入肝纤维化模型大鼠的体内研究其对肝纤维化的影响提供前提条件.
在本次实验过程中, 就重组质粒构建过程中的连接步骤, 直接将双酶切线性化切胶纯化回收的真核表达载体pcDNA3.1(+)片断与双酶切后切胶纯化回收的TβRⅠ基因片连接, 同时建立了不同比例的连接反应体系, 载体DNA:外源插入DNA摩尔比为: 3:1, 5:1, 7:1, 连接时间和温度选择了22 ℃连接2 h及14 ℃连接过夜, 最后均成功获得了重组子. 总结经验认为所得目的片段的浓度及载体浓度大于10 mg/L即可试行快速连接, 可有效提高实验的效率. 如目的片段的浓度较小, 则应行过夜连接, 实验中曾将目的片段连接到T载体, 再酶切纯化回收, 结果所得目的片段的浓度很低, 行快速连接未获成功, 过夜连接则获得重组子, 但实验周期延长. 在实验中同时建立不同比例的连接反应体系, 可有利于提高实验效率.
本实验承蒙石河子大学第一附属医院中心实验室的杨军主任、周婷老师悉心指导和热忱帮助, 在此一并致谢.
肝纤维化形成过程受到众多细胞因子的调节, 目前认为最重要的细胞因子是PDGF(血小板衍化生长因子)和TGF-β(转化生长因子β). TGF-β在肝纤维化的发生发展过程中不仅能促进ECM的合成增加, 而且能抑制ECM的降解. TGF-β信号传导过程中活化的TGF-β必须与相应的细胞膜受体结合, 才能将信号传递给TGF-β家族的细胞内信号分子SMAD, 再将信号从细胞质传入到细胞核, 从而特异性的调节 TGF-β靶基因的表达, 调节HSC的转化和ECM的合成、降解.
近年来利用阻断TGF-β的信号通路干预肝纤维化的发生发展的实验性研究越来越多, 越来越深入. 不断的证明干扰TGF-β的信号通路可有效的干预肝纤维化的发生发展. 目前已有研究发现虽然绝大多数细胞都有TβRⅠ、TβRⅡ两种受体, 但比例并不相同, 对TGF-β的反应性也大不相同, 肝HSC活化后其细胞表面的TβRⅡ显著减少, 而TβRⅠ增加或保持不变, 并认为这可能是HSC活化后功能改变的部分原因. 目前国内外通过不同方法抑制TβRⅡ的表达来延缓肝纤维化的进程的实验较多, 而通过抑制TβRⅠ的表达或通过调节TβRⅠ、TβRⅡ两种受体的比例来干预肝纤维化的发生发展的实验较少.
由于反义技术是近十几年才发展起来的新技术, 目前构建反义真核表达质粒并通过反义技术干预和调控基因表达的相关报道并不多见. 本实验应用巢式RT-PCR技术获得TβRⅠ基因片段, 其间采用嵌套引物策略, 采取巢式PCR技术进行两次扩增, 减少了非靶序列的扩增. 用基因重组技术以pcDNA3.1(+)为载体构建反义TβRⅠ基因真核表达质粒.
构建鼠反义转化生长因子βⅠ型受体(TβRⅠ)基因pcDNA3.1(+)真核表达质粒, 为进一步研究通过抑制TβRⅠ的表达或通过调节TβRⅠ、TβRⅡ两种受体的比例来干预肝纤维化的发生发展提供实验基础.
反义RNA技术: 是根据核酸杂交原理, 借助基因重组技术, 将特异的反义基因连接到特定的表达载体上(质粒, 病毒), 转录出反义RNA与相应的mRNA形成双链, 从而在核酸复制、转录及翻译水平高度抑制靶基因的表达. TGF-β受体: TGF-β信号传导过程中活化的TGF-β需与相应的细胞膜受体结合,包括TβRⅠ、TβRⅡ、TβRⅢ, 然后将信号传入到细胞内.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 1. | 王吉耀主编. 现代肝病治疗-理论与进展. 第一版. 上海: 上海医科大学出版社 1999; 179-186. |
| 2. | Safadi R, Friedman SL. Hepatic fibrosis-role of he-patic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 3. | Roulot D, Sevcsik AM, Coste T, Strosberg AD, Marullo S. Role of transforming growth factor beta type II receptor in hepatic fibrosis: studies of human chronic hepatitis C and experimental fibrosis in rats. Hepatology. 1999;29:1730-1738. [PubMed] |
| 4. | Par A, Par G. Liver fibrosis: pathophysiology, diag-nosis and treatment. Orv Hetil. 2005;146:3-13. [PubMed] |
| 5. | Lewindon PJ, Pereira TN, Hoskins AC, Bridle KR, Williamson RM, Shepherd RW, Ramm GA. The role of hepatic stellate cells and transforming growth factor-beta(1) in cystic fibrosis liver disease. Am J Pathol. 2002;160:1705-1715. [PubMed] |
| 6. | Leask A, Abraham DJ. TGF-beta signaling and the fibrotic response. FASEB J. 2004;18:816-827. [PubMed] |
| 8. | Wada W, Kuwano H, Hasegawa Y, Kojima I. The dependence of transforming growth factor-beta-induced collagen production on autocrine factor activin A in hepatic stellate cells. Endocrinology. 2004;145:2753-2759. [PubMed] |
| 9. | Date M, Matsuzaki K, Matsushita M, Tahashi Y, Furukawa F, Inoue K. Modulation of transforming growth factor beta function in hepatocytes and hepatic stellate cells in rat liver injury. Gut. 2000;46:719-724. [PubMed] |
| 13. | Fernandez T, Amoroso S, Sharpe S, Jones GM, Bliskovski V, Kovalchuk A, Wakefield LM, Kim SJ, Potter M, Letterio JJ. Disruption of transforming growth factor beta signaling by a novel ligand-dependent mechanism. J Exp Med. 2002;195:1247-1255. [PubMed] |
| 15. | George J, Roulot D, Koteliansky VE, Bissell DM. In vivo inhibition of rat stellate cell activation by solu-ble transforming growth factor beta type II receptor: a potential new therapy for hepatic fibrosis. Proc Natl Acad Sci USA. 1999;96:12719-12724. [PubMed] |
| 16. | Wells RG. Fibrogenesis. V. TGF-beta signaling path-ways. Am J Physiol Gastrointest Liver Physiol. 2000;279:G845-G850. [PubMed] |
| 17. | Massague J, Wotton D. Transcriptional control by the TGF-beta/Smad signaling system. EMBO J. 2000;19:1745-1754. [PubMed] |
| 18. | Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signall-ing. Nature. 2003;425:577-584. [PubMed] |
| 19. | Yakymovych I, Heldin CH, Souchelnytskyi S. Smad2 phosphorylation by type I receptor: contribution of arginine 462 and cysteine 463 In the C terminus of Smad2 for specificity. J Biol Chem. 2004;279:35781-35787. [PubMed] |
| 20. | Huse M, Muir TW, Xu L, Chen YG, Kuriyan J, Mas-sague J. The TGF beta receptor activation process: an inhibitor- to substrate-binding switch. Mol Cell. 2001;8:671-682. [PubMed] |
| 21. | Callahan JF, Burgess JL, Fornwald JA, Gaster LM, Harling JD, Harrington FP, Heer J, Kwon C, Lehr R, Mathur A. Identification of novel inhibitors of the transforming growth factor beta1 (TGF-beta1) type 1 receptor (ALK5). J Med Chem. 2002;45:999-1001. [PubMed] |
| 22. | Meurer SK, Tihaa L, Lahme B, Gressner AM, Weis-kirchen R. Identification of endoglin in rat hepatic stellate cells: new insights into transforming growth factor beta receptor signaling. J Biol Chem. 2005;280:3078-3087. [PubMed] |
| 23. | Goumans MJ, Valdimarsdottir G, Itoh S, Rosendahl A, Sideras P, ten Dijke P. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. EMBO J. 2002;21:1743-1753. [PubMed] |
| 24. | Shao R, Shi Z, Gotwals PJ, Koteliansky VE, George J, Rockey DC. Cell and molecular regulation of endothelin-1 production during hepatic wound healing. Mol Biol Cell. 2003;14:2327-2341. [PubMed] |
| 26. | Chen C, Okayama H. High-efficiency transforma-tion of mammalian cells by plasmid DNA. Mol Cell Biol. 1987;7:2745-2752. [PubMed] |
| 28. | Fu RB, Wu PS, Song YF, Qiu J, Dai TY, Li JH, Xiu JC. Construction of eukaryotic expression vectors of two mutants of hypoxia-inducible factor-1 and their expressions in human microvascular endothelial cells. Diyi Junyi Daxue Xuebao. 2005;25:1348-1351. [PubMed] |
| 29. | Eickelberg O, Centrella M, Reiss M, Kashgarian M, Wells RG. Betaglycan inhibits TGF-beta signaling by preventing type I-type II receptor complex for-mation. Glycosaminoglycan modifications alter betaglycan function. J Biol Chem. 2002;277:823-829. [PubMed] |
| 30. | RenYue-Xin , 宋 于刚, 陈 学清, 智 发朝, 钟 世顺, 南 清振, 武 金宝, 崔 忠林. pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Gro alpha真核表达质粒的构建及鉴定. 世界华人消化杂志. 2004;12:2623-2626. [DOI] |
| 31. | Han XC, Zhang H, Jia MK, Han G, Jiang WD. Expression of TIMP-3 Gene by Construction of a Eukaryotic Cell Expression Vector and Its Role in Reduction of Metastasis in a Human -Breast Cancer Cell Line. Cell Mol Immunol. 2004;1:308-310. [PubMed] |