修回日期: 2005-10-03
接受日期: 2005-10-19
在线出版日期: 2006-01-08
目的: 探讨内皮素-1(ET-1)在重症急性胰腺炎(severe acute pancreatitis, SAP)胰腺中的表达对胰腺损伤的作用机制及丹参注射液对ET-1 mRNA表达的影响.
方法: Wistar大鼠45只, 随机等分为模型组、药物组和对照组. 以50 g/L牛磺胆酸钠1 mL/kg经胰管内逆行注射复制SAP模型. 药物组在制模后im丹参[2 mL/(kg·d)], 1次/6 h. 对照组仅行假手术. 各组动物在术后24 h测血淀粉酶、ET-1和腹水量. 使用原位杂交和图象分析检测胰腺ET-1 mRNA的表达强度, 并观察胰腺的病理变化.
结果: 模型组血中淀粉酶和腹水量分别为35.9±5.93 µkat/L和9.87±2.34 mL, 显著高于药物组的23.96±5.56 µkat/L和5.27±2.81 mL及对照组的3.60±0.62 µkat/L和0 mL(P<0.001). 模型组血中ET-1为185.47±20.80 ng/L, 高于药物组的164.27±18.53 ng/L和对照组的72.90±17.27 ng/L(P<0.05, P<0.001). 模型组和药物组胰腺ET-1 mRNA表达均增高, 模型组显著高于药物组(28.22±1.15 vs 23.81±1.04, P<0.001). 模型组和药物组胰腺均有病理改变, 但药物组较模型组减轻(评分: 10.45±1.42 vs 12.05±1.28, P<0.05).
结论: SAP时胰腺ET-1 mRNA高表达导致ET-1过度生成并与胰腺损伤有关. 丹参能抑制胰腺ET-1 mRNA的过度表达, 从而对胰腺起保护作用.
引文著录: 张莹, 石承先, 黄平, 任娟娟, 李玉祥. 丹参对重症急性胰腺炎内皮素-1 mRNA的影响. 世界华人消化杂志 2006; 14(1): 35-38
Revised: October 3, 2005
Accepted: October 19, 2005
Published online: January 8, 2006
AIM: To investigate the expression of endothelin-1 (ET-1) mRNA in severe acute pancreatitis (SAP) as well as the effect of Salviae Miltiorrhizae (SM) on ET-1 mRNA expression in rats.
METHODS: Forty-five Wistar rats were randomly divided into 3 groups: model group (MG, n = 15), SM group (SMG, n = 15), and control group (CG, n = 15). Severe acute pancreatitis was induced by intraductal injection of 50 g/L sodium taurocholate (1.0 mL/kg) in MG and SMG. The rats in SMG were then treated with Salviae Miltiorrhizae [2 mL/(kg•d)]. Sham-operation was only performed in CG. The levels of ascites, serum ET-1 and amylase (AMY) were determined at 24 h. The expression of ET-1 mRNA was examined by in situ hybridization in pancreatic tissues. The pathological changes of the pancreas were observed 24 h after modeling.
RESULTS: The levels of ascites and serum AMY in MG (9.87 ± 2.34 mL, 35.9 ± 5.93 µkat/L) and SMG (5.27 ± 2.81 mL, 23.96 ± 5.56 µkat/L) were markedly higher than those in CG (0 mL, 3.60 ± 0.62 µkat/L, P < 0.001). The level of serum ET-1 in MG was significantly higher than that in SMG and CG (185.47 ± 20.80 ng/L vs 164.27 ± 18.53 ng/L, 72.90 ± 17.27 ng/L, P < 0.05,P < 0.001). ET-1 mRNA expression was notably higher in MG than that in SMG (28.22 ± 1.15 vs 23.81 ± 1.04, P < 0.001). Pathological changes were obviously alleviated in SMG in comparison with those in MG (score: 10.45 ± 1.42 vs 12.05 ± 1.28, P< 0.05).
CONCLUSION: Over-expression of ET-1 mRNA in pancreas plays an important role in SAP, and SM can inhibit the expression of ET-1 mRNA and alleviate the pancreatic injury.
- Citation: Zhang Y, Shi CX, Huang P, Ren JJ, Li YX. Effect of Salviae Miltiorrhizae on expression of endothelin-1 mRNA in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 35-38
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/35.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.35
重症急性胰腺炎(severe acute pancreatitis, SAP)起病急, 变化快, 病情复杂, 其发病机制至今仍不清楚. 传统胰酶消化学说已不能全面解释急性胰腺炎的发病机制. 有研究提示, 胰腺微循环紊乱是急性胰腺炎发生发展中的重要特征[1-4]. ET-1是迄今为止最强的缩血管物质之一[5-7], 但在SAP胰腺中的表达与胰腺病理改变的关系不清楚, 丹参作为常用的活血化淤药对其表达是否有影响, 也值得探讨.
健康Wistar大鼠45只, 体质量220-280 g (遵义医学院动物饲养中心提供). 牛磺胆酸钠(Sigma 公司), ET-1 mRNA原位杂交试剂盒(武汉博士德生物工程有限公司), ET-1试剂盒(北京东亚免疫研究所产品), α淀粉酶试剂盒(上海科华-东菱诊断用品有限公司), 丹参注射液(四川五粮液集团宜宾制药厂).
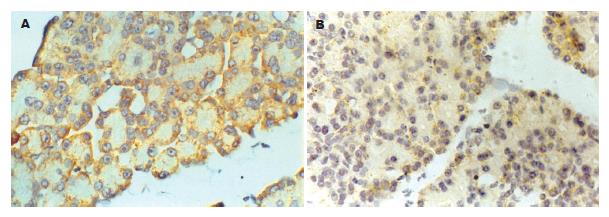
大鼠随机分为模型组(n = 15), 丹参组(n = 15)和对照组(n = 15). 模型组术前禁食12 h, 禁水4 h. 10 g/L戊巴比妥钠(25 mg/kg)ip麻醉. 采用上腹壁正中切口入腹, 寻及十二指肠及胰胆管, 用一小动脉夹夹闭胆管近肝门端, 4.5号针头经肠壁从十二指肠乳头刺入胰胆管约0.8 cm, 以0.2 mL/min的速度向胰胆管内逆行推注50 g/L牛磺胆酸钠溶液(sodiumtaurocholate, Na-Tc), 1.0 mL/kg后压迫5 min, 见胰腺出血坏死后去除小动脉夹关腹. 丹参组复制SAP模型关腹时腹股沟肌肉内注射丹参注射液[2 mL/(kg·d)], 1次/6 h, 共4次. 对照组仅开腹并轻轻触动十二指肠后关腹. 模型组、对照组im 9 g/L氯化钠溶液, 剂量、给药时间同丹参组. 动物分笼饲养, 自由进水. 制模后24 h 10 g/L戊巴比妥钠ip(15 mg/kg)麻醉下经颈动脉插管采血并处死动物, 取胰腺组织备检. 采血样l mL置于加有100 g/L EDTA二钠15 µL和抑肽酶20 µL(3 334 nkat)的试管中混匀, 4 ℃ 3 000 r/min离心10 min分离血清, -20 ℃保存待测. 检测方法按东亚免疫技术研究所提供的放免试剂盒说明书操作. 颈动脉采血l mL, 加少许肝素混匀, 2 500 r/min离心15 min, 取血浆-20 ℃保存待测. 全自动生化分析仪按淀粉酶(amylase, AMY)试剂盒说明书操作. 开腹后用注射器抽尽腹水并计量. 胰组织标本(1 cm×1 cm×0.5 cm)固定于40 g/L多聚甲醛溶液中(含1 g/L DEPC), 常规脱水, 石蜡包埋. 石蜡切片厚度7 µm, 脱蜡至水; 30 mL/L H202处理10 min;滴加30 mL/L柠檬酸新鲜稀释的蛋白酶, 37 ℃消化15 min, 暴露mRNA核酸片段; 预杂交3 h; 每张切片滴加ET-1寡核苷酸探针原位杂交液20 µL, 原位杂交专用盖玻片覆盖, 37 ℃湿盒中杂交20 h; 杂交后依次用2×SSC, 0.5×SSC, 0.2×SSC洗涤; 依次滴加封闭液(室温30 min)、鼠抗地高辛(37 ℃, 60 min)、生物素化SABC(37 ℃, 20 min); DAB显色10 min(DAB显色试剂盒为博士德公司产品). 阴性对照以PBS代替原位杂交液. ET-1 mRNA阳性表达的细胞胞质中出现棕黄色颗粒. 应用Biomias99图象分析系统(四川大学图像图形研究所), 在10×20倍视野下, 每张切片取50%组织测定积分吸光度表示阳性颗粒相对含量.
统计学处理 SPSS 10.0版统计软件处理数据, 以mean±SD表示, 组间比较用方差分析, 两组间比较采用t检验.
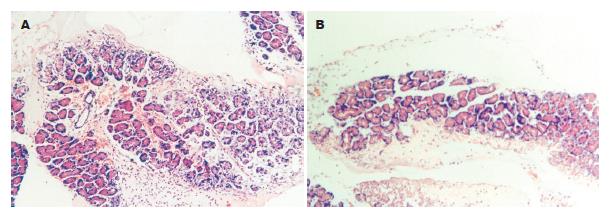
模型组开腹见淡红色或淡黄色腹水, 量多, 胃肠胀气明显. 胰腺大片出血坏死, 呈暗红色, 表面及周围腹膜、系膜见皂化斑; 肺表面高度充血, 可见点状出血, 胸腔内少量积液, 呈血性; 药物组见中少量腹水, 呈淡红色或淡黄色, 胃肠胀气较模型组轻; 胰腺见片状出血坏死, 呈暗红色, 表面及周围腹膜、系膜可见皂化斑. 对照组无腹水, 腹内器官未见异常改变. 光镜下模型组胰腺小叶间质水肿明显, 叶间隔及小叶间隔弥漫性增宽, 部分小叶轮廓不清, 大片状出血和变性坏死, 毛细血管高度扩张, 血管周围、小叶间有大量粒细胞浸润(评分12.05±1.28, 图1A). 药物组胰腺的病理改变较模型组轻, 主要表现在胰腺为片状出血, 粒细胞浸润少, 脂肪坏死较轻(评分10.45±1.42, P<0.05, 图1B). 对照组: 胰腺结构完整未见异常.
模型组和药物组大鼠血ET-1, AMY和腹水均显著高于对照组(P<0.001), 药物组的ET-1, AMY和腹水明显低于模型组(P<0.01, 表1).
胰腺微循环障碍在急性胰腺炎发病机制中的作用越来越受到重视[2,3,8]. SAP发生发展过程中, 由于胰酶在腺泡中过早激活、过度的炎症反应产生大量的细胞因子和血管活性物质等可直接或间接引起局部血流量减少、血流速度降低、白细胞黏附、毛细血管通透性增加以及功能性毛细血管密度降低等造成微循环功能障碍[9,10]. ET主要由血管内皮细胞释放, 具有强大的缩血管功能. 研究显示, ET-1能诱发微循环损害和腺泡细胞损伤[11-14], 表明ET-1介导的微血管改变对胰腺炎的病理生理改变起重要作用. 我们研究发现, 模型组动物胰腺的ET-1 mRNA过度表达, 血液中ET-1水平亦较高, 淀粉酶和腹水量均升高, 胃肠胀气明显, 胰腺的病理改变也较重; 这种现象的机制可能是ET-1 mRNA过度表达, ET-1大量生成, 致胰腺微血管持续的痉挛, 从而导致胰腺缺血和局部微循环淤滞, 使微循环改变, 血栓形成, 大量渗出, 加重胰缺血并促使AP病情加重, 且这种病变可持续不断发展. 同时胰腺腺泡中存在ET-1受体, ET-1与其受体结合能促进钙离子大量内流, 损伤胰腺组织细胞, 各种酶及各种炎性介质和细胞因子等释放, 引起周身反应, 可造成全身病理改变, 很快出现全身性炎症反应综合征和多器官功能障碍综合征.
丹参是常用的活血化淤药. 实验表明, 丹参注射液具有增加动物肠系膜微血管血流速度、抗凝和抗氧化作用. 我们发现, 使用丹参注射液的药物组动物, 胰腺的ET-1 mRNA表达下调, 血液中的ET-1水平相应下降, 胃肠胀气及腹水量减少, 胰腺病理改变亦减轻. 这与使用ET-1受体阻断剂(ET-1-RA)后胰腺血流量改善、病情减轻实验一致[8,15-17]. 提示丹参能有效地减轻胰腺的病变程度, 保护胰腺组织, 通过改善微循环, 减少微血管痉挛及胰腺组织缺血缺氧, 其作用机制之一可能是通过抑制SAP时ET-1 mRNA的过度表达, 减少ET-1的生成, 消除ET-1引起的不良影响, 稳定毛细血管壁通透性, 减少液体向组织间隙转移, 显著提高胰腺毛细血管血流量, 从而发挥其器官保护效应的作用. 因此重症急性胰腺炎早期胰腺微循环紊乱在胰腺炎的发生、发展中起重要作用. 早期应用丹参能降低胰腺ET-1 mRNA的过度表达, 纠正胰腺微循环紊乱, 有益于重症急性胰腺炎病情的转归.
近年研究发现认为急性胰腺炎的发生和发展不一定或不完全取决于胰酶的消化, 而与循环因素有着极其重要的联系. 目前的研究表明: 胰腺微循环紊乱贯穿于急性胰腺炎的整个病程, 是其发病的始动因素之一, 胰腺的微循环障碍主要有血液和微血管两个方面的改变, 两者相互影响, 形成恶性循环, 导致胰腺缺血, 加重胰腺的病理变化, 并且局部微循环障碍的进一步加剧可促使急性胰腺炎由水肿性发展为出血坏死性.
在重症急性胰腺炎早期血液流变学和微循环的改变先于血流动力学的改变, 由于全血黏度、血浆黏度增高, 使全身血液流动性降低, 携带和运输氧的能力下降, 常致全身炎症反应综合征(SIRS), 并进一步加重胰腺损伤, 甚至出现衰竭而致患者死亡. 早期纠正全身血液流变学的改变对重症急性胰腺炎的转归有积极意义. 本文以缩血管物质-内皮素-1(endothelin-1 )为靶点, 用丹参进行干预, 重点探讨丹参对重症急性胰腺炎血液流变学的影响及治疗机制.
1 刘建生, 张晓红, 付极. 急性胰腺炎时内皮素和一氧化氮变化及丹参治疗作用研究. 医师进修杂志2003; 26: 21-22
2 王兴鹏, 王国良, 巫协宁. 急性胰腺炎血循环障碍的意义. 新消化病学杂志 1997; 5: 55
3 钟守先. 重症急性胰腺炎研究方向的几点建议. 中国普通外科杂志 2005: 14: 321-322
本文应用丹参改善微循环的功效, 明确丹参对缩血管物质ET-1mRNA表达的影响, 探讨重症急性胰腺炎早期胰腺微循环紊乱在胰腺炎的发生、发展中起重要作用, 以及早期应用丹参对重症急性胰腺炎病情转归的影响.
重症急性胰腺炎早期存在微循环障碍, 本研究采用丹参治疗, 观察缩血管物质ET-1mRNA的表达变化, 以及胰腺病理变化和动物存活情况, 有助于为临床提供重症急性胰腺炎较为有效的救治措施.
电编: 张敏 编辑:潘伯荣 审读:张海宁
| 2. | Schmidt J, Ebeling D, Ryschich E, Werner J, Gebhard MM, Klar E. Pancreatic capillary blood flow in an improved model of necrotizing pancrea-titis in the rat. J Surg Res. 2002;106:335-341. [PubMed] |
| 3. | Zhou ZG, Chen YD, Sun W, Chen Z. Pancreatic microcirculatory impairment in experimental acute pancreatitis in rats. World J Gastroenterol. 2002;8:933-936. |
| 4. | Dlugosz JW, Nowak K, Laszewicz W, Andrzejewska A, Wroblewski E. The effect of endothelin-1 recep-tor antagonists in acute experimental pancreatitis in the rats. Exp Toxicol Pathol. 2003;55:137-145. [PubMed] |
| 5. | Inoue K, Hirota M, Kimura Y, Kuwata K, Ohmuraya M, Ogawa M. Further evidence for endothelin as an important mediator of pancreatic and intestinal ischemia in severe acute pancreatitis. Pancreas. 2003;26:218-223. [PubMed] |
| 6. | Plusczyk T, Bersal B, Menger MD, Feifel G. Differ-ential effects of ET-1, ET-2, and ET-3 on pancreatic microcirculation, tissue integrity, and inflammation. Dig Dis Sci. 2001;46:1343-1351. [PubMed] |
| 7. | Foitzik T, Faulhaber J, Hotz HG, Kirchengast M, Buhr HJ. Endothelin mediates local and systemic disease sequelae in severe experimental pancrea-titis. Pancreas. 2001;22:248-254. [PubMed] |
| 8. | Eibl G, Hotz HG, Faulhaber J, Kirchengast M, Buhr HJ, Foitzik T. Effect of endothelin and endothelin receptor blockade on capillary permeability in experimental pancreatitis. Gut. 2000;46:390-394. [PubMed] |
| 9. | von Dobschuetz E, Pahernik S, Hoffmann T, Kiefmann R, Heckel K, Messmer K, Mueller-Hoecker J, Dellian M. Dynamic intravital fluorescence microscopy-a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 2004;67:55-63. [PubMed] |
| 10. | Strate T, Mann O, Kleinhans H, Schneider C, Knoefel WT, Yekebas E, Standl T, Bloechle C, Izbicki JR. Systemic intravenous infusion of bovine hemoglobin significantly reduces microcirculatory dysfunction in experimentally induced pancreatitis in the rat. Ann Surg. 2003;238:765-771. [PubMed] |
| 11. | Forgacs B, Eibl G, Wudel E, Franke J, Faulhaber J, Kahrau S, Buhr HJ, Foitzik T. RES function and liver microcirculation in the early stage of acute experimental pancreatitis. Hepatogastroenterology. 2003;50:861-866. [PubMed] |
| 12. | Farrant GJ, Abu-Zidan FM, Liu X, Delahunt B, Zwi LJ, Windsor JA. The impact of intestinal ischaemia-reperfusion on caerulein-induced oedematous experimental pancreatitis. Eur Surg Res. 2003;35:395-400. [PubMed] |
| 13. | Sakai Y, Masamune A, Satoh A, Nishihira J, Yamagi-wa T, Shimosegawa T. Macrophage migration inhi-bitory factor is a critical mediator of severe acute pancreatitis. Gastroenterology. 2003;124:725-736. [PubMed] |
| 14. | Jaworek J, Leja-Szpak A, Bonior J, Nawrot K, Tomaszewska R, Stachura J, Sendur R, Pawlik W, Brzozowski T, Konturek SJ. Protective effect of melatonin and its precursor L-tryptophan on acute pancreatitis induced by caerulein overstimulation or ischemia/reperfusion. J Pineal Res. 2003;34:40-52. [PubMed] |
| 15. | Kaska M, Pospisilova B, Slizova D. Pathomorpholo-gical changes in microcirculation of pancreas during experimental acute pancreatitis. Hepatogastroenterology. 2000;47:1570-1574. [PubMed] |
| 16. | Plusczyk T, Bersal B, Westermann S, Menger M, Feifel G. ET-1 induces pancreatitis-like microvascu-lar deterioration and acinar cell injury. J Surg Res. 1999;85:301-310. [PubMed] |
| 17. | Andrzejewska A, Dlugosz JW. The endothelin-1 receptor antagonists ameliorate histology and ultra-structural alterations in the pancreas and decrease trypsinogen activation in severe taurocholate pancr-eatitis in rats. Int J Exp Pathol. 2003;84:221-229. [PubMed] |