修回日期: 2005-03-11
接受日期: 2005-03-22
在线出版日期: 2005-05-01
目的: 研究家族遗传性胆囊胆固醇结石患者、非家族遗传性胆囊胆固醇结石患者和非胆固醇结石患者肝组织HMGCoA还原酶(HMGCR)、固醇携带蛋白2(SCP2)基因mRNA的表达情况, 进而明确二者在胆石形成中的作用.
方法: 选取2003-08/2004-08天津市南开医院外科住院病例90例, 均取得患者及家属知情同意, 其中家族遗传性胆囊胆固醇结石患者28例, 非家族遗传性胆囊胆固醇结石患者30例, 非胆固醇结石患者32例, 术中肝活检, 行肝组织总RNA 提取, 逆转录反应合成cDNA, 设计引物, 进行聚合酶链反应(PCR)扩增HMGCR和SCP2基因的目的片段, 检测肝组织mRNA的表达水平的不同.
结果: 家族遗传性和非家族遗传性胆固醇结石组HMGCR, SCP2mRNA表达水平较非胆固醇结石组升高; 其中HMGCR mRNA表达在家族遗传性胆固醇结石组为1.9 269±0.2 134, 非家族遗传性组为1.9 791±0.2 524, 二者均高于非胆固醇结石组0.7 730±0.1 530, 差异有显著性(P<0.05); SCP2 mRNA表达在家族遗传性胆固醇结石组为0.8 908±0.1 649, 非家族遗传性组为0.7 503±0.1 004, 二者均高于非胆固醇结石组0.5 205±0.1 900, 差异有显著性(P<0.05); 家族遗传性胆固醇结石SCP2mRNA表达水平较非家族遗传性胆固醇结石组升高, 差异有显著性(P<0.05), 而HMGCR mRNA在家族遗传性和非家族遗传性胆固醇结石组两组间无统计学差别.
结论: 胆囊胆固醇结石患者肝组织HMGCR, SCP2mRNA表达水平升高是胆囊胆固醇结石形成的重要原因.
引文著录: 崔云峰, 崔乃强, 李东华, 张琚. 家族性胆固醇结石患者肝组织HMGCR和SCP2mRNA的表达. 世界华人消化杂志 2005; 13(9): 1115-1118
Revised: March 11, 2005
Accepted: March 22, 2005
Published online: May 1, 2005
AIM: To investigate the expression of the genes for HMGcoA reductase (HMGCR) and sterol carrier protein-2 (SCP2) in the livers of patients with hereditary and non-hereditary cholesterol gallstone, as well as non-cholesterol gallstone.
METHODS: The mRNA expression levels of the liver HMGCR and SCP2 genes were determined by RT-PCR in 28 patients with hereditary cholesterol gallstone, 30 patients with non-hereditary cholesterol gallstone, and 32 patients with non-cholesterol gallstone.
RESULTS: The mRNA expression levels of HMGCR in hereditary and non-hereditary cholesterol gallstone patients were 1.9 269±0.2 134 and 1.9 791±0.2 524, respectively, both increased significantly (P<0.05) as compared with that in the non-cholesterol gallstone patients (0.7 730±0.1 530). The levels of SCP2 mRNA in hereditary and non-hereditary cholesterol gallstone patients were 0.8 908±0.1 649 and 0.7 503±0.1 004, both increased significantly (P<0.05) as compared with non-cholesterol gallstone patients (0.5 205±0.1 900). Moreover, there was also a significant increase of SCP2 mRNA in hereditary cholesterol gallstone patients as compared with non-hereditary cholesterol gallstone patients (P<0.05).
CONCLUSION: HMGCR and SCP2 are overexpressed in cholesterol gallstone patients, which may be an important cause of cholesterol gallstones.
- Citation: Cui YF, Cui NQ, Li DH, Zhang J. Expression of HMGCR, SCP2 mRNA in hereditary cholesterol gallstone patients. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1115-1118
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1115.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1115
胆汁胆固醇高分泌, 生成致石性胆汁, 是胆囊胆固醇结石形成的重要原因. HMGCoA还原酶是肝脏胆固醇合成的限速酶, 其活性增高, 则肝脏合成胆固醇增多, 可使胆汁中胆固醇饱和指数上升. SCP2为可溶性碱性蛋白[1]. 作为胆固醇代谢的调节因子, 参与胆固醇的生物合成和胆固醇向胆汁酸、胆固醇酯及类固醇激素的转化; 另作为胆固醇转运器, 参与细胞内、质膜间胆固醇的运输[2-4]. 在本实验中我们研究了具有家族遗传背景的胆囊胆固醇结石患者、散发性结石患者和非结石患者肝组织HMGCR, SCP2基因的表达情况. 试图探讨在家族遗传背景下和散发条件下HMGCR, SCP2基因表达情况的改变, 从而揭示二者在胆石形成中的作用.
家族遗传性胆囊胆固醇结石组为[5], 3代血缘亲属中至少2代, 而且每代中至少有1例胆固醇结石患者, 结石中胆固醇含量>50%. 散发性结石组为胆囊结石患者, 结石中胆固醇含量>50%. 对照组为原发性肝内胆管结石患者, 结石中胆固醇含量<20%; 胃、十二指肠溃疡、胃癌、结肠癌等超声证实无胆石患者. 患者及家属知情同意. 排除标准: 对胆固醇代谢可能有影响的疾病、生理状态和饮食生活因素, 如肥胖、内分泌病、酗酒、某些药物等.2003-08/2004-08南开医院外科住院家族遗传性胆囊胆固醇结石患者28例, 女15例, 男13例, 年龄25-80岁; 散发性结石患者30例, 女16例, 男14例, 年龄20-80岁; 对照组32例, 女16例, 男16例, 年龄15-78岁. 两组患者的年龄及体重指数BMI(kg/m2)无显著差别(P>0.05). 术中活检约5 mm3肝组织, 立即放入液氮保存. Taq DNA聚合酶, 购自北京金世纪生物公司; N6随机引物, Sagon公司合成; M-MLV逆转录酶和Trizol试剂购于GIBCO公司; 引物由北京奥科生物技术有限公司合成; 结石中胆固醇含量用Centric公司生化试剂盒测定.
采用Trizol法提取肝组织总RNA的, 新鲜组织标本在液氮中研磨, Trizol 匀浆后行RNA提取, 所得RNA进行浓度、纯度和完整性的检测. 取RNA 1 ug用M-MLV进行逆转录反应, 逆转录反应条件为37℃水浴中反应2 h, 所得cDNA用于PCR扩增, 产物置-20℃冻存备用. 扩增目标引物见表1.
| 基因名称 | 引物序列5'→3' | 扩增片段bp | |
| β2-Microglobulin | 上游 | ATG CCT GCC GTG TGA ACC ATGT | |
| 下游 | AGA GCT ACC TGT GGA GCA ACCT | 285 | |
| GAPDH | 上游 | GGG GAG CCA AAA GGG TCA TCA TCT | |
| 下游 | GAC GCC TGC TTC ACC ACC TTC TTG | 457 | |
| HMGCR | 上游 | TACCATGTCAGGGGTACGTC | |
| 下游 | CAAGCCTAGAGACATAATCATC | 247 | |
| SCP2 | 上游 | ATGGGTT TTC CG GAAGCCGCCAGTT | |
| 下游 | TCAGA GCTTAGCGTTGCCT GGCTG | 432 |
PCR反应条件为第1组: HMGCR/GAPDH 94℃, 3 min(94℃, 90 s→5℃, 60 s→72℃, 60s)×2872℃, 7 min; 内参照GAPDH的PCR条件同HMGCR基因, 循环数为22. 第2组: SCP2/β2-微球蛋白94℃, 3 min(94℃, 60 s→58℃, 60 s→72℃, 60 s)×2272℃, 7 min; 内参照Microglobulin的PCR条件同SCP2基因, 循环数为21. 将PCR产物加样于2 g/L琼脂糖凝胶中, 电泳后在凝胶呈像分析系统中分析目的基因PCR产物条带的灰度值及相应的内参照PCR产物条带的灰度值, 以二者的比值反映原始样品中目的基因mRNA的水平. 结石中胆固醇含量测定采用Andrew K Diehl方法[6].
统计学处理 应用SPSS10.0统计软件, 计量资料以mean±SD表示, 数据处理采用单因素方差分析, 两组间比较采用HSD检验.
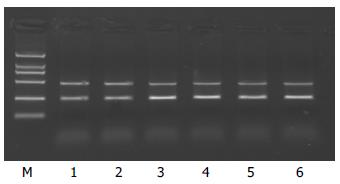
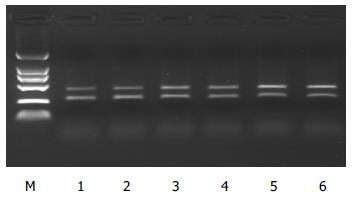
家族遗传性和非家族遗传性胆固醇结石组HMGCRmRNA表达水平较非胆固醇结石升高, 差异有显著性, P<0.05, 图1; 但家族遗传性和非家族遗传性胆固醇结石组两组间无统计学差别P>0.05, 表1. 家族遗传性和非家族遗传性胆固醇结石组SCP2mRNA表达水平较非胆固醇结石增高, 差异有显著性, P<0.05, 图2; 家族遗传性胆固醇结石组SCP2mRNA表达水平高于非家族遗传性胆固醇结石组, 差异有显著性, P<0.05, 表2.
| n | HMGCR/GAPDH Mrna A值比 | SCP2/ Micro mRNA A值比 | |
| 家族遗传性组 | 28 | 1.9269±0.2134a | 0.8908±0.1649ac |
| 非家族遗传性组 | 30 | 1.9791±0.2524a | 0.7503±0.1004a |
| 对照组 | 32 | 0.7730±0.1530 | 0.5205±0.1900 |
胆囊胆固醇结石的形成是一个多因素参与的复杂病变过程, 国内外关于胆囊胆固醇结石发病机制的研究由70年代Admirand和Small基于热力学的生物化学理论已经发展为多种因素综合作用的学说[7], 其中肝脏胆固醇代谢异常致胆汁中胆固醇过饱和, 是结石形成的首要和最重要条件之一. 目前遗传因素在胆固醇结石致石性胆汁形成中的作用研究日益受到国内外学者的重视, Pima印第安人和部分西方国家人群胆囊结石发生率高; 单卵双生者胆汁胆固醇饱和度往往相似, 这些现象提示胆石病具有遗传特征[8]. 现多数学者认为胆石病是一种具有遗传倾向的多基因遗传病, 具有常染色体显性延迟遗传特点, 多个基因的微效累积作用及后天的环境因素在其发病过程中起重要作用[9-11]. Paigen et al[12]通过对结石易感小鼠C57L/J和抗结石形成小鼠AKR/J两个株系进行遗传分析, 认为不只一个基因影响结石形成. 现已发现有许多遗传位点作用于胆汁胆固醇的过饱和、成核和胆囊的收缩, 已知染色体定位和功能的45个基因可以归纳成6类胆石病的候选基因, 但他们与胆固醇结石的确切关系需要进一步验证[13].
HMGCoA还原酶活性增高, 肝脏合成胆固醇增多, 可使胆汁中胆固醇饱和指数上升[14]. 人的HMGCoA还原酶的基因位于第13号染色体上, 其cDNA长约45 kb, 编码的HMGCoA还原酶具有888个氨基酸序列, 其中339个氨基酸序列为膜结合部位, 439个氨基酸为酶催化部位, 另有110个氨基酸连接部位, 并经分析, 人与仓鼠的HMGCoA还原酶的cDNA具有高度同源性[15]. Shoda et al[16]发现胆石症患者的HMGCoA还原酶活性比一般人群要高, 他们认为HMGCoA还原酶基因水平上升是导致胆石症的重要原因. 但Khanuja et al[17]研究了九系胆石症发病率不同的小鼠, 发现易患胆石症的C57L, SWR和A系小鼠的HMGCoA还原酶的mRNA水平没有下降, 而抗胆石症的SM, AKR, DBA/2系小鼠HMGCOA还原酶的mRNA水平显著降低; 甾醇调节元件结合蛋白(SREBP)可能是HMGCoA还原酶基因的调节因素[18]. 对于HMGR活性与胆石形成关系的争论较大, 部分学者认为结石易感小鼠HMGR mRNA表达水平升高, 而在抗结石形成小鼠HMGR mRNA表达水平变化不明显. 我们的实验发现胆固醇结石患者肝组织HMGCoA还原酶 mRNA表达水平较非胆固醇结石升高, 差异有显著性各组比较(F = 22.256, P<0.05); 与Shoda et al结果一致, 即胆石症患者的HMGCoA还原酶活性比一般人群要高, 并且mRNA水平也显著高于一般人群. 我们认为HMGCoA还原酶基因水平上升必然导致肝脏胆固醇合成增加, 使致石性胆汁出现, 导致胆石症的发生. 然而, 由于在家族遗传性和非家族遗传性胆固醇结石患者间其基因表达未发现明显差别, 所以他在遗传中的作用有待进一步研究.
SCP2基因与SCPx基因在结构上重叠相连, 为一聚合基因(fusion gene), 常称为SCP2/SCPx基因. 哺乳动物的SCP2/SCPx基因具有高度保守性[19]. SCP2/SCPx基因定位于人类染色体1p32, 全长约80 kb, 包含16个外显子和15个内含子, 已鉴定出多个转录起始点[20]. SCP2是一种分子量为13.2 ku的可溶性碱性蛋白, 最早从小鼠肝脏中被分离纯化, 且被证实肝脏中含量最高, 主要存在于肝脏的过氧化物酶体(peroxisome)、内质网、线粒体、溶酶体和胞质中. Lyons et al[21]观察到肝细胞瘤细胞过氧化物酶体中胆固醇浓度是正常小鼠肝细胞的10倍, SCP2浓度(2.5 μg/mg)却远低于对照组(8 μg/mg), 但体外培养动脉粥样硬化形成中巨噬细胞和动脉平滑肌细胞都观察到细胞内游离胆固醇浓度的升高与SCP2mRNA、SCP2同步升高现象, 故推测细胞内高浓度胆固醇决定了SCP2基因的表达水平. 动物实验证实SCP2在新合成的胆固醇转运至胆汁的过程中是必不可少, 并能将肝脏新合成的胆固醇直接从内质网快速转运至胆汁, 而不需细胞微管系统和高尔基体的介入[22]. Wang et al[23]观察到在结石易感小鼠中SCP2 mRNA与SCP2同步升高现象, 认为是SCP2转录的上调导致了SCP2含量的增多, 从而导致肝脏胆固醇和胆汁胆固醇浓度升高, 促进结石形成. 对易感小鼠的进一步研究发现在结石形成过程中Lith 1基因导致了SCP2 mRNA和SCP2的过度表达. 在实验中, 我们检测到SCP2 mRNA表达在胆固醇结石患者明显较对照组为高(F = 11.089 P<0.05), 与Fuchs, Wang et al在结石易感小鼠观察到结果不谋而合, 也与我们以往结果相同[24]; 目前认为SCP2可通过以下机制参与致石性胆汁形成: 促进7-脱氢胆固醇生成胆固醇[25-26]; 抑制C7H活性减少胆固醇向胆汁酸的转化[27]; 抑制ACAT活性减少胆固醇向胆固醇酯转化; 提高LDL-c来增加肝细胞胆固醇浓度. 因此我们认为: SCP2作用的结果是胆汁中胆固醇含量增加和胆汁酸含量减少, 形成致石性胆汁, 为胆固醇析出结晶并最终形成结石提供了必需条件. 我们同时发现家族遗传性胆固醇结石组mRNA表达水平高于非家族遗传性胆固醇结石组, 差异有显著性(P<0.05); 因此我们设想SCP2可能在胆石病的遗传中起一定的作用.
总之, 我们认为: 胆囊胆固醇结石患者肝组织HMGCR, SCP2mRNA表达水平升高, 因此HMGCR, SCP2基因表达上调可能是胆囊胆固醇结石形成的重要原因; SCP2基因表达水平上调则可能在胆石病遗传中起一定作用; 进一步验证了"肝脏是致石性胆汁产生的主要部位, 其在胆石形成中占有重要地位; 而且遗传因素在胆石病的发病中占有重要地位"这一假说.
编辑: 张海宁 电编: 潘伯荣
| 1. | Stolowich NJ, Petrescu AD, Huang H, Martin GG, Scott AI, Schroeder F. Sterol carrier protein-2: structure reveals function. Cell Mol Life Sci. 2002;59:193-212. [PubMed] |
| 2. | Atshaves BP, Storey SM, McIntosh AL, Petrescu AD, Lyuksyutova OI, Greenberg AS, Schroeder F. Sterol carrier protein-2 expression modulates protein and lipid composition of lipid droplets. J Biol Chem. 2001;276:25324-25335. [PubMed] |
| 3. | Gallegos AM, Atshaves BP, Storey SM, McIntosh AL, Petrescu AD, Schroeder F. Sterol carrier protein-2 expression alters plasma membrane lipid distribution and cholesterol dynamics. Biochemistry. 2001;40:6493-6506. [PubMed] |
| 4. | Gallegos AM, Schoer JK, Starodub O, Kier AB, Billheimer JT, Schroeder F. A potential role for sterol carrier protein-2 in cholesterol transfer to mitochondria. Chem Phys Lipids. 2000;105:9-29. [PubMed] |
| 6. | Diehl AK, Schwesinger WH, Holleman DR Jr, Chapman JB, Kurtin WE. Clinical correlates of gallstone composition: distinguishing pigment from cholesterol stones. Am J Gastroenterol. 1995;90:967-972. [PubMed] |
| 7. | Portincasa P, Moschetta A, Calamita G, Margari A, Palasciano G. Pathobiology of cholesterol gallstone disease: from equilibrium ternary phase diagram to agents preventing cholesterol crystallization and stone formation. Curr Drug Targets Immune Endocr Metabol Disord. 2003;3:87-68. [PubMed] |
| 8. | Kosters A, Jirsa M, Groen AK. Genetic background of cholesterol gallstone disease. Biochim Biophys Acta. 2003;1637:1-19. [PubMed] |
| 12. | Paigen B. Genetics of responsiveness to high-cholesterol diets in the mouse. Am J Clin Nutr. 1995;62:458-462. [PubMed] |
| 13. | Lammert F, Carey MC, Paigen B. Chromosomal organization of cadinate genes involved in cholesterol gallstone formation: a murine gallstone map. Gastroenterology. 2001;120:221-238. [PubMed] |
| 14. | Roglans N, Vazquez-Carrera M, Alegret M, Novell F, Zambon D, Ros E, Laguna JC, Sanchez RM. Fibrates modify the expression of key factors involved in bile-acid synthesis and biliary-lipid secretion in gallstone patients. Eur J Clin Pharmacol. 2004;59:855-861. [PubMed] |
| 15. | Friesen JA, Rodwell VW. The 3-hydroxy-3-methylglutaryl coenzyme-A(HMG-CoA)reductases. Genome Biol. 2004;5:248. [PubMed] |
| 16. | Shoda J, He BF, Tanaka N, Matsuzaki Y, Yamamori S, Osuga T. Primary dual defect of cholesterol and bile acid metabolism in liver of patient with intrahepatic calculi. Gastroenterology. 1995;108:1534-1537. [PubMed] |
| 17. | Khanuja B, Cheah YC, Hunt M, Nishina PM, Wang DQ, Chen HW, Billheimer JT, Carey MC, Paigen B. Lith1, a major gene affecting cholesterol gallstone formation among inbred strains of mice. Proc Natl Acad Sci USA. 1995;92:7729-7733. [PubMed] |
| 18. | Field FJ, Born E, Mathur SN. Fatty acid flux suppresses fatty acid synthesis in hamster intestine independently of SREBP-1 expression. J Lipid Res. 2003;44:1199-1208. [PubMed] |
| 19. | Atshaves BP, Storey SM, Schroeder F. Sterol carrier protein-2/sterol carrier protein-x expression differentially alters fatty acid metabolism in L cell fibroblasts. J Lipid Res. 2003;44:1751-1762. [PubMed] |
| 20. | Gallegos AM, Atshaves BP, Storey SM, Starodub O, Petrescu AD, Huang H, McIntosh AL, Martin GG, Chao H, Kier AB. Gene structure, intracellular localization, and functional roles of sterol carrier protein-2. Prog Lipid Res. 2001;40:498-563. [PubMed] |
| 21. | Lyons HT, Kharroubi A, Wolins N, Tenner S, Chanderbhan RF, Fiskum G, Donaldson RP. Elevated cholesterol and decreased sterol carrier protein-2 in peroxisomes from AS-30D hepatoma compared to normal rat liver. Arch Biochem Biophys. 1991;285:238-245. [PubMed] |
| 22. | Puglielli L, Rigotti A, Greco AV, Santos MJ, Nervi F. Sterol carrier protein-2 is involved in cholesterol transfer from the endoplasmic reticulum to the plasma membrane in human fibroblasts. J Biol Chem. 1995;270:18723-18726. [PubMed] |
| 23. | Fuchs M, Lammert F, Wang DQ, Paigen B, Carey MC, Cohen DE. Sterol carrier protein 2 participates in hypersecretion of biliary cholesterol during gallstone formation in genetically gallstone-susceptible mice. Biochem J. 1998;336:33-37. [PubMed] |
| 25. | Amigo L, Zanlungo S, Miquel JF, Glick JM, Hyogo H, Cohen DE, Rigotti A, Nervi F. Hepatic overexpression of sterol carrier protein-2 inhibits VLDL production and reciprocally enhances biliary lipid secretion. J Lipid Res. 2003;44:399-407. [PubMed] |
| 26. | Bonne AC, den Bieman MG, Gillissen GF, van Lith HA, van Zutphen LF. Chromosomal localization of genes involved in biosynthesis, metabolism or transport of cholesterol in the rat. Cytogenet Genome Res. 2002;97:183-186. [PubMed] |
| 27. | Hirai A, Kino T, Tokinaga K, Tahara K, Tamura Y, Yoshida S. Regulation of sterol carrier protein 2 (SCP2) gene expression in rat peritoneal macrophages during foam cell formation. A key role for free cholesterol content. J Clin Invest. 1994;94:2215-2223. [PubMed] |