修回日期: 2005-03-01
接受日期: 2005-03-16
在线出版日期: 2005-05-01
目的: 检测TNF-α, NF-κBmRNA在病毒性肝炎中的表达以及与肝细胞凋亡的关系.
方法: 采用免疫组织化学方法、原位杂交技术以及原位末端标记技术(TUNEL实验)检测65例病毒性肝炎患者和10例非肝病对照者肝组织中TNF-α, NF-κBmRNA的表达和肝细胞凋亡的情况.
结果: 病毒性肝炎患者肝组织中TNF-α, NF-κBmRNA阳性表达率分别为76.9%和70.3%, 明显高于对照组的20.0%和10.0%(P<0.01); TNF-α和NF-κBmRNA的表达与肝细胞凋亡密切相关(rs = 0.267和rs = 0.362, P<0.05); 病毒性肝炎患者肝组织中TNF-α, NF-κBmRNA的表达存在明显的相关性(rs = 0.385, P<0.05). 随着慢性肝炎病理损伤的程度的加重, NF-κBmRNA的阳性表达率增高(P<0.05).
结论: TNF-α, NF-κBmRNA的表达在病毒性肝炎的发病及肝细胞凋亡的发生中存在相关性. TNF-α, NF-αBmRNA的表达随着病变程度的加重而增高.
引文著录: 袁淑芳, 单鑫, 张跃新, 刘存. 病毒性肝炎肝组织TNF-α和NF-κBmRNA的表达与肝细胞凋亡. 世界华人消化杂志 2005; 13(9): 1094-1097
Revised: March 1, 2005
Accepted: March 16, 2005
Published online: May 1, 2005
AIM: To explore the expression of TNF-α antigen and NF-κBmRNA in liver tissues of hepatitis patients and its effect on hepatocyte apoptosis.
METHODS: Sixty-five paraffin setions from patients with viral hepatitis were studied, while ten cases of normal liver tissues were selected as control. Immunohistochemistry was employed to determined the expression of TNF-α antigen. NF-κBmRNA was measured by in situ hybridization. Apoptosis was detected by terminal deoxynucleotidy1 transferase mediated dUTP nick end labeling (TUNEL).
RESULTS: The expression of TNF-α antigen and NF-κBmRNA in patients with viral hepatitis were 76.9% and 70.3% respectively, which were significantly increased as compared with those (20.0% and 10.0%) in control (P<0.01). The expression of TNF-α antigen, NF-κBmRNA were significantly correlated with the apoptosis of hepatocytes (rs = 0.267 and rs = 0.362, P<0.05). There was also a significant relationship between TNF-α antigen and NF-κBmRNA expression in liver tissue of hepatitis (rs = 0.385, P<0.05). With the development of viral hepatitis, the expression of NF-κBmRNA was markedly increased (P<0.05).
CONCLUSION: TNF-α antigen and NF-κBmRNA are positively related to the occurrence, development of viral hepatitis as well as hepatocyte apoptosis.
- Citation: Yuan SF, Shan X, Zhang YX, Liu C. Expression of TNF-α antigen and NF-κBmRNA in liver tissue and its effect on hepatocyte apoptosis. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1094-1097
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1094.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1094
病毒性肝炎是我国肝硬化最常见的病因, 主要为乙型、丙型或乙型加丁型重叠感染. 其中HBV感染, 不仅可引起急性、慢性病毒性肝炎, 而且与肝纤维化、肝细胞癌(HCC)的发生、发展密切相关. 全世界大约有20亿人感染过HBV, 其中约4亿人为HBV携带者. 全球每年约有100万人死于HBV感染相关疾病, 占疾病死因的第9位[1-3]. 我国病毒性肝炎的发病居世界首位, 现有HBV患者3 000万. 由于肝炎病毒、细胞分子、凋亡相关基因、自身免疫等多种因素参与, 至今病毒性肝炎的治疗仍是当今世界面临的一个难题. 近年来研究证实肝纤维化可以逆转, 但目前尚缺乏高效、无明显副作用的药物. 目前的热点和难点是彻底弄清激活肝细胞变化的调控机制, 而凋亡作为一种可能的调控机制日益受到重视. 我们研究TNF-α, NF-κBmRNA在病毒性肝炎中的表达与肝组织炎症活动度、肝纤维化、肝细胞凋亡的情况, 来寻找一种抑制肝纤维化向肝硬变转变的新措施, 为临床肝病的诊断及治疗提供理论基础.
乙型肝炎58例, 丙型肝炎7例. 男34例, 女31例, 年龄13-59(平均34.1)岁. 汉族45例, 维族19例. 血清学证实HBsAg或抗-HCV阳性, 并采用免疫组化检测肝组织中病毒标志物. 取非肝脏疾病死亡的正常肝组织10例作对照. 肝活检标本均常规用40 g/L中性甲醛固定, 石蜡包埋. 兔抗人多克隆抗体TNF-α, NF-κB原位杂交检测试剂盒均购自博士德生物工程有限公司, 细胞凋亡检测试剂盒购自德国Boehringer Mannheim公司.
石蜡切片常规脱蜡、水化后, 过氧化物酶阻断、孵育, 加TNF-α多克隆抗体(工作浓度分别1: 80), 再加生物素标记的第2抗体及链霉菌抗生物素蛋白-过氧化物酶溶液, 室温孵育, 经DAB显色, 苏木素复染, 中性树胶封片. 石蜡切片常规脱蜡至水, 过氧化物酶阻断, 加胃蛋白酶消化液暴露核酸片段30 min, 余按NF-κBmRNA原位杂交检测试剂盒说明书逐步进行. 石蜡切片常规脱蜡、水化后, PBS漂洗, 3 ml/L H2O2甲醇封闭内原性过氧化物酶活性, 加通透性液(1 g/L TritonX-100溶解于0.1%柠檬酸钠)和TUNEL反应混合液、Converter POD, DAB显色, 显微镜下观察肝细胞凋亡. 阳性对照为1例已知阳性的重型肝炎肝组织. 阴性对照: 用正常肝组织按以上方法分别检测TNF-α, NF-κBmRNA和细胞凋亡. 并用缓冲液分别代替TNF-α多克隆抗体, NF-κBmRNA探针及TDT(末端脱氧核酸转移酶)进行对照检测. TNF-α阳性结果为细胞膜和(或)细胞质内出现棕黄色颗粒. NF-κBmRNA阳性结果为细胞核内出现棕黄色颗粒. 原位凋亡的阳性细胞为细胞核内出现棕黄色颗粒.
统计学处理 采用SPSS11.0统计分析软件进行χ2检验、四格表确切概率法、Spearman相关分析. 以P<0.05为差异有显著性.
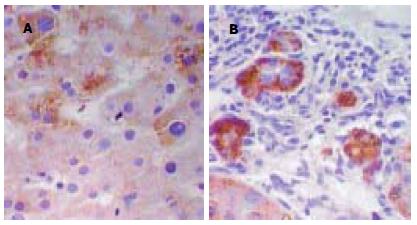
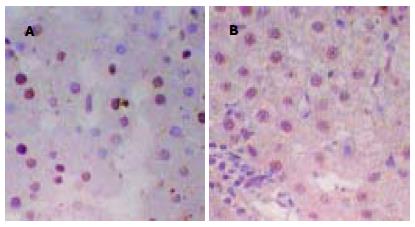
在10例正常肝组织中TNF-α, NF-κBmRNA仅有少量的表达, 而在病毒性肝炎组织中的阳性表达率均明显高于正常肝组织(P<0.01, 表1). TNF-α在肝细胞核及细胞质均有不同程度的表达, 呈弥漫型、灶型、片簇状分布于肝小叶内, 少部分在胆管上皮细胞内表达, 不少尚伴炎细胞浸润和肝细胞坏死. NF-κBmRNA活化后在细胞核表达, 阳性细胞主要在肝小叶内、汇管区, 呈点状分布. 连续切片发现部分病例TNF-α, NF-κBmRNA在肝细胞同一区域表达, 这些部位的肝细胞损害多较重. 但TNF-α阳性肝细胞分布比NF-κBmRNA阳性肝细胞分布更广泛、弥漫、阳性程度稍强(图1, 2).
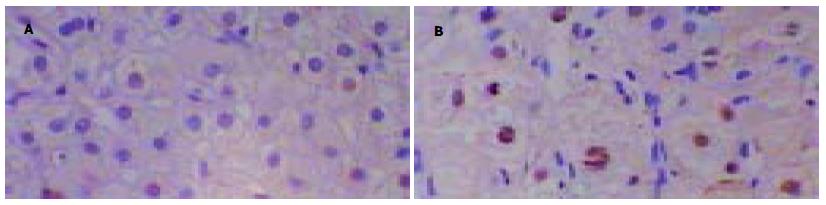
TNF-α、NF-κBmRNA表达均与肝细胞凋亡密切相关(aP<0.05). 在43例肝细胞凋亡患者中, 同时伴单纯TNF-α, NF-κBmRNA阳性者分别为37例(86.0%)、34例(79.1%). 在正常的肝组织中可见少量发生凋亡的细胞. 各种不同类型肝炎肝细胞均有不同程度凋亡. 凋亡的细胞表现为胞膜完整、核改变, 见核固缩及染色质边聚. 凋亡细胞多位于坏死区周边, 变性坏死区内可见凋亡小体, 凋亡小体也呈阳性着色, 肝小叶内也有散在分布(图3).
如表3所示: TNF-α的阳性表达程度随着炎症活动度、肝纤维化程度的加重而增高, 并与炎症坏死区和纤维化分布区域相一致, 但经统计分析无显著差异. NF-κBmRNA表达程度随炎症活动度、纤维化程度的加重而增高, 经统计分析各组之间有显著差异(P<0.05).
TNF-α是由单核巨噬细胞产生的内源性细胞因子, 其生物学效应是通过其受体TNFR1而产生[4], 其产生的信号传导途径有2条[5]: (1)是fas相关蛋白死亡域(FADD)介导的细胞凋亡; (2)通过TNF受体相关死亡域-TNF受体相关因子(TRAF2)激活核转录因子NF-κB抑制凋亡, TNFR2则通过不同于TNFR1但在某些环节可发生交叉反应的信号传导途径激活NF-κB, 使细胞增殖分化[6]. 本结果显示, 在病毒性肝炎肝组织中, TNF-α, NF-κBmRN的表达明显高于正常肝组织, 且表达程度随炎症活动度、肝纤维化程度加重而增高, 尤其在汇管区周围、肝小叶内碎屑、桥接、灶状坏死区更明显, 这与张启华et al[7]的发现一致. 我们还发现, TNF-α, NF-κBmRN在组织炎症、坏死区域分布基本一致, 这些部位的肝细胞损害多较重, 并且二者的表达呈显著相关性. 提示慢性肝病中由于多种炎症因子的诱导作用, 使NF-κB的活性持续存在, 且在肝炎病毒等因素的诱导下, TNF-α与其相应的配体结合后, 在诱发细胞凋亡的同时激活细胞内NF-κB, 从而参与肝脏的急慢性炎症或纤维化过程. 本研究显示: TNF-α的表达虽与炎症活动度、纤维化程度无统计学意义, 却反映出了表达的特点, 说明TNF-α可作为急性期反应因子参与病毒性肝炎免疫病理及炎症过程, 直接造成肝损伤, 在肝纤维化的发生、发展中占重要地位.
在病毒感染所造成的肝损害机制中, 肝细胞的异常凋亡是主要机制之一. 本资料显示, 在肝细胞凋亡较强的部位多有TNF-α, NF-κBmRN的表达, 且随肝细胞凋亡表达的增高而增加. 经原位凋亡检测发现, 凋亡细胞多位于坏死区周边, 变性坏死区内可见凋亡小体, 肝小叶内也有散在的分布, 并有大量炎细胞浸润. 并且病变早期以肝细胞凋亡为主, 病程中后期肝细胞凋亡和坏死共存. 说明肝细胞凋亡发生时常伴有肝细胞坏死, 二者均可以引起肝损伤. 正常情况下凋亡细胞的清除不伴随炎症反应. 本资料显示, 在慢性肝炎的肝组织中, 肝细胞炎症活动度越强, 凋亡细胞也越多. 提示炎症反应和凋亡并不是孤立的, 说明如果凋亡足够抗拒被清除的过程, 肝细胞凋亡可激发炎症和/或坏死. Leist et al[8-9]认为TNF-α诱导肝细胞凋亡可能是肝组织损伤的重要启动因素, 当大量凋亡的肝细胞不能为吞噬细胞清除时, 中性粒细胞受到内原性递质TNF-α的吸引而移动至肝脏, 并受到没有被迅速清除的凋亡细胞的激活, 中性粒细胞的激活可能是引起肝细胞坏死的最后过程. 另一方面可能是由于TNF-α介导的肝细胞凋亡尚有其他因素影响, 如NF-κB因子等. 但TNF-α如何启动对细胞凋亡的促进或抑制的机制尚不清楚.
在转基因动物模型的研究中发现, TNF-α可抑制HBV DNA的复制和核心蛋白的表达, 诱导肝细胞凋亡, 用抗TNF-α单抗可以阻断其凋亡[10]. Lang et al[11-12]研究TNF-α对已激活的HSC可产生凋亡诱导, 此作用能被下游效应物NF-κB所阻断. 加强TNF-α介导的HSC细胞凋亡机制的研究, 阻断TNF-α诱导的凋亡信号的传导, 可防止肝细胞凋亡和坏死, 有助于指导未来抗纤维化的治疗方案.
目前认为NF-κB主要通过以下三条途径来抑制细胞凋亡: (1)NF-κB通过调控IL-6、IL-8、TNF-α这些炎症因子的基因表达而间接抑制自身及其他细胞凋亡; (2)NF-κB[13]通过诱导或上调抗凋亡基因抑制凋亡. Wang et al[14]发现NF-κB能够激活Bcl-2家族中的Al/Bfl而抑制由TNF-α引起的细胞凋亡. 其机制主要是NF-κB作用于Caspase-3和线粒体的上游, 并能阻止细胞色素C从线粒体中释放. 细胞色素C是Caspase-3激活的促发因素, 是凋亡调控中的关键环节; (3)NF-κB通过诱导TRAF和IAP抑制凋亡[15]. 依据NF-κB抑制凋亡的理论并以之作为靶点, 导入其抑制性基因IKBs, 通过抑制NF-κB活性而增加HSC凋亡, 将成为今后病毒性肝炎、肝纤维化治疗的新途径.
编辑: 张海宁 电编: 潘伯荣
| 2. | McMahon BJ, Bulkow L, Harpster A, Snowball M, Lanier A, SaccoF , Dunaway E, Williams J. Screening for hepatocellular carcinoma in Alaska natives infected with chonic hepatitis B: a 16-year populationg-based stude. Hepatology. 2000;32:842-846. |
| 3. | Pisani P, Parkin DM, Bary F, Ferlay J. Estimates of the worldwide mortality from 25 cancers in 1990. INT J Cancer. 1999;83:18-29. |
| 7. | 张 启华, 许 正锯, 程 莉. 病毒性乙型肝炎患者血清sFAS、TNF-α、IL-6和IL-8的检测及临床意义. 细胞与分子免疫学杂志. 2001;17:445-446. |
| 8. | Leist M, Gantner F, Bohlinger I. Tumor necrosis factor-induced hepatocyte apoptosis liver failure in experimental murine shock models. Am J pathol. 1995;146:1220-1234. |
| 11. | Lang A, Brenner DA, Rippe RA. Nuclear factor KAPPA B induced resistance to tumor necrosis factor alpha mediated in hepatic stellate cells. Hepatology. 1998;28:437A. |
| 13. | 朱 波, 罗 成基. 核转录因子-κB与细胞凋亡. 国外医学临床生物化学与检验学分册. 2001;22:18-19. |
| 14. | Wang CY, Guttridge DC, Mayo MW. NF-kappa B induces expression of the Bcl-2 homologue Al/Bfl-1 to preferentially supp- ress chemotherapy-induced apoptosis. Mol Cell Biol. 1999;19:5923-5929. |