修回日期: 2005-01-11
接受日期: 2005-01-20
在线出版日期: 2005-04-15
目的: 通过观察心理应激对小鼠小肠推进运动的影响, 同时测定血浆和小肠组织中P物质(substance P, SP)和生长抑素(somatostain, SS)水平的变化, 探讨心理应激后小肠动力紊乱及其机制.
方法: 用猫恐吓鼠的方法制备心理应激模型. 用碳素墨水肠道染色法观察小肠运动, 以碳素墨水在小肠中移行距离占整段小肠长度的百分比, 其作为小肠推进百分率来观察小肠推进运动功能. 用放射免疫法测定血浆和小肠组织中SS及SP浓度.
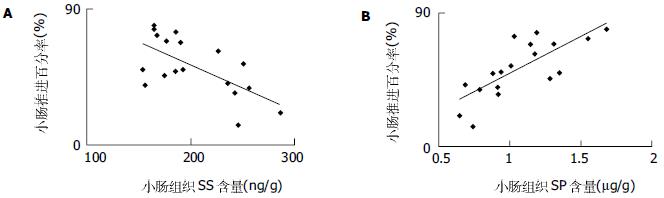
结果: 心理应激后小肠推进运动明显受抑(52.2±19.2% vs 70.2±17.8%, P<0.01). 应激组小鼠血浆和小肠组织中SS浓度较对照组明显升高(128±36 ng/L vs 91±31 ng/L, P<0.05; 203±41 ng/g vs 150±35 ng/g, P<0.01); 应激组小鼠小肠组织中SP浓度较对照组明显下降(1.07±0.29 μg/g vs 1.45±0.34 μg/g, P<0.01), 而血浆中SP浓度二者相比较无显著差异(21.6±7.8 ng/L vs 26.7±8.5 ng/L, P>0.05). 小鼠小肠推进百分率与小肠组织中SS含量呈负相关(r = -0.664, P<0.05), 与小肠组织中SP含量呈正相关(r = 0.764, P<0.05).
结论: 心理应激后小肠推进运动延缓, 其改变很可能与小肠组织中SS和SP含量变化有密切联系.
引文著录: 曹曙光, 夏宣平, 王文星, 郑君杰, 薛战雄. 心理应激对小鼠小肠运动及血浆、小肠组织中生长抑素和P物质的影响. 世界华人消化杂志 2005; 13(8): 967-970
Revised: January 11, 2005
Accepted: January 20, 2005
Published online: April 15, 2005
AIM: To investigate the effects of psychological stress on small intestinal motility and the expression of somatostain (SS) and substance P (SP) in plasma and small intestine, and to explore the relationship between small intestinal motor disorders and gastrointestinal hormones under psychological stress.
METHODS: Thirty-six mice were randomly divided into psychological stress group and control group. An animal model with psychological stress was established by housing the mice with a hungry cat in separate layers of a two-layer cage. A semi-solid colored marker (carbon-ink) was used for monitoring small intestinal transit. SS and SP levels in plasma and small intestine in mice were measured by radioimmunoassay (RIA).
RESULTS: Small intestinal transit was inhibited (52.2 % ± 19.2% vs 70.2 % ± 17.8%, P<0.01) in mice after psychological stress, compared with the controls. Plasma and small intestinal SS levels in psychological stress mice were significantly higher than those in the control group (128 ng/L % ± 36 ng/L vs 91 ng/L ± 31 ng/L, P<0.05; 203 ng/g ± 41 ng/g vs 150 ng/L % ± 35 ng/g, P<0.01). Small intestinal SP levels in psychological stress mice were significantly lower than those in the control group (1.07μg/g ± 0.29 μg/g vs 1.45μg/g % ± 0.34 μg/g, P<0.01), whereas plasma SP concentrations were not significantly different between both groups (21.6 ng/L ± 7.8 ng/L vs 26.7 ng/L ± 8.5 ng/L, P>0.05). There was significantly negative correlation between small intestinal transit and SS level in intestine (r = -0.664, P<0.05), but positive correlation between small intestinal transit and SP level in small intestine (r = 0.764, P<0.05).
CONCLUSION: Psychological stress inhibits the small intestinal transit, probably by up-regulating SS and down-regulating SP expression in small intestine.
- Citation: Cao SG, Xia XP, Wang WX, Zheng JJ, Xue ZX. Effects of psychological stress on small intestinal motility, somatostain and substance P levels in plasma and small intestine in mice. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 967-970
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/967.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.967
近年来, 随着社会的发展及各方面竞争压力的增加, 来源于社会的精神心理因素的应激对人类健康的影响越来越强烈, 并成为重要的应激原.精神心理应激可引起胃肠道功能紊乱, 一些胃肠疾病的患者如肠易激综合征、功能性消化不良, 在遭受精神心理应激后能使腹痛、腹胀等胃肠道症状加重[1-2]. 大量研究表明, 精神心理应激引起胃排空延迟[3-4]和促进结肠运动[5-6], 但对小肠运动的影响目前研究尚少. 且目前报道的有关精神心理应激的研究, 如冷应激、束缚应激、电击足底应激、强迫游泳应激等并非真正独立的精神心理应激, 均涉及躯体应激方面[7-9]. 机体遭受应激后, 通过中枢和周围神经系统影响胃肠激素的释放, 对胃肠道运动进行调节[10]. 一般认为, 生理状态下, P物质(SP)促进小肠运动[11-12], 而生长抑素(SS)抑制小肠运动[13], 但在精神心理应激状态下, 他们是否参与调节小肠运动及作用如何, 研究较少. 我们通过动物实验了解应激后SS、SP的释放量及其与小肠运动变化的可能联系, 进一步探讨胃肠激素在精神心理应激所致小肠动力紊乱中的作用.
雄性小鼠36只, 体重20-30 g, 购于江宁青龙山实验动物所. SP及SS放免试剂盒由北京海科锐生物技术中心提供.
雄性小鼠36只, 随机分为应激组和对照组, 每组18只, 两组在相同条件下饲养, 自由饮食. 心理应激模型制备[14-16]: 将应激组小鼠放入双层笼下层, 同时将一只饥饿的猫放入双层笼的上层, 使猫与鼠无生理性接触10 min后取出, 每天1次, 持续10 d. 对照组除不接触猫外, 其他处理程序与应激组相同[7]. 在造模10 d, 两组小鼠均禁食24 h, 禁水12 h, 每只小鼠给予碳素墨水0.25 mL灌胃, 25 min后, 摘眼球取血放入含EDTA二钠0.3 μL和抑肽酶1 000 kU的试管中, 并处死动物, 剖腹取出小肠(十二指肠始端至回盲部), 记录碳素墨水在小肠中移行距离及整段小肠长度, 以碳素墨水在小肠中移行距离及整段小肠长度的百分比值, 其作为小肠推进百分率来评价小肠推进运动情况[17-18]. 测量后用生理盐水冲净小肠内容物, 用吸水纸吸干水分后放置于干燥小瓶中. 试管中血液标本经混匀, 低温离心10 min(3 000/min), 分离血浆, -70℃保存待测. 小肠组织放入生理盐水中, 煮沸10 min, 用滤纸尽量吸干组织中水分, 用分析天平称质量后放置玻璃匀浆器内, 按比例加入1 mol/L冰醋酸(每100 g组织加1 mol/L冰醋酸0.3 mL), 匀浆, 再加等体积1 mol/L氢氧化钠中和, 低温离心30 min(3 000 r/min), 取上清液于-70℃保存待测. 用放射免疫法测定血浆和小肠组织中SS及SP浓度.
统计学处理 结果用mean±SD表示, 用t检验确定结果的显著性(P<0.05). 并用直线回归分析二者相关性.
碳素墨水灌胃25 min后, 应激组小肠推进百分率为52.2±19.2%, 对照组小鼠为70.2±17.8%, 应激组较对照组显著降低, 差异有显著性(n = 18, P<0.01), 提示应激后小鼠小肠推进运动功能明显延缓(表1).
应激组小鼠小肠组织中SS含量较对照组小鼠显著升高(P<0.01); 血浆中SS含量较对照组亦明显升高(P<0.05). 应激组小鼠小肠组织中SP含量显著低于对照组小鼠(P<0.05); 而血浆中SP含量与对照组相比无显著差异性(P>0.05)(表2).
有关精神心理应激与小肠运动功能的研究, 目前报道呈两种截然不同的结果, 且其中的病理生理学机制尚未完全明了. Ditto et al[19]报道应激加快小肠推进运动, 缩短小肠转运时间. 而Tsukada et al[20]发现应激抑制小肠推进运动. 本实验研究结果与Tsukada et al相近, 发现应激状态下, 碳素墨水在小鼠小肠中移行距离较对照组明显缩短, 说明心理应激抑制小肠推进运动. 既往研究显示, 胃肠运动功能障碍性疾病(如肠易激综合征)的患者, 在遭受心理应激后, 可引起腹痛、腹胀等症状[1], 这可能与应激抑制小肠推进运动功能, 导致肠道内气体不能有效地排出体外而过多在肠道潴留[21], 而引发一系列临床症状. 本结果显示, 应激后小鼠小肠组织和血浆中SS含量较对照组明显升高, 提示SS可能参与心理应激后小肠动力紊乱的调节. SS主要由胰岛、胃、肠黏膜中的D细胞分泌, 广泛地分布于胃肠道黏膜和中枢神经系统, 胃幽门区的SS浓度最高, 在十二指肠、空肠、胰腺也有很高的浓度, 在内脏神经的肠肌间和黏膜下神经丛含有SS阳性的神经元. 其受体在胃肠道内亦广泛分布. 在外周, 该激素为抑制性激素, 可抑制胃固体排空、抑制胃张力性收缩、减小进餐前后胃容量改变、延长小肠和结肠转运时间[13]. SS主要通过直接作用于肠道组织中生长抑素受体调节小肠推进运动. SS还抑制促胃液素、胆囊收缩素、胃动素等胃肠激素的分泌; SS对胃肠运动的抑制除直接作用外, 还可以抑制胃泌素引起的平滑肌细胞收缩活动[22]. 综合上述一系列研究结果, 心理应激抑制小肠推进运动的可能机制: 应激状态下, 肠道组织和血浆中SS分泌增多, 后者通过血循环以内分泌形式作用于胃肠平滑肌细胞相应的受体、经胃肠肽能神经释放递质对胃肠运动起调控作用、调节其他胃肠激素的释放, 而对小肠推进运动起抑制作用.
SP作为一种重要的胃肠肽广泛地分布于肠神经系统和整个胃肠道[23], 以空肠中含量较高, 既可以激素的形式亦可作为神经递质参与胃肠运动的调控. 大量的实验研究证明SP是胃肠运动调节中主要的兴奋性神经递质[24-25], 对胃肠道的兴奋作用表现为对胃肠纵行肌和环行肌有双重的收缩效应: 包括直接的短时作用和紧随的由胆碱能神经释放Ach引起的长时作用. Jun et al[26]发现SP通过NK-1受体作用于小肠环行肌中Cajal细胞, 影响小肠移行性复合运动(MMC)发生频律, 发挥对小肠运动的调节作用. 我们发现, 心理应激后小肠组织中SP含量较对照组明显降低, 而血浆中含量二者无显著差异, 说明应激后小肠推进运动的减慢可能与小肠组织中SP含量降低有关. Naslund et al[27]亦报道血浆中SP含量不随MMC各时相发生周期性变化, 而MMC Ⅲ相或Ⅲ相前小肠中SP浓度出现峰值, 这与本实验研究结果相一致. 这些实验结果说明, 心理应激后小肠推进运动的改变, 可能与应激影响肠腔内SP释放来调节小肠运动有关. 本结果提示, 心理应激后小肠组织中某些胃肠肽的释放, 可能是导致小肠动力紊乱的主要因素之一, 但以下问题尚需进一步研究解决: (1)应激是怎样影响小肠组织中胃肠肽的释放; (2)小肠组织中胃肠肽通过什么途径调节应激后小肠动力紊乱.
总之, 心理应激后小肠推进运动的抑制, 与小肠组织中SP减少, 血浆和小肠组织中SS升高有密切关联, 而血浆中SP含量的变化不明显, 其是否参与应激后小肠动力紊乱的调节, 有待更进一步研究.
编辑: 张海宁 电编: 潘伯荣
| 1. | Mayer EA, Naliboff BD, Chang L, Coutinho SV. Stress and irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2001;280:G519-24. [PubMed] |
| 2. | Mayer EA, Craske M, Naliboff BD. Dpression, anxiety, and the gastrointestinal system. J Clin Psychiatry. 2001;62:28-36. [PubMed] |
| 3. | Tsukada F, Nagura Y, Abe S, Sato N, Ohkubo Y. Effect of restraint and footshock stress and norepinephrine treatment on gastric emptying in rats. Biol Pharm Bull. 2003;26:368-370. [PubMed] |
| 4. | Mistiaen W, Blockx P, Van Hee R, Bortier H, Harrisson F. The effect of stress on gastric emptying rate measured with a radionuclide tracer. Hepatogastroenterology. 2002;49:1457-1460. [PubMed] |
| 5. | Martinez V, Tache Y. Role of CRF receptor 1 in central CRF-induced stimulation of colonic propulsion in rats. Brain Res. 2001;893:29-35. [PubMed] |
| 6. | Maillot C, Million M, Wei JY, Gauthier A, Tache Y. Peripheral corticotropin-releasing factor and stress-stimulated colonic motor activity involve type 1 receptor in rats. Gastroenterology. 2000;119:1569-1579. [PubMed] |
| 7. | Tsukada F, Sugawara M, Kohno H, Ohkubo Y. Evaluation of the effects of restraint and footshock stress on small intestinal motility by an improved method using a radionuclide, 51Cr, in the rat. Biol Pharm Bull. 2001;24:488-490. [PubMed] |
| 8. | Dai Y, Liu JX, Li JX, Xu YF. Effect of pinaverium bromide on stress-induced colonic smooth muscle contractility disorder in rats. World J Gastroenterol. 2003;9:557-561. [PubMed] |
| 10. | Monnikes H, Tebbe JJ, Hildebrandt M, Arck P, Osmanoglou E, Rose M, Klapp B, Wiedenmann B, Heymann-Monnikes I. Role of stress in functional gastrointestinal disorders. Evidence for stress-induced alterations in gastrointestinal motility and sensitivity. Dig Dis. 2001;19:201-211. [PubMed] |
| 11. | Li LS, Qu RY, Wang W, Guo H. Significance of changes of gastrointestinal peptides in blood and ileum of experimental spleen deficiency rats. World J Gastroenterol. 2003;9:553-556. [PubMed] |
| 12. | Linard C, Marquette C, Strup C, Aigueperse J, Mathe D. Involvement of primary afferent nerves after abdominal irradiation: consequences on ileal contractile activity and inflammatory mediator release in the rat. Dig Dis Sci. 2003;48:688-697. [PubMed] |
| 13. | Foxx-Orenstein A, Camilleri M, Stephens D, Burton D. Effect of a somatostatin analogue on gastric motor and sensory functions in healthy humans. Gut. 2003;52:1555-1561. [PubMed] |
| 17. | 王 少根, 陈 侠英, 王 立基, 汪 昌荣, 徐 凡. 严重烫伤休克期肠道运动功能的改变及意义. 中国中西医结合脾胃杂志. 2000;8:80-82. |
| 19. | Ditto B, Miller SB, Barr RG. A one-hour active coping stressor reduces small bowel transit time in healthy young adults. Psychosom Med. 1998;60:7-10. [PubMed] |
| 20. | Tsukada F, Sawamura K, Kohno H, Ohkubo Y. Mechanism of inhibition of small intestinal motility by restraint stress. Differs from that with norepinephrine treatment in rats. Biol Pharm Bull. 2002;25:122-124. [PubMed] |
| 21. | Serra J, Azpiroz F, Malagelada JR. Impaired transit and tolerance of intestinal gas in the irritable bowel syndrome. Gut. 2001;48:14-19. [PubMed] |
| 22. | Wang L, Zhou L. The signal transduction pathway involved in the effects of brain-gut peptides on gastrointestinal smooth muscle cells. Jichu Yixue Yu Linchuang. 1999;19:122-125. |
| 23. | Maake C, Kloas W, Szendefi M, Reinecke M. Neurohormonal peptides, serotonin, and nitric oxide synthase in the enteric nervous system and endocrine cells of the gastrointestinal tract of neotenic and thyroid hormone-treated axolotls (Ambystoma mexicanum). Cell Tissue Res. 1999;297:91-101. [PubMed] |
| 24. | Wheatley JM, Hutson JM, Chow CW, Oliver M, Hurley MR. Slow-transit constipation in childhood. J Pediatr Surg. 1999;34:829-832. [PubMed] |
| 25. | Lordal M, Theodorsson E, Hellstrom PM. Tachykinins influence interdigestive rhythm and contractile strength of human small intestine. Dig Dis Sci. 1997;42:1940-1949. [PubMed] |
| 26. | Jun JY, Choi S, Yeum CH, Chang IY, You HJ, Park CK, Kim MY, Kong ID, Kim MJ, Lee KP. Substance P induces inward current and regulates pacemaker currents through tachykinin NK1 receptor in cultured interstitial cells of Cajal of murine small intestine. Eur J Pharmacol. 2004;495:35-42. [PubMed] |
| 27. | Naslund E, Backman L, Theodorsson E, Hellstrom PM. Intraduodenal neuropeptide levels, but not plasma levels, vary in a cyclic fashion with the migrating motor complex. Acta Physiol Scand. 1998;164:317-323. [PubMed] |