修回日期: 2004-12-01
接受日期: 2004-12-28
在线出版日期: 2005-04-15
目的: 探讨抗原表位特异性CTL在肝炎发作中的抗病毒和肝损害作用.
方法: 用四个HBV 抗原表位肽四聚体对外周血中抗原特异性CTL进行检测, (HBV抗原表位肽分别为HBcAg18-27, 序列为FLPSDFFPSV(C18), HBsAg183-191序列为WLSLLVPFV(E183), HBeAg335-343序列FLLTRILTI(E335), 多聚酶P的575-583序列为FLLSLGIHL(P575))检测慢性乙型肝炎患者肝炎发作时病毒抗原表位特异性CTL出现频率, 统计分析抗原表位特异性CTL频率与病毒载量和血清ALT水平的相关关系. 将所有检测的病例按照血清ALT水平高低重新分组进行对比, 分析各组间抗原表位特异性CTL频率的差异.
结果: 36例慢性HBV感染患者抗原表位特异性CTL检测阳性33例(91.7%), HBeAg183-191表位特异性CTL频率高于其他三个(P<0.05). 统计分析抗原表位特异性CTL频率与病毒载量和血清ALT水平相关性不显著; 分组对比发现血清ALT升高5-10倍组多个抗原表位特异性CTL水平高于其他组(P<0.05).
结论: 慢性HBV感染患者外周血中存在抗原表位特异性CTL, 但特异性CTL的存在并不能代表保护性免疫. 认为慢性HBV感染肝炎发作时抗原表位特异性CTL反应增强, 抗原表位特异性CTL在肝炎发作过程中具有抗病毒和肝组织损害双重作用, 肝组织损害可能比较轻微, 严重的肝损害可能是非特异性细胞造成.
引文著录: 王洪, 周吉军, 夏杰, 王宇明. 抗原表位特异性CTL在慢性HBV感染肝损伤和抗病毒中的作用研究. 世界华人消化杂志 2005; 13(8): 1030-1033
Revised: December 1, 2004
Accepted: December 28, 2004
Published online: April 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 1030-1033
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/1030.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.1030
乙型肝炎病毒(hepatitis B virus HBV)是一种非直接致细胞病变的病毒, 免疫反应是HBV感染发病的主要原因. 在HBV感染发病免疫发病因素中, 细胞毒性T细胞(cytotoxic T lymphocyte CTL)是非常重要的一部分, 是清除胞内病毒的主要力量. 有资料显示CTL主要以非细胞毒机制清除病毒, 在清除病毒过程中不损伤感染肝细胞的[1]; 但也有研究认为CTL在清除细胞内病毒的同时也不可避免地造成感染肝细胞的损伤[2-3], 而且在炎症的初始阶段CTL可能是造成肝损伤的主要原因.
慢性HBV感染患者常出现肝功能转氨酶(ALT)的反复波动, 慢性乙型肝炎的自然史就是肝炎发作(hepatitis flares)和炎症消退(remissions)反复交替, 向前发展的过程. 肝炎发作后往往伴随HBeAg血清转换(HBeAg)和HBVDNA的清除, 大量研究表明慢性乙型肝炎炎症发作强度与HBeAg血清转换(HBeAg)和HBVDNA的清除率相关[4], 因此认为肝炎发作是机体免疫增强的结果. 对慢性肝炎消退期和肝炎发作期抗原表位特异性CTL的研究有利于正确认识特异性CTL在乙型肝炎发病过程中的作用. 我们采用全新的MHC/肽四聚体复合物(tetramer)技术对慢性HBV感染患者外周血抗原表位特异性CTL进行准确定量, 通过与肝功能, 血清病毒载量等临床指标的综合分析, 对特异性CTL在慢性乙型肝炎发作过程中的作用进行初步的评价, 为进一步认识特异性CTL在HBV感染发病中的作用提供资料.
1.1.1 病例: 我科2003-08/2004-06门诊和住院HBV感染患者75例, 男52例, 女23例, 18-50岁, 平均年龄26.5岁. 所有患者HBsAg持续阳性半年以上, HBeAg或HBV DNA阳性, 诊断符合2000年第十次全国传染病寄生虫病学术会议讨论修订标准, 排除HAV、HCV、HDV、HEV、HIV病毒感染(相应抗体阴性). 参照2001年AASLD肝炎防治指导方案, 将慢性肝炎(按ALT水平)分为慢性肝炎静止期(ALT≤1×ULN, upper limit of normal)和慢性肝炎发作期(ALT≥1×ULN), 并将慢性肝炎发作分为轻型(ALT≥1, <5×ULN), 中型(ALT≥5, <10×ULN), 重型(ALT≥10×ULN). HLA-A2-慢性活动性乙肝患者7例及HLA-A2+健康献血员6名为对照组.
1.1.2 试剂及来源: R-PE标记的rMHC tetramer: HLA-A*0201/FLPSDFFPSV(Tc18-27), HLA-A*0201/FLLTRILTI (Te183-191), HLA-A*0201/WLSLLVPFV(Te335-343), HLA-A*0201/FLLSLGIHL(Tp575-583)购自英国Proimmune公司; R-PE标记的亲合素购自美国Sigma公司; Cy-ChromeTM标记的鼠抗人CD8mAb 购自美国BD-PharMingen公司; Cy-ChromeTM标记的鼠IgG1mAb同型对照购自美国BD-PharMingen公司; 10×红细胞裂解液购自美国BD-PharMingen公司; FACS洗涤液(含1 g/LBSA, 0.1 g/L叠氮钠的PBS); FITC标记的鼠抗人HLA-A2mAb购自Serotec公司; TGL-16B台式离心机(上海); FACstarPlus流式细胞仪/FCM(Becton-Dickinson); 定量PCR仪(LightCycler, 敏感度为103); 7150全自动生化分析仪.
血清转氨酶水平测定采用7020全自动生化分析仪; HAV、HBV、HCVA、HDV、HEV抗原抗体系统检测采用ELISA方法(上海科华公司), 血清HBV DNA定量检测(定量PCR, 深圳匹基公司)按说明书进行. 抗原特异性CTL的检测: 采集肝素抗凝的外周静脉血2 mL, 用FITC标记的鼠抗人HLA-A2mAb直接进行免疫荧光染色流式细胞仪检测HLA-A2表型. Tetramer染色参照Proimmune公司说明书, 采用新鲜全血染色方案: 抗凝新鲜外周静脉血100 μL加入tetramer 2 μL, 20 μL PE-Cy5(或FITC)标记的CD8抗体混匀, 避光冰上孵育30 min后, 加2 mL 1×FACS裂解液室温10 min; 待细胞悬液变成真性溶液后, PBA液(含5 g/L牛血清白蛋白, 0.5 g/L 叠氮钠, 0.01 mol/L PBS)洗涤2次; 10 g/L多聚甲醛固定FACstarPlus流式细胞仪检测, BD FACS专用CELLQuestTM软件分析.
统计学处理 依ALT水平进行分组, 对Tetramer阳性率(%)进行计量统计, 以均数±标准差(mean±SD)表示, 分析各样本平均数间的差异, 采用T检验; 对病毒载量(以病毒拷贝数表示, 依对数值计算)和血清转氨酶水平进行相关性分析, 整个统计过程用SPSS12.0统计软件进行, P<0.05为有显著性意义.
在本组研究中75例慢性乙肝患者, 血清ALT从383.4-3 200.6 nkat/L, 平均3 324.0±3 550.7 nkat/L; 血清病毒拷贝数0-8.8×108copies/L, 平均5.6×105 copies/L. 经统计分析二者之间无显著相关性 (P>0.05).
在75例慢性乙肝患者有36例为HLA-A2+, 经流式细胞仪检测HLA-A2+的平均荧光强度大于90%, 对HLA-A2+HBV感染患者的tetramer染色, 以CD8+细胞设门计算tetramer+细胞频率, 在慢性乙肝患者中, HLA-A2+组和HLA-A2-组之间有显著性差异(P<0.05), 但HLA-A2-组和正常健康HLA-A2+组无明显差异(P>0.05).
HLA-A2+正常健康组及HLA-A2-慢性乙肝患者组tetramer+细胞≤0.02%. 所有HLA-A2+患者的tetramer+细胞频率以>0.02%为阳性, 33例HLA-A2+乙肝患者外周血中存在tetramer+细胞, 阳性率92%, 仅仅有3例患者外周血中四种全部≤0.02%.30例Tc18-27tetramer+性细胞, 存在频率为0.03-0.92%; Te183-191在30例患者的阳性频率为0.03-2.41%; Te 335-343 在26例患者的阳性频率为0.03-1.37%; Tp575-583在26例患者中阳性表达频率为0.03-0.6%. 在4种表位特异性CTL中, Te183-191显著高于其他三种(P<0.05), 其他之间无明显差异(P>0.05). 但4种表位特异性CTL和病毒载量相关性无显著意义(P>0.05), 以血清转氨酶水平为因变量, Tc18-27、Te183-191、Te335-343、Tp575-583为自变量进行逐步回归分析得出的回归方程无统计学意义(P>0.05).
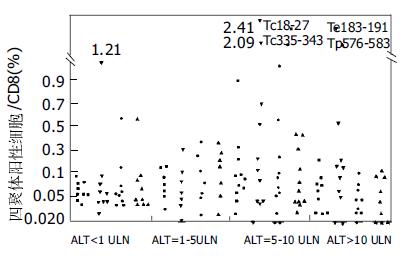
36例HLA-A2+慢性HBV感染患者按照血清ALT的高低分为ALT正常组, ALT升高1-5倍(1-5ULN), ALT升高5-10倍(5-10ULN), ALT升高大于10倍(>10ULN). 各组病例分别为9例、7例, 11例和9例. 其外周血tetramer+细胞频率见图1.
在慢性HBV肝炎患者中, ALT正常组和ALT>10ULN组抗原特异性较低, Te335-343和Tp575-583在ALT正常组高于ALT>10ULN组, 但和两组之间经统计学分析无差异. 在ALT处于5-10ULN组, Tc18-27、Te335-343和Tp575-583明显高于其他两组, 统计分析相差显著(表1).
HBV作为嗜肝细胞病毒, 病毒本身及其在体内的复制过程并不引起宿主肝细胞的损伤, HBV感染发病通常被认为是宿主细胞免疫的结果, 宿主免疫不仅具有抗病毒的作用而且也造成肝损害[5-8]. 抗原特异性CTL的重要的免疫成分, 在HBV感染发病中具有重要作用; 但其在抗病毒和肝细胞损伤中的作用仍不十分清楚, 主要原因是HBV感染, 特别是慢性HBV感染, 抗原特异性CTL数很少, 研究特异性CTL的传统方法很难检测到[8], 研究工作非常困难. 慢性乙型肝炎的自然发展过程并不是一成不变的, 在其自然过程中, 大约20%慢性携带者或非活动肝炎患者出现肝炎发作, 而且可以伴有血清HBeAg的转换和(或)病毒的清除, 提示肝炎发作过程中, 机体免疫功能是不断变化的. 对慢性乙肝肝炎发作期抗原表位特异性CTL的研究有助与阐明特异性细胞免疫在肝炎发作中的作用.
MHC/肽四聚体复合物检测抗原特异性CTL具有高效、敏感的特点, 我们曾对MHC/肽四聚体复合物与细胞内细胞因子染色检测抗原特异性CTL进行对比, MHC/肽四聚体复合物检出率明显高于细胞因子染色(此部分未公布). 目前公认MHC/肽四聚体复合物技术为定量检测表位特异性CTL的金标准[9-10], MHC/肽四聚体复合物技术给表位特异性CTL的研究提供了有效的手段, 也为进一步了解表位特异性CTL与病毒复制及肝脏损害之间的相关关系提供了可能性.
我们发现慢性活动性乙肝患者病毒载量与血清转氨酶水平无明显相关性, 支持既往关于病毒本身并不引起肝细胞损害的观点. 几乎所有慢性HBV感染患者外周血中都存在tetramer+细胞, 阳性率91.7%, 表明在慢性HBV感染时, 患者体内抗原特异性CTL与HBV并存, 特异性CTL的存在并不能代表机体的保护性反应. 本研究发现慢性HBV感染患者体内抗原特异性CTL数量在2.5%以下, 比文献报道的其他病毒感染低[11-13], 其可能的原因在多个文献中都有分析. 本实验中Te183-191平均频率高于其他三种, 其原因可能是 HBV不同抗原具有不同的免疫原性和耐受原性[14]. 比如: HBcAg的抗原性最强, 机体最容易产生抗-HBc[15]; 而慢性HBV感染患者, HBcAg特异性CTL往往很低, 可能是因为过强的免疫原造成T细胞的过度激活, 出现激活诱导性细胞死亡(activation-induced cell death, AICD). Te183-191平均频率高的原因可能与此正好相反. 在其他研究中也发现, 慢性乙型肝炎患者外周血单核细胞在HBeAg183-191的刺激下更容易产生细胞因子[16], 但Te183-191升高的临床意义仍不清楚.
对慢性HBV感染肝炎发作时抗原表位特异性CTL的研究发现, 在ALT升高5-10倍时间, 表位特异性CTL频率明显升高, 提示肝炎发作时特异性细胞免疫增强. T细胞反应低下被认为是HBV感染慢性化的一个重要原因, 慢性肝炎发作是常见的临床现象[17], 肝炎发作容易出现HBVDNA复制的终止和HBeAg血清学转换(抗病毒治疗和自然发生), 而且其发生率与ALT水平相关. 有研究发现慢性HBV感染肝炎发作患者, 血清转氨酶(ALT)的升高与核心抗原18-27的特异性CTL(Tc18-27)的增殖密切相关, 并且在急性发作时Tc18-27细胞表面HLA-DR和CCR5高表达; 而在静止期则为低表达[18]. 在本研究中也发现多个抗原表位特异性CTL数量在急性发作时升高, 提示肝炎发作时, 抗原特异性细胞免疫增强, 肝炎发作时机体处于免疫激活状态. 因此, 抗原表位特异性CTL在肝炎发作过程中具有抗病毒和肝组织损害两方面的作用, 四个抗原表位中在抗病毒和肝组织损害中的作用是否存在差异还有待于进一步的研究. 在本研究中抗原表位特异性CTL频率与病毒载量和血清ALT水平之间相关不显著, 可能是因为观察病例数少, 观察时间不够(肝炎发作后发生HBeAg血清学转换的时间在6 mo-5 a).
大量研究显示慢性乙肝发生肝炎发作时, ALT水平的高低与发生HBV DNA复制终止和HBeAg血清学转换(HBeAg消失和抗-HBe的出现)的几率平行, 肝炎发作不仅有利于拉米扶定的治疗, 而且还减少YMDD变异株的产生[19], 提示机体免疫反应与ALT水平直接相关, ALT越高, 机体免疫反应越强. 在本研究中, 重度肝炎发作(ALT>10×ULN)患者四聚体阳性细胞比ALT升高5-10倍患者低. 可能有两方面的原因, (1)抗原特异性CTL更多的隐藏在肝脏内, 因而外周血中数量少. (2)在重度肝炎发作时, 造成肝损伤的主要效应细胞不是抗原特异性CTL, 有资料也显示, 在发生肝炎发作时, 肝脏中存在大量非抗原特异性CTL, 非抗原特异性CTL是造成损伤的主要效应细胞. 目前认为CTL可通过非细胞毒机制发挥控制和清除HBV病毒的作用, 如果HBV特异性效应CD8+T细胞应答不能控制病毒复制则会直接或通过吸引其他非病毒抗原特异性T细胞聚集而造成肝病理损害[20], 而且有研究表明通过阻滞趋化因子的作用可减少抗原非特异性细胞(中性粒细胞)在肝细胞的浸润可以降低肝细胞的损害程度[21]. 我们通过对慢性HBV感染不同临床表现患者外周血中抗原表位特异性CTL数量的检测, 分析肝炎发作时抗原表位特异性CTL频率与血清ALT和病毒载量的关系, 认为慢性HBV感染肝炎发作时抗原表位特异性CTL反应增强, 抗原表位特异性CTL在肝炎发作过程中具有抗病毒和肝组织损害双重作用, 但由抗原表位特异性CTL造成的肝组织损害可能比较轻微, 严重的肝损害可能是非特异性细胞造成.
编辑: 张海宁
| 1. | Guidotti LG, Chisari FV. Noncytolytic control of viral infections by the innate and adaptive immune response. Annu Rev Immunol. 2001;19:65-91. [PubMed] |
| 2. | Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect Dis. 2002;2:395-403. [PubMed] |
| 3. | Guidotti LG. The role of cytotoxic T cells and cytokines in the control of hepatitis B virus infection. Vaccine. 2002;20:A80-A82. [PubMed] |
| 4. | Perrillo RP, Lai CL, Liaw YF, Dienstag JL, Schiff ER, Schalm SW, Heathcote EJ, Brown NA, Atkins M, Woessner M. Predictors of HBeAg loss after lamivudine treatment for chronic hepatitis B. Hepatology. 2002;36:186-194. [PubMed] |
| 5. | Liaw YF. Hepatitis flares and hepatitis B e antigen seroconversion: implication in anti-hepatitis B virus therapy. J Gastroenterol Hepatol. 2003;18:246-252. [PubMed] |
| 6. | Tang TJ, Kwekkeboom J, Laman JD, Niesters HG, Zondervan PE, de Man RA, Schalm SW, Janssen HL. The role of intrahepatic immune effector cells in inflammatory liver injury and viral control during chronic hepatitis B infection. J Viral Hepat. 2003;10:159-167. [PubMed] |
| 7. | Thimme R, Wieland S, Steiger C, Ghrayeb J, Reimann KA, Purcell RH, Chisari FV. CD8(+)T cells mediate viral clearance and disease pathogenesis during acute hepatitis B virus infection. J Virol. 2003;77:68-76. [PubMed] |
| 8. | Wieland SF, Spangenberg HC, Thimme R, Purcell RH, Chisari FV. Expansion and contraction of the hepatitis B virus transcriptional template in infected chimpanzees. Proc Natl Acad Sci USA. 2004;101:2129-2134. [PubMed] |
| 9. | Tsai SL, Lee TH, Chien RN, Liao SK, Lin CL, Kuo GC, Liaw YF. A method to increase tetramer staining efficiency of CD8+T cells with MHC-peptide complexes: therapeutic applications in monitoring cytotoxic T lymphocyte activity during hepatitis B and C treatment. J Immunol Methods. 2004;285:71-87. [PubMed] |
| 10. | Appay V, Rowland-Jones SL. The assessment of antigen-specific CD8+ T cells through the combination of MHC class I tetramer and intracellular staining. J Immunol Methods. 2002;268:9-19. [PubMed] |
| 11. | Callan MF, Tan L, Annels N, Ogg GS, Wilson JD, O'Callaghan CA, Steven N, McMichael AJ, Rickinson AB. Direct visualization of antigen-specific CD8+ T cells during the primary immune response to Epstein-Barr virus In vivo. J Exp Med. 1998;187:1395-1402. [PubMed] |
| 12. | Belz GT, Xie W, Doherty PC. Diversity of epitope and cytokine profiles for primary and secondary influenza a virus-specific CD8+ T cell responses. J Immunol. 2001;166:4627-4633. [PubMed] |
| 13. | Chen G, Shankar P, Lange C, Valdez H, Skolnik PR, Wu L, Manjunath N, Lieberman J. CD8 T cells specific for human immunodeficiency virus, Epstein-Barr virus, and cytomegalovirus lack molecules for homing to lymphoid sites of infection. Blood. 2001;98:156-164. [PubMed] |
| 14. | Kakimi K, Isogawa M, Chung J, Sette A, Chisari FV. Immunogenicity and tolerogenicity of hepatitis B virus structural and nonstructural proteins: implications for immunotherapy of persistent viral infections. J Virol. 2002;76:8609-8620. [PubMed] |
| 15. | Ferrari C, Missale G, Boni C, Urbani S. Immunopathogenesis of hepatitis B. J Hepatol. 2003;39:S36-S42. [PubMed] |
| 16. | Reignat S, Webster GJ, Brown D, Ogg GS, King A, Seneviratne SL, Dusheiko G, Williams R, Maini MK, Bertoletti A. Escaping high viral load exhaustion: CD8 cells with altered tetramer binding in chronic hepatitis B virus infection. J Exp Med. 2002;195:1089-1101. [PubMed] |
| 17. | Lok AS, McMahon BJ; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Chronic hepatitis B. Hepatology. 2001;34:1225-1241. [PubMed] |
| 18. | Shimada N, Yamamoto K, Kuroda MJ, Terada R, Hakoda T, Shimomura H, Hata H, Nakayama E, Shiratori Y. HBcAg-specific CD8 T cells play an important role in virus suppression, and acute flare-up is associated with the expansion of activated memory T cells. J Clin Immunol. 2003;23:223-232. [PubMed] |
| 19. | Tsubota A, Arase Y, Suzuki F, Kobayashi M, Matsuda M, Sato J, Suzuki Y, Akuta N, Sezaki H, Hosaka T. Severe acute exacerbation of liver disease may reduce or delay emergence of YMDD motif mutants in long-term lamivudine therapy for hepatitis B e antigen-positive chronic hepatitis B. J Med Virol. 2004;73:7-12. [PubMed] |
| 20. | Maini MK, Boni C, Lee CK, Larrubia JR, Reignat S, Ogg GS, King AS, Herberg J, Gilson R, Alisa A. The role of virus-specific CD8(+)cells in liver damage and viral control during persistent hepatitis B virus infection. J Exp Med. 2000;191:1269-1280. [PubMed] |
| 21. | Sitia G, Isogawa M, Kakimi K, Wieland SF, Chisari FV, Guidotti LG. Depletion of neutrophils blocks the recruitment of antigen-nonspecific cells into the liver without affecting the antiviral activity of hepatitis B virus-specific cytotoxic T lymphocytes. Proc Natl Acad Sci USA. 2002;99:13717-13722. [PubMed] |