修回日期: 2005-02-28
接受日期: 2005-03-03
在线出版日期: 2005-04-01
目的: 探讨热处理BGC-823人胃癌细胞后, HSP70表达与细胞凋亡及超微结构改变的关系.
方法: 采用MTT法及流式细胞术对BGC-823胃癌细胞株在42℃及43℃两个温度, 分别热处理2、7、12 h后, 进行细胞增生、凋亡及HSP表达测定, 同时在透射电镜下观察肿瘤细胞的超微结构特点.
结果: 高热对肿瘤细胞的杀伤作用明显, 各加热组均可使BGC-823细胞高表达HSP70, 在43℃条件下热休克7 h后, HSP70表达量最高, 并与细胞的凋亡有关. 随着时间延长, 对肿瘤细胞超微结构的影响加大. 大多数细胞表现出染色质浓缩、DNA分裂的形态学特征.
结论: 热处理对肿瘤细胞具有杀伤作用, 43℃/7 h为诱导BGC-823细胞凋亡的最适宜条件, 凋亡是BGC-823细胞热诱导死亡的重要机制, 热处理后HSP70过表达可能与肿瘤细胞凋亡有关.
引文著录: 戴洁, 邵雪辉, 孙黎, 薄爱华, 刘开洋, 李海锋. 温热对BGC-823胃癌细胞HSP70表达及超微结构的影响. 世界华人消化杂志 2005; 13(7): 913-915
Revised: February 28, 2005
Accepted: March 3, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 913-915
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/913.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.913
细胞在受到各种理化及生物因素(应激素)刺激时, 所诱导合成的热休克蛋白(heat shock protein, HSP)具有多种生物学活性[1-3]. 许多资料显示, HSP在多种肿瘤中有异常表达, 并与肿瘤的分化、增生、凋亡有关[4-7]. 近年来, 在肿瘤免疫激活原理的研究中发现HSP参与机体特异性抗肿瘤免疫反应[8], 其表达量与肿瘤免疫原性强弱密切相关[9-11], 而且肿瘤组织中的HSP-肽复合物具有肿瘤疫苗作用[12-16]. 为进一步探讨HSP在肿瘤发生、发展中的作用机制, 我们利用加热法作用于BGC-823胃癌细胞, 观察体外加热诱导肿瘤细胞HSP70蛋白的表达及其对肿瘤细胞超微结构的影响, 为研究HSP的抗肿瘤作用及其肿瘤的综合治疗提供更多的资料和依据.
人胃腺癌细胞系BGC-823由北京市肿瘤研究所建株.鼠抗人HSP70单克隆抗体, 工作液浓度1/100(武汉博士德生物工程有限公司); Streptavidin peroxidase试剂盒(北京中山生物技术有限公司). 羊抗鼠FITC-IgG(Jackson Immunoresearch Laboratories, Inc.), 工作液浓度1/100.
1.2.1 细胞培养与分组: BGC-823细胞常规培养于含100 mL/L胎牛血清的RPMI 1640培养基中, 细胞收获采用胰蛋白酶消化法. 加热组: 将铺成单层且处于对数生长期的细胞培养瓶放入水浴中加热, 设42℃及43℃两个温度, 分别于精密恒温水浴箱中加热2、7、12 h, 每组重复3次, 置37℃ CO2培养箱, 饱和水蒸汽下平衡2 h后检测. 阴性对照组: 37℃恒温培养.
1.2.2 MTT法检测细胞生长抑制率: 将BGC-823细胞接种于96孔板(3×103/孔), 待24 h后处于对数生长期且铺成单层时加热. 做4个复孔. 检测时, 每孔加入MTT50 μL, 继续培养4 h, 弃去上清, 加DMSO 100 μL, 酶联免疫检测分析仪测定490 nm处吸收光值(A490). 细胞生长抑制率按下列公式计算:
抑制率(%) = (对照孔A490 - 实验孔A490)/对照孔A490 × 100%
1.2.3 流式细胞术检测胃癌细胞HSP70的表达: 采用间接免疫荧光标记方法, 将细胞数调整为1×109/L, 每份样品分别加入第一抗体(鼠抗人HSP70mAb)工作液100 μL, 37℃水中温浴30 min. PBS离心洗涤. 第二抗体工作液100 μL, 37℃水中温浴30 min. 美国BD公司生产的FACS420型流式细胞仪, 分别进行单参数检测, 以对数方式采集数据, HP-300 Consort 30计算机处理.
1.2.4 电镜样本制备: 取43 ℃加热处理2、7、12 h各组及对照组细胞消化, 25 g/L戊二醛固定, 2 500 r/min离心, 去上清, 细胞团经10 g/L锇酸后固定、丙酮脱水、浸透、树脂包埋、超薄切片、铀-铅复染、透射电镜下观察.
统计学处理 应用SPSS10.0对数据进行t检验及Spearman等级相关进行分析.
加热法能有效抑制BGC-823细胞生长, 其细胞生长抑制率为61.3%±3.2%.
试验组较对照组细胞贴壁率、伸展率变化明显. 加热42℃ 2 h时, 部分细胞变圆, 少数浮起, 大多数细胞核结构存在, 核仁明显.42℃ 7 h时, 可见细胞融合, 坏死较明显.12 h时大多数细胞变圆、浮起. 加热43℃ 2 h时大多数细胞变圆, 核染色质聚集或核内空泡形成, 少数细胞裂解.43℃ 7 h镜下见较多细胞碎片, 细胞融合及坏死明显.43℃ 12 h时, 细胞数目明显减少, 大部分细胞死亡、裂解, 并凝结成小团; 残留细胞萎缩聚合成团.
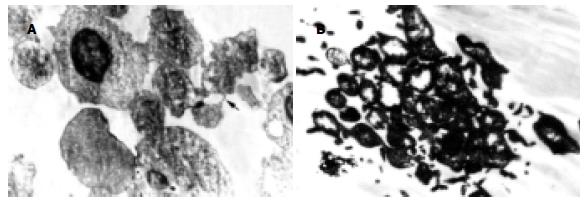
超薄切片可见加热组细胞较对照组细胞变化明显, 其中主要为细胞核、其次为线粒体及细胞膜.43℃加热处理2 h后, 细胞表面微绒毛减少, 线粒体变性肿胀、嵴断裂、内质网脱颗粒或结构不清或消失, 胞浆内空泡增多, 但质膜破裂不明显. 加热7 h后, (1)细胞核的变化明显. 可见核染色质浓缩、核裂解呈数块小体, 并可见胞质内容物及胞膜出芽现象(图1A-B); (2)少部分细胞核异染色质消失, 电子密度减低呈均质状. 核仁相随染色质消失, 丝状物不明显, 使核仁电子密度高低不等. 有的核仁裂解呈数块, 偶见圈状核仁; (3)7 h组还可见部分细胞质膜局部溶解、破裂, 甚至消失, 出现细胞融合. 细胞器肿胀, 局部堆积, 线粒体嵴断裂、部分呈髓鞘样变性. 胞质中水肿液聚集形成低电子密度空泡, 大小不等.12 h组, (1)细胞破坏明显, 可见许多膜状结构, 并见细胞裂解呈数块小体. (2)一些尚存细胞体积较小, 胞质内细胞器明显减少, 次级溶酶体增加.
大量资料表明, 肿瘤组织中存在着高表达的HSP, 但其生物学作用, 目前报道仍不完全一致. 一些实验表明, 当细胞从细胞分裂的G0期进入G1期, 伴随着热休克蛋白的产生. 转化中的细胞, 其增生活性可以影响HSP70的诱导. 提示热休克蛋白与肿瘤增生存在着一定关系[4,6,17]. 在HSP与肿瘤细胞凋亡的关系研究中, 很多实验已证实二者关系密切. 至今已有许多关于HSP与肿瘤细胞凋亡抑制方面的报道[18-21]. 尽管HSP70的表达绝大多数情况下保护细胞逃逸凋亡, 但还是有实验显示出一种HSP70水平与细胞凋亡率间的平行关系[22]. 也有报道表明, HSP通过影响细胞增生过程必需的蛋白构象而参与细胞周期, 影响着c-myc、src、p53、Rb等肿瘤基因的表达和功能[23-27]. 傅庆国et al发现HSP70作为肿瘤抗原在诱导抗肿瘤免疫中具有双重性[28-30]. Galli et al发现当靶细胞处于不同的生长环境时, HSP能发挥两种截然不同的作用: 既促进死亡又促进生长[29].
综合分析表明, HSP不是在一个水平, 以一种途径参与细胞增生、凋亡等生理、病理活动, 因而对HSP研究尚有许多问题需要深入探讨.
我们利用传统加热法作用于BGC-823人胃癌细胞株, 采用MTT法及流式细胞术对BGC-823胃癌细胞株在不同休克温度(42℃、43℃)、不同休克时间下(2 h、7 h、12 h)进行了生存率试验及HSP表达测定, 结果显示, 体外加热可诱导肿瘤细胞迅速产生HSP70, BGC-823细胞在43℃条件下热休克7 h后, HSP70表达最高, 同时细胞生长抑制率、凋亡率也显著高于对照组, 提示我们BGC-823细胞在热处理时, 生长抑制与发生凋亡可能与HSP70表达有关.43℃/7 h应为BGC-823细胞最佳的非致死性休克温度条件.
细胞的功能、代谢与细胞的形态、结构密不可分, 在探讨HSP与细胞增生与凋亡的关系时, 人们注意到细胞在受到热损伤因子作用后, 除引起HSP表达增加, 常伴随酶等蛋白质功能、代谢和结构改变, 细胞结构变化往往出现较晚, 且这方面的报告较少. Li et al在研究Rat-1中成纤维细胞热诱导的凋亡时发现, 44℃/1 h热处理后, 大多数细胞在 1 d内出现凋亡的形态学改变[6]. 他们提出凋亡是某些细胞株热诱导死亡的重要机制. 我们的实验支持这一结论, 并报告了43℃温热对肿瘤细胞超微结构的影响. 概括起来有如下特点: 首先, 热休克时间不同, 对肿瘤细胞的影响不一, 43℃/2 h以细胞变性为主; 43℃/7 h以细胞坏死为主; 43℃/12 h大多数坏死, 部分细胞仍存活. 其次, 温热引起的细胞超微结构改变的主要为染色质浓缩、DNA裂解以及胞质内容物、胞膜"出芽", 即细胞凋亡的形态学特点, 随着时间延长, 出现细胞膜的改变. 说明BGC-823细胞热诱导死亡的过程中, 凋亡是不可缺少的重要机制. 再次, 部分萎缩细胞的存活表明即使是同克隆的肿瘤细胞对热的耐受力也不相同. 实验进一步从形态学上证明HSP70水平与细胞凋亡之间的平行关系, 温热对肿瘤细胞超微结构的影响可能与HSP的作用分不开. 除HSP外, 可能还有其他与肿瘤增生、凋亡相关基因的作用有关, 这方面的研究工作正在进行中.
编辑: 张海宁
| 3. | Hang H, He L, Fox MH. Cell cycle variation of Hsp70 levels in HeLa cell at 37 degrees C and after a heat shock. J Cell Physiol. 1995;165:367-375. |
| 4. | Wei YQ, Zhao X, Kariya Y, Teshigawara K, Uchida A. Inhibition of proliferation and induction of apoptosis by abrogation of heat-shock protein (HSP)70 expression in tumor cells. Cancer lmmunol Immunother. 1995;40:73-78. [PubMed] |
| 5. | Darimont BD. The Hsp90 chaperone complex-A poteitial target for cancer therapy? World J Gastroenterol. 1999;5:195-198. [PubMed] |
| 6. | Liu XL, Xiao B, Yu ZC, Guo JC, Zhao QC, Xu L, Shi YQ, Fan DM. Down-regulation of Hsp90 could change cell cycle distribution and increase drug sensitivity of tumor cells. World J Gastroenterol. 1999;5:199-208. [PubMed] |
| 7. | Buzzard KA, Giaccia AJ, Killender M, Anderson RL. Heat shock protein 72 modulates pathways of stress-induced apoptosis. J Biol Chem. 1998;273:17147-17153. [PubMed] |
| 9. | Melcher A, Todryk A, Hardwick N, Ford M, Jacobson M, Vile RG. Tumor immunogenicity is determined by the mechanism of cell death via induction of heat shock protein expression. Nat Med. 1998;4:581-587. [PubMed] |
| 10. | Todryk S, Melcher AA, Hardwick N, Linardakis E, Bateman A, Colombo MP, Stoppac A, Vile RG. Heat shock protein 70 induced during tumor cell killing induces Th1 cytokines and targets immature dendritic cell precursors to enhance antigen uptake. J Immunol. 1999;163:1398-1408. [PubMed] |
| 11. | Masse D, Ebstein F, Bougras G, Harb J, Meflah K, Gregoire M. Increased expression of inducible HSP70 in apoptotic cells is correlated with their efficacy for antitumor vaccine therapy. Int J Cancer. 2004;111:575-583. [PubMed] |
| 12. | Blachere NE, Li Z, Chandawarkar RY, Suto R, Jaikaria NS, Basu S, Udono H, Srivastava PK. Heat shock protein-peptide complexes, reconstituted in vitro, elicit peptide-specific cytotoxic T lymphocyte response and tumor immunity. J Exp Med. 1997;186:1315-1322. [PubMed] |
| 13. | 陈 晓虹. 热休克蛋白与肿瘤免疫治疗. 中国肿瘤生物治疗杂志. 2002;9:65-67. |
| 14. | Sato N, Torigoe T. The molecular chaperones in cell cycle control. Ann N Y Acad Sci. 1998;30:851: 61-66. [PubMed] |
| 15. | Selkirk JK, He C, Patterson RM, Merrick BA. Tumor suppressor p53 gene forms multiple isoforms: evidence for single locus origin and cytoplasmic complex formation with heat shock proteins. Electrophoresis. 1996;17:1764-1771. [PubMed] |
| 16. | He L, Fox MH. Comparison of flow cytometry and western blotting to measure Hsp70. Cytometry. 1996;25:280-286. [PubMed] |
| 17. | Gabai VL, Zamulaeva IV, Mosin AF, Makarova YM, Mosina VA, Budagova KR, Malutina YV, Kabakov AE. Resistance of Ehrlich tumor cells to apoptosis can be due to accumulation of heat shock proteins. FEBS Lett. 1995;375:21-26. [PubMed] |
| 18. | Samali A, Cotter TG. Heat shock proteins increase resistance to apoptosis. Exp Cell Res. 1996;223:163-170. [PubMed] |
| 19. | Jin ZH, Matsumoto H, Hayashi S, Hatashita M, Ohtsubo T, Shioura H, Kitai R, Kano E. P53-independent thermosensitiza-tion by mitomycin C in human non-small-cell lung cancer cells. Int J Radiat Oncol Biol Phys. 2004;59:852-860. [PubMed] |
| 20. | Gehrmann M, Brunner M, Pfister K, Reichle A, Kremmer E, Multhoff G. Differential up-regulation of cytosolic and membrane-bound heat shock protein 70 in tumor cells by anti-inflammatory drugs. Clin Cancer Res. 2004;10:3354-3364. [PubMed] |
| 21. | Edwards KM, Munger K. Depletion of physiological levels of the human TID1 protein renders cancer cell lines resistant to apoptosis mediated by multiple exogenous stimuli. Oncogene. 2004;23:8419-8431. [PubMed] |
| 22. | Chant ID, Rose PE, Morris AG. Susceptibility of AML cells to in vitro apoptosis correlates with heat shock protein70 (HSP70) expression. Br J Haematol. 1996;93:898-902. |
| 23. | Abd el All H, Rey A, Duvillard P. Expression of heat shock protein70 and c-myc in cervical carcinoma. Anticancer Res. 1998;18:1533-1536. [PubMed] |
| 24. | Selkirk JK, Merrick BA, Stackhouse BL, He C. Multiple p53 protein isoforms and formation of oligomeric complexes with heat shock protein Hsp70 and Hsp90 in the human mammary tumor, T47D, cell line. Appl Theor Electrophor. 1994;4:11-18. [PubMed] |
| 25. | Li DP, Li Calzi S, Sanchez ER. Inhibition of heat shock factor activity prevents heat shock potentiation of glucocorticoid receptor-mediated gene expression. Cell Stress Chaperones. 1999;4:223-234. [PubMed] |
| 26. | Le Bihan S, Marsaud V, Mercier-Bodard C, Baulieu EE, Mader S, White JH, Renoir JM. Calcium/calmodulin kinase inhibitors and immunosuppressant macrolides rapamycin and FK506 inhibit progestin- and glucocorticosteroid receptor-mediated transcription in human breast cancer T47D cells. Mol Endocrinol. 1998;12:986-1001. [PubMed] |
| 28. | 傅 庆国, 孟 凡东, 郭 克建, 郭 仁宣. 热休克蛋白70在诱导肿瘤免疫中的效应. 中华微生物学和免疫学杂志. 2003;23:31-33. |
| 29. | Galli G, Ghezzi P, Mascagni P, Marcucci F, Fratelli M. Mycobacterium tuberculosis heat shock protein 10 increases both proliferation and death in mouse P19 teratocarcinoma cells. In Vitro Cell Dev Biol Anim. 1996;32:446-450. [PubMed] |