修回日期: 2005-02-01
接受日期: 2005-02-02
在线出版日期: 2005-04-01
目的: 了解YMDD变异阴性的拉米夫定耐药患者体内HBV逆转录酶基因变异情况.
方法: 采用PCR产物直接测序方法对3例YMDD变异阴性的拉米夫定耐药患者体内HBV RT区基因序列进行分析.
结果: 3份标本核苷酸变异率为0.24-0.85%, 氨基酸变异率均为0.73%, 较既往GenBank中收录的HBV C型基因序列的变异率无明显差别. 发现以往已发表序列中未出现的新型变异-rtQ125N变异.
结论: 部分拉米夫定表型耐药现象的出现可能与HBV RT区基因变异无关.
引文著录: 冯鑫, 闫杰, 王磊, 宋淑静, 张四平, 张剑平, 谢雯, 李蕴铷. YMDD变异阴性的拉米夫定表型耐药患者体内乙型肝炎病毒逆转录酶基因序列分析. 世界华人消化杂志 2005; 13(7): 911-912
Revised: February 1, 2005
Accepted: February 2, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 911-912
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/911.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.911
拉米夫定(Lamivudine)具有抑制乙肝病毒(HBV)复制之功能, 用于治疗慢性HBV感染近期疗效已得到肯定; 但随着服药时间的延长, 耐药现象的出现影响了其远期疗效[1]. HBV YMDD变异是的拉米夫定耐药的主要原因, 但尚有部分表型耐药患者血清中未检出该变异株[2]. 为了解YMDD变异阴性的拉米夫定耐药患者体内HBV逆转录酶(reverse transcriptase, RT)基因变异情况, 我们采用PCR产物直接测序方法对此类患者体内HBV RT区基因序列进行分析.
自北京地坛医院就诊的慢性HBV感染者中选取3例出现表型耐药但YMDD变异阴性患者作为研究对象; 采集出现表型耐药后继续拉米夫定治疗4 mo时血清, 于-70℃保存备用.3患者均为男性, 年龄22-36岁, 临床诊断符合2000年第十次全国病毒性肝炎与肝病学术会议修订的病毒性肝炎诊断标准[3]; 治疗方法为拉米夫定(贺普丁, 由英国葛兰素公司生产)100 mg, 每日一次; 每2 mo随访1次, 检测肝功能、HBV DNA及HBVM(表1).
| 病例号 | 年龄(岁) | 性别 | 治疗前 | 耐药时间(mo) | 耐药后4 mo时 | ||||||||
| ALT (nkat) | TBIL(mmol/L) | HBeAg | Anti- HBe | HBV DNA(copies/L) | ALT (nkat) | TBIL(μmol/L) | HBeAg | Anti-HBe | HBVDNA (copies/L) | ||||
| 361 | 36 | M | 1 617.0 | 19 | - | + | 3.5×107 | 6 | 333.4 | 12 | - | + | 2.6×107 |
| 368 | 22 | M | 9 952.0 | 81 | + | - | 1.6×1011 | 6 | 266.7 | 8 | + | - | 9.8×109 |
| 452 | 29 | M | 1 050.2 | 12 | + | - | 7.3×109 | 12 | 183.4 | 14 | + | - | 8.5×108 |
1.2.1 病毒DNA的抽提: 采用异硫氰酸胍一步法提取血清中的DNA. 待检血清50 μL加入含4 mol/L异硫氰酸胍的裂解液60 μL, 37℃温育10 min; 加入酚/氯仿/异戊醇(25: 24: 1)50 μL, 震荡混匀后13 000 g离心10 min; 取上清, 加入等量异丙醇, -20℃沉淀2 h, 13 000 g离心10 min, 弃上清; 加入600 mL/L乙醇50 μL, 13 000 g离心10 min, 弃上清, 室温干燥后加入20 μL双蒸水溶解, -20℃保存.
1.2.2 HBV基因型检测: 采用巢式PCR技术进行HBV基因型检测, 具体方法见参考文献[4].
1.2.3 YMDD变异检测: 采用错配PCR-限制性片段长度多态性分析(mpPCR-RFLP)的方法.
1.2.4 巢式PCR引物设计: 检索GenBank收录的HBV基因全序, 采用Primer Premier 5.0及Oligo 6.67软件辅助分析, 于HBV RT区内设计巢式PCR引物, 其中外引物: P1: 5'-CCTCACCCATATCGTCAA-3'(nt105-122), P2: 5'-GAGCCACAAAGGTTCCAC-3'(nt1255-1238); 内引物: P3: 5'-GCACCGAACATGGAGAAC-3'(nt146-163), P4: 5'-AGGCAGGATAGCCACATT -3'(nt1051-1034)(引物由上海生工生物技术公司合成).
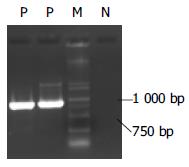
1.2.5 巢式PCR反应: 30 μL PCR反应体系含Takara Ex TaqTM DNA聚合酶(购自大连宝生物工程有限公司)1U、10×扩增缓冲液3 μL、25 mol/L dNTP 0.12 μL、50 μmol/L引物0.12 μL; 第一轮PCR模板为血清抽提物6 μL, 引物为P1、P2; 第二轮PCR模板为第一轮PCR产物3 μL, 引物为P3、P4. 两轮PCR循环温度条件均为94℃ 3 min, 94℃ 45 s、55℃ 45 s、72℃ 45 s, 共30循环, 72℃ 7 min. 取第二轮PCR产物8 μL, 以10 g/L琼脂糖凝胶电泳, EB染色后于紫外灯下观察结果, 于906 bp处出现荧光条带者为阳性.
1.2.6 PCR产物测序: 将第二轮PCR产物经10 g/L低熔点琼脂糖凝胶电泳纯化后, 分别以P3、P4为测序引物, 应用双脱氧末端终止法进行序列测定(由北京鼎国生物技术公司完成).
1.2.7 序列分析: 基因型检测结果显示各标本均为C型, 故选取GenBank中收录的HBV C型基因序列50条(均与拉米夫定治疗无关), 生成共享序列(consensus); 并从中随机选取6条(AB014378、AF223960、AF068756、D23683、AB014389、AF458664)与3份标本测序结果一同进行核苷酸序列及氨基酸序列分析. 序列分析应用DNAstar、clustalx、GeneDoc等分子生物学软件完成.
阳性标本PCR产物大小与预期值相符, 为906 bp(图1).
3份标本均成功测序, 有效序列长度为819 bp(nt193-1011). 测序结果已提交至GenBank, 其序列号(accession number)分别为: AY812742、AY812743、AY812744.
3份标本核苷酸变异率为0.24-0.85%, 氨基酸变异率均为0.73%, 较既往GenBank中收录的HBV C型基因序列的变异率无明显差别(表2). 进一步分析发现: 标本452序列中出现的rtQ125N变异在以往发表序列中未检索到; 3份标本HBV RT区的其他氨基酸变异均处于非保守区域内, 在已发表的HBV C型序列中均可见到.
| 核苷酸序列(%) | 氨基酸序列(%) | |
| AB014378 | 2.31 | 2.19 |
| AB014389 | 1.22 | 2.56 |
| AF068756 | 2.07 | 1.46 |
| AF223960 | 3.05 | 2.93 |
| AF458664 | 0.36 | 0.73 |
| D23683 | 2.31 | 1.83 |
| 361 | 0.61 | 0.73 |
| 368 | 0.85 | 0.73 |
| 452 | 0.24 | 0.73 |
HBV P基因YMDD变异(rtM204V/I)及L528M变异(rtL180M)是目前公认的拉米夫定耐药变异, 但上述变异仅能解释75%的拉米夫定耐药现象[2], 尚有部分表型耐药患者体内未发现此类变异. 潘小平et al曾报道表型耐药患者存在PCR-RFLP法不能准确检测的YMDD变异(G743C/A). 此外, 在拉米夫定治疗中曾发现rtL80V/I、rtL82M、rtF166L、rtV173L和rtA200V等诸多变异形式. 为进一步了解YMDD变异阴性的拉米夫定耐药患者体内HBV逆转录酶基因变异情况, 本研究采用PCR产物直接测序方法对此类患者体内HBV RT区基因序列进行了分析. 结果显示: 三位拉米夫定表型耐药患者体内并未发现上述变异, 且较既往GenBank中收录的HBV C型基因序列的变异率无明显差别; 故而可认为部分拉米夫定表型耐药现象的出现可能与HBV RT区基因变异无关, 此类表型耐药的原因尚待进一步研究.
HBV存在准种状态, 随机克隆测序不适于研究抗病毒治疗前后的病毒基因序列变化, 应从准种中的优势种群的变异情况来阐明HBV基因的变化与临床病情间的相互关系. 我们采用PCR产物直接测序方法进行拉米夫定治疗后HBV RT区基因序列变异分析. 该方法所获得的测序结果可代表患者体内某时点的HBV优势株, 故而具备治疗前后的可比性. 为保证测序结果的可靠性, 在PCR及测序实验中均应用了具有3'→5'外切活性的高保真DNA聚合酶, 从而保证了实验结果的可信性.
编辑: 张海宁
| 2. | Gaia S, Marzano A, Smedile A, Barbon V, Abate ML, Olivero A, Lagget M, Paganin S, Fadda M, Niro G. Four years of treatment with lamivudine: clinical and virological evaluations in HBe antigen-negative chronic hepatitis B. Aliment Pharmacol Ther. 2004;20:281-287. [PubMed] |