修回日期: 2005-01-28
接受日期: 2005-02-02
在线出版日期: 2005-04-01
目的: 检测结直肠癌组织中趋化因子和血管内皮生长因子(VEGF)的表达及血管密度, 研究趋化因子IL-8的表达与肿瘤血管形成的关系, 判断其临床应用价值.
方法: 采用RT-PCR方法检测新鲜结直肠癌组织标本中趋化因子IL-8 mRNA的表达; 采用免疫组织化学方法检测结直肠癌组织中趋化因子IL-8蛋白、VEGF的表达及血管密度(CD34).
结果: 12例结直肠癌组织经RT-PCR检测均可出现趋化因子IL-8 mRNA的表达, 40例结直肠癌组织IL-8蛋白表达的阳性率为87.5%, IL-8的表达与结直肠癌肿瘤MVD密切相关, IL-8表达强者, 其肿瘤血管密度高. (阳性组: 37.715±6.710; 阴性组: 32.88±5.8130; t = 2.436; P = 0.02, r = 0.367).12例结直肠癌组织的IL-8 mRNA的表达与其相对应的肿瘤组织MVD密切相关(r = 0.839, P = 0.001).
结论: 结直肠癌组织趋化因子IL-8的表达参与调节肿瘤的血管形成, IL-8增强肿瘤血管的形成.
引文著录: 杨春康, 陈道达, 张惠灏, 许东坡, 田源, 张景辉. 结直肠癌趋化因子IL-8的表达与血管形成的关系. 世界华人消化杂志 2005; 13(7): 899-901
Revised: January 28, 2005
Accepted: February 2, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 899-901
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/899.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.899
血管形成在肿瘤的生长和转移中起着重要的作用, 研究表明[1]血管形成与肿瘤生长转移密切相关. 趋化因子家族[2]因其特殊的结构而具有调节血管形成的作用, 我们将探讨结直肠癌趋化因子IL-8的表达与血管形成的关系及其对结直肠癌肿瘤生物学行为的影响.
40例患者平均年龄56±12岁(35-70), 男27例, 女13例, 直肠癌24例, 结肠癌16例, 其中淋巴结或远处转移者有22例.高分化腺癌19例、中分化腺癌15例、低分化腺癌6例. IL-8 RT-PCR检测试剂及免疫组化抗体, 免疫组化试剂盒均购自福州迈新公司. 抗CD34抗体用于检测血管密度, 购自福州迈新公司, 抗VEGF抗体购自北京中山公司.
术中取新鲜结直肠肠癌组织标本, 共40例, 置-80℃液氮中保存, 待RT-PCR检测及IL-8的免疫组织化学检测, 收集相应的正常组织为对照组.
RT-PCR按常规方法进行检测, PCR反应条件为: 先90℃变性5 min, 后设置95℃变性1 min, 60℃退火及引物延伸2.5 min, 循环35轮. 趋化因子IL-8的引物序列: 5'primer: 5'-ATG ACT TCC AAG CTG GCC GTG GCT-3'; 3'primer: 5'-TCT CAG CCC TCT TCA AAA ACT TCTC-3'; IL-8相对分子质量Mr289.
1.2.1 免疫组织化学检测: 将新鲜保存的40例结直肠癌组织标本及其正常组织行冰冻切片, 切片厚度约6 μm, 置-80℃冰箱中待用. 采用链霉菌抗生物素蛋白-过氧化酶免疫组化染色超敏试剂盒检测IL-8的表达情况. CD34及VEGF的免疫组织化学检测: 将冰冻切片后的结直肠癌组织用40 g/L甲醛固定后, 石蜡包埋并切片, 厚约3 mm. 采用链霉菌抗生物素蛋白-过氧化酶免疫组化方法检测CD34及VEGF的表达情况.
1.2.2 检测结果计数: 将所照的结直肠癌组织RT-PCR结果电泳条带扫描输入计算机系统, 进行条带密度扫描并数字化.
1.2.3 IL-8免疫组化染色结果的判定: 光学显微镜下, 根据染色反应的强度, 按其阳性细胞的数量及染色深度分别记为0-3分, 并根据这两项指标的积分分为四种, 即阴性为0分; 阳性(+)为2分, 阳性(++)为3-4分, 强阳性(+++)为5-6分. 其中阳性细胞数<50%为1分, 50%-80%为2分, >80%为3分, 染色深度以多数细胞的呈色反应为准. 二者都为细胞质着色, 为便于统计按肿瘤细胞着色强度及阳性细胞分布范围分为二个等级; 以10%-30%细胞呈弱、中等强度阳性反应为标准, 分为阴性和阳性.
1.2.4 微血管密度计数: 切片在100倍光镜下挑选微血管分布最高区, 在200倍视野下计数5个视野中被CD34染成棕色的血管数目, 取其平均值作为微血管密度(MVD), 每一与邻近的微血管明显分离的阳性染色的血管内皮细胞或血管内皮细胞簇都视为独立的微血管[3]
统计学处理 统计分析采用SPSS10.0软件. 对MVD的比较用两组独立标本的t检验, 对mRNA与MVD之间的关系用Spearman's检验.
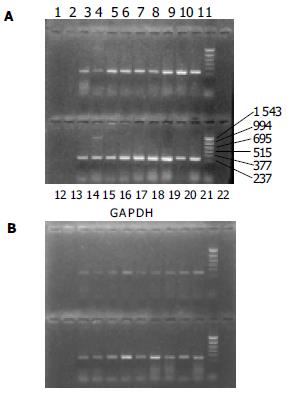
从已收集的40例标本中选18例进行三种趋化因子的RT-PCR反应, 另取想对应的正常结直肠组织4例, 结肠癌肝转移组织1例, 炎性肉芽肿1例作对照.18例标本中均有IL-8 mRNA的表达. 可以看出IL-8 mRNA的相对分子质量与预期的(289)一致(图1).
40例结直肠癌组织中, IL-8表达的阳性率为20%(20/40). 在阳性表达的组织中, 着色部位多数位于肿瘤细胞质中, 部分位于核周, 着色由浅至深分布不均. 在一些浸润的免疫细胞, 血管内皮细胞也出现IL-8蛋白的表达. 结直肠正常黏膜组织IL-8的表达多数集中绒毛表面且多数呈弱阳性表达.
VEGF均为胞质着色, 表达产物多定位于结直肠癌肿瘤细胞胞质内, 部分微血管内皮细胞亦有弱阳性表达, 结直肠正常黏膜仅弱阳性表达, 按前述计数方法, VEGF表达的阳性率为57.5%(23/40).
结直肠癌组织总的血管密度为34.90±5.98/高倍视野, 新生血管多位于肿瘤组织内的间质中或肿瘤组织边缘.
IL-8的表达与结直肠癌肿瘤MVD密切相关, IL-8表达强者, 其肿瘤血管密度高. (t = 2.44, P = 0.02, r = 0.367. 阳性: 37.72±6.71; 阴性: 32.88±5.81)
Spearman's检验表明: 12例结直肠癌组织的IL-8 mRNA的表达与其相对应的肿瘤组织MVD密切相关(r = 0.839, P = 0.001).
结直肠癌组织VEGF表达阳性及阴性的血管密度分别为37.657±6.610/高倍视野、32.106±5.414/高倍视野, 经t检验, VEGF的表达与肿瘤MVD密切相关(t = 4.124, P = 0.00, r = 0.556), 表明VEGF阳性者, 其肿瘤组织血管密度高.
发生转移的结直肠癌其平均MVD为38.241±7.119/高倍视野, 未发生转移的平均MVD为31.700±3.785/高倍视野(t = 3.508, P = 0.001, r = 0.495). 表明结直肠癌MVD的形成与结直肠肠癌的转移密切相关, MVD高者, 其转移发生率增高.
趋化因子IL-8在结直肠癌的肿瘤血管形成中起重要的作用. IL-8的表达与结直肠癌的肿瘤MVD呈正相关, 即IL-8可促进肿瘤血管的形成. IL-8属于趋化因子的CXC家族, 其蛋白分子质量为8 ku, 并且在其结构上具有ELR基序, 即含有一个由谷氨酸-亮氨酸-精氨酸组成的氨基酸序列, 决定了IL-8具有调节血管形成的作用, 即IL-8能够趋化血管内皮细胞, 有促进血管形成的作用. 而像IP-10, PF4等CXC趋化因子因不含有ELR这个基序, 则有抑制血管形成的作用[2]. 因此, 正是CXC趋化因子这种结构上的不同, 才使具有调节血管形成的作用. 当这些趋化因子在局部表达失衡时, 其在各种病理(包括肿瘤)或生理状态下则起重要的作用. 如在卵巢肿瘤[4]、前列腺癌[5]、胃癌[6]等肿瘤的研究中均发现肿瘤组织的血管形成与IL-8表达的升高有关. 而在肺癌的另一项研究中则发现IP-10能抑制肿瘤血管生成从而抑制肺癌的生长与转移[7].
VEGF是一种34-42 ku的蛋白, 能增加微血管的通透性, 刺激内皮细胞分裂, 增加组织因子和某些蛋白酶的产生, 他刺激血浆蛋白如纤维蛋白的渗出, 并在细胞外基质沉积, 成为肿瘤基质和新生的毛细血管网络基础[8], 是某些实体瘤的重要血管生成因子. 本研究显示结直肠癌组织能表达VEGF, 且VEGF的表达与肿瘤MVD密切相关(t = 4.124, P = 0.00), 表明VEGF的表达能促进结直肠癌的血管形成, 从而促进了结直肠癌的生长、转移. 在黑色素瘤[9]、头颈部磷癌[10]等的研究中也得出同样的结论.
虽然IL-8与VEGF同为血管调节因子, 对结直肠癌的血管形成均起作用, 但他们的调节机制并不一定相同. IL-8除了调节血管形成之外, 他还具有免疫调节作用, 能够影响肿瘤的微环境. 在卵巢肿瘤的研究中, 人们发现IL-8对血管的调节作用比VEGF更大[4], 总之, 调节血管形成的因子众多, 各个因子在其中的具体作用仍需进一步研究.
血管形成在肿瘤生长转移中起重要的作用, 因此抗血管形成就成为抗肿瘤治疗中的一个重要环节. 而趋化因子IL-8的这种与肿瘤血管形成的关系就有可能成为抗肿瘤治疗的靶点之一, 具有重要的临床意义.
编辑: 张海宁
| 1. | Garcea G, Lloyd TD, Gescher A, Dennison AR, Steward WP, Berry DP. Angiogenesis of gastrointestinal tumours and their metastases--a target for intervention? Eur J Cancer. 2004;40:1302-1313. [PubMed] |
| 2. | Belperio JA, Keane MP, Arenberg DA, Addison CL, Ehlert JE, Burdick MD, Strieter RM. CXC chemokines in angiogenesis. J Leukoc Biol. 2000;68:1-8. [PubMed] |
| 3. | Vermeulen PB, Gasparini G, Fox SB, Colpaert C, Marson LP, Gion M, Belien JA, de Waal RM, Van Marck E, Magnani E. Second international consensus on the methodology and criteria of evaluation of angiogenesis quantification in solid human tumours. Eur J Cancer. 2002;38:1564-1579. [PubMed] |
| 4. | Kassim SK, El-Salahy EM, Fayed ST, Helal SA, Helal T, Azzam Eel-D, Khalifa A. Vascular endothelial growth factor and interleukin-8 are associated with poor prognosis in epithelial ovarian cancer patients. Clin Biochem. 2004;37:363-369. [PubMed] |
| 5. | Kim SJ, Uehara H, Karashima T, Mccarty M, Shih N, Fidler IJ. Expression of interleukin-8 correlates with angiogenesis, tumorigenicity, and metastasis of human prostate cancer cells implanted orthotopically in nude mice. Neoplasia. 2001;3:33-42. [PubMed] |
| 6. | Kitadai Y, Takahashi Y, Haruma K, Naka K, Sumii K, Yokozaki H, Yasui W, Mukaida N, Ohmoto Y, Kajiyama G. Transfection of interleukin-8 increases angiogenesis and tumorigenesis of human gastric carcinoma cells in nude mice. Br J Cancer. 1999;81:647-653. [PubMed] |
| 7. | Arenberg DA, White ES, Burdick MD, Strom SR, Strieter RM. Improved survival in tumor-bearing SCID mice treated with interferon-gamma-inducible protein 10 (IP-10/CXCL10). Cancer Immunol Immunother. 2001;50:533-538. [PubMed] |
| 8. | Scavelli C, Vacca A, Di Pietro G, Dammacco F, Ribatti D. Crosstalk between angiogenesis and lymphangiogenesis in tumor progression. Leukemia. 2004;18:1054-1058. [PubMed] |
| 9. | Rofstad EK, Halsor EF. Vascular endothelial growth factor, interleukin 8, platelet-derived endothelial cell growth factor, and basic fibroblast growth factor promote angiogenesis and metastasis in human melanoma xenografts. Cancer Res. 2000;60:4932-4938. [PubMed] |
| 10. | Eisma RJ, Spiro JD, Kreutzer DL. Role of angiogenic factors: coexpression of interleukin-8 and vascular endothelial growth factor in patients with head and neck squamous carcinoma. Laryngoscope. 1999;109:687-693. [PubMed] |