修回日期: 2005-02-28
接受日期: 2005-03-03
在线出版日期: 2005-04-01
目的: 研究半乳糖基化壳聚糖(Galactosylated chitosan, GC)在狗体内的肝靶向性作用.
方法: GC与质粒pEGFP-N1混和制备成纳米微囊复合物, 体外转染SMMC-7721细胞. 杂种狗术前1 d静脉注射氯化钆(14 mg/kg)以清除Kupffer细胞. 将含1 mg质粒的纳米微囊经肝动脉和门静脉注射入动物体内.48 h后取主要脏器组织做冰冻切片, 在荧光显微镜下观察绿荧光蛋白表达情况. 以裸质粒作为对照.
结果: 7721细胞中有绿荧光蛋白的表达, 体内实验GC组肝组织中有绿荧光蛋白表达, 其他脏器组织中仅有微量表达.
结论: 半乳糖基化壳聚糖在体外有较高的转染率, 在大动物体内有肝靶向性作用, 肝动脉、门静脉联合给药是基因治疗的一种有效途径.
引文著录: 李剑平, 窦科峰, 陈勇, 鱼军, 杨雁灵, 赵青川, 乔庆, 毛海泉. 半乳糖基化壳聚糖肝靶向性基因转导的体内实验. 世界华人消化杂志 2005; 13(7): 848-851
Revised: February 28, 2005
Accepted: March 3, 2005
Published online: April 1, 2005
AIM: To investigate the hepatocyte-targeting effect of galactosylated chitosan (GC) in vivo.
METHODS: GC was complexed with plasmid pEGFP-N1 to develop nanoparticles, which were then transfected into SMMC-7721 cells. Dogs were treated with gadolinium chloride (14 mg/kg) via intravenous injection 24 hours before operation to deplete Kupffer cells. The nanoparticles containing 1 mg plasmid were injected through hepatic artery and portal vein. Main organs were collected and used to prepare frozen sections. Green fluorescence was examined under the fluorescence microscope after 48 hours. Naked plasmid DNA was used as control.
RESULTS: Green fluorescent protein was detected in SMMC-7721 cells transfected with pEGFP-N1 plasmid. The transfection efficiency was higher in GC group (60.4%±2.2%), than the liposome group (55.6±1.6%) (P = 0.04). In vivo experiments showed that in the GC group, bright green fluorescence existed in the hepatic tissue, while only weak fluorescence was observed in other tissues.
CONCLUSION: GC nanoparticle can be efficiently transfected in vitro. It is hepatocyte-specific in large animals. The administration via hepatic artery and portal vein is an effective approach for gene transfer.
- Citation: Li JP, Dou KF, Chen Y, Yu J, Yang YL, Zhao QC, Qiao Q, Mao HQ. Hepatocyte-tageted gene transfer of galactosylated chitosan in vivo. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 848-851
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/848.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.848
壳聚糖(Chitosan)是甲壳类动物的提取物经脱乙酰基化反应后得到的一种高分子多聚糖, 能溶于水, 目前主要从海洋生物蟹和虾的壳中提取. 壳聚糖具有生物可降解性和生物相容性[1], 无毒、无免疫原性, 能与质粒DNA有效地结合成纳米微囊, 并使其免受DNase的降解[2], 对质粒DNA具有一定程度的保护作用. 壳聚糖纳米微囊作为基因传递载体的应用前景正广泛受到人们的关注[3]. 我们选用半乳糖基化壳聚糖, 即在壳聚糖分子结构上修饰以半乳糖配体[9], 制备GC-质粒纳米微囊, 将含报告基因的质粒pEGFP-N1注入动物体内, 研究GC在体内的肝靶向性.
半乳糖基化壳聚糖, 由约翰霍普金斯大学毛海泉教授惠赠. 质粒pEGFP-N1购于Clonetech公司. 大肠杆菌DH5α, SMMC-7721细胞株为本实验室保存. 华舜质粒小量提取试剂盒、卡那霉素、琼脂糖购于上海生工公司. DNA Marker为MBI公司产品. 限制性内切酶购于TaKaRa公司. 质粒大量提取试剂盒(Qiagen Endo-Free Giga Kits)为Qiagen公司产品. 乙酸钠和硫酸钠为分析纯. 细胞培养基RPMI1640, Lipofec-tamineTM 2000脂质体转染试剂购于Gibco. 荧光显微镜为Olympus产品, 冰冻切片机为Leica产品. 杂种狗6只, 第四军医大学实验动物中心提供.
将质粒pEGFP-N1转化感受态大肠杆菌DH5α, 均匀涂于卡那霉素抗性的平板. 挑选阳性菌落, 接种于含50 mg/L卡那霉素的LB培养液中, 小量提取质粒. 用Hand Ⅲ和BamHⅠ进行双酶切反应, 反应体系20 μL, 取酶切产物10 μL用20 g/L琼脂糖凝胶电泳分析. 酶切验证无误后, 将含质粒的菌液接种于含50 mg/L卡那霉素的LB培养液2.5 L中, 按试剂盒说明书的步骤大量提取并纯化质粒. 将GC溶液(0.2 g/L, 含25 mmol/L NaAC, pH5.7)和质粒DNA溶液(1 g/L, 含50 mmol/LNa2SO4)按N/P比1: 1混合[4], 迅速在旋涡混合器上混合30 s, 置于室温下30 min, 即得GC-质粒纳米微囊. 置于4℃保存.
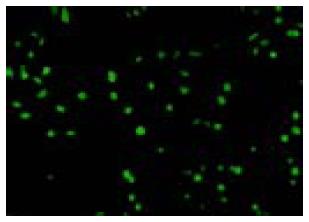
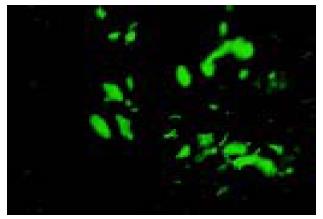
1.2.1 体外转染SMMC-7721肝癌细胞: 用2.5 g/L胰酶消化SMMC-7721细胞, 加1-2滴至12孔板中的盖玻片上, 37℃孵箱放置1 h, 使细胞贴壁, 制成细胞爬片, 加入培养液1.0 mL. 待细胞达80%汇合率时进行转染.24 h后用GC-质粒纳米微囊转染, 以脂质体包裹pEGFP-N1为阳性对照. 转染后48 h取出, 用PBS洗2遍, 40 g/L多聚甲醛[5]固定10 min, PBS洗2遍; 加数滴细胞核染色剂DAPI(diamidino-phenyl-indole, 二脒基苯基吲哚)液染色5 min[6], 洗片; 滴甘油: PBS 1滴在载玻片中央, 小心取出盖玻片, 细胞面朝下轻轻放在载玻片液滴上, 置于荧光显微镜下观察绿荧光蛋白的表达. 在同一视野下, 分别计数绿荧光蛋白表达的细胞数和DAPI染色的细胞数, 计算转染率.
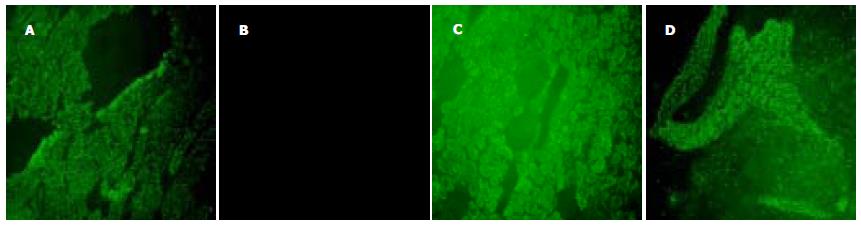
1.2.2 GC-质粒纳米微囊体内注射: 将6只狗随机分为2组, 实验组注射GC-质粒纳米微囊, 对照组仅注射裸质粒. 实验前1 d静脉注射氯化钆(14 mg/kg), 清除Kupffer细胞[7]. 无菌手术下开腹, 解剖肝动脉、门静脉, 按肝动脉与门静脉的血流量比(1: 10)[8]注射纳米微囊或裸质粒, 每个试验动物接受的质粒注射总量为1 mg.7-0无损伤缝线缝合注射部位出血点. 关腹. 术后注射先锋霉素V抗感染.48 h后处死动物, 取肝、心、脾、肺、肾组织, 作冰冻切片. 置于荧光显微镜下, 观察绿荧光蛋白的表达情况.
统计学处理 数据处理用SPSS 11.5统计软件, GC组和脂质体组体外转染率的比较用两样本均数比较的t检验(将转染率作为计量资料).
荧光显微镜观察显示, 转染48 h后, 细胞中可观察到绿色荧光点, 表明报告基因EGFP已经被纳米微囊递送到细胞内, 并开始表达产生绿色荧光蛋白(图1). 按有绿荧光蛋白表达的细胞数占该视野下细胞总数(DAPI染色的细胞数)的比例计算的转染率, GC组为60.4%±2.2%, 高于阳性对照脂质体组的55.6%±1.6%, (P = 0.04).
靶向性转基因技术[9]对于基因治疗十分重要. 肝脏是人体重要的代谢器官, 与人类许多遗传性、代谢性、感染性疾病及肿瘤密切相关. 因此, 以肝脏为直接靶器官或作为生物效应靶器官的基因治疗倍受关注[10], 一直是临床基因治疗研究领域的热点之一. 基因治疗以前常用病毒载体, 病毒载体虽然转染效率高, 但是安全性差, 1999年美国宾夕法尼亚大学以重组腺病毒为载体的基因治疗药物临床试验造成了受试者死亡的悲剧[11]. 近年来, 越来越多的研究证据表明, 病毒载体可引起严重的免疫反应[12], 因此病毒载体的应用受到了限制. 传统的非病毒载体也各有局限性[13]: 裸DNA直接注射法转移效率可达100%, 准确快速.但设备昂贵, 不适合大量细胞的转染; DNA-磷酸钙共沉淀法转染效率低[14]; 脂质体表达时间短, 组织特异性差. 根据肝脏的生理特性, 半乳糖受体介导的药物载体交联物成为肝靶向的研究的热点[15-16]. 在哺乳动物肝细胞向朝肝窦一侧的细胞膜上有一种受体, 称为去唾液酸糖蛋白受体(ASGR). 他是一种专一性识别末端含有半乳糖或乙酰氨基半乳糖的糖蛋白. 每个细胞含有约20万个 ASGR的结合点[17-18]. Braun et al[19]通过模型比较了几种肝靶向的途径, 认为经ASGR介导途径最好, 该系统对肝有较高的亲和性, 且肝吸收迅速. GC是基于ASGR的一种基因递送载体, 因其具有生物相容性, 能与质粒DNA 形成纳米微囊复合物, 并对质粒DNA有一定的保护作用, 是一种比较理想的肝靶向性载体.
壳聚糖分子在酸性条件下带正电荷, DNA分子带负电荷, 因此壳聚糖与DNA可形成纳米微囊. 在壳聚糖与DNA的静电作用和硫酸钠对壳聚糖的盐析作用下, 壳聚糖分子与DNA分子复合压缩并包裹缠绕, 形成颗粒, 最终形成纳米微囊胶体液. 纳米微囊的直径在100 nm以下, 保证了细胞对粒子的内吞过程正常进行, 从而使转染成功[20]. 绿荧光蛋白是从腔肠动物多管水母属Aequoren victuria分离出的一种蛋白, 可在多种异源细胞中表达[21], 其表达产物在紫外光的激发下能产生强烈的绿色荧光, 可以在荧光显微镜下观察到[22], 不需添加任何底物, 不需染色, 他的表达也不影响细胞的生长和功能, 因此绿荧光蛋白在研究中常用于考察基因递送载体的性能[23]. p EGFP-N1 质粒有真核细胞强启动子(immediate early promoter of human CMV, CMV IE), 所带EGFP作为基因标签可在多种系组织细胞中高效表达, 荧光强度与基因拷贝数及蛋白表达水平直接相关. 本实验体外转染的目的是验证GC纳米微囊的转染能力, 为体内实验提供依据. 结果提示GC纳米微囊在体外转染有较高的效率, 略高于阳离子脂质体.
肝动脉和门静脉是肝脏的双重血液供应, 注射纳米微囊后, 可随血液分布到肝脏各部分. 临床上肝动脉和门静脉的注射可通过B超引导下穿刺或介入来实现, 有一定的可行性. 本实验仅在GC组肝组织内检测到阳性荧光, 且裸质粒组均未见荧光, 说明GC在大动物体内具有肝靶向性. 如果用适当的功能基因替换报告基因, 预期相应的基因也可以表达, 并可能达到一定的治疗效果. 本实验仅对GC做了初步研究, 对于体外及体内的长期表达及临床应用还需要进一步研究.
编辑: 张海宁 电编: 潘伯荣
| 1. | Muzzarelli C, Muzzarelli RA. Natural and artificial chitosan-inorganic composites. J Inorg Biochem. 2002;92:89-94. [PubMed] |
| 2. | MacLaughlin FC, Mumper RJ, Wang J, Tagliaferri JM, Gill I, Hinchcliffe M, Rolland AP. Chitosan and depolymerized chitosan oligomers as condensing carriers for in vivo plasmid delivery. J Control Release. 1998;56:259-272. [PubMed] |
| 3. | Cui Z, Mumper RJ. Chitosan-based nanoparticles for topical genetic immunization. J Control Release. 2001;75:409-419. [PubMed] |
| 4. | Kim TH, Park IK, Nah JW, Choi YJ, Cho CS. Galactosylated chitosan/DNA nanoparticles prepared using water-soluble chitosan as a gene carrier. Biomaterials. 2004;25:3783-3792. [PubMed] |
| 5. | Luby-Phelps K, Ning G, Fogerty J, Besharse JC. Visualization of identified GFP-expressing cells by light and electron microscopy. J Histochem Cytochem. 2003;51:271-274. [PubMed] |
| 6. | Cunha S, Odijk T, Suleymanoglu E, Woldringh CL. Isolation of the Escherichia coli nucleoid. Biochimie. 2001;83:149-154. [PubMed] |
| 7. | Lee CM, Yeoh GC, Olynyk JK. Differential effects of gadolinium chloride on Kupffer cells in vivo and in vitro. Int J Biochem Cell Biol. 2004;36:481-488. [PubMed] |
| 8. | Azoulay D, Eshkenazy R, Andreani P, Castaing D, Adam R, Ichai P, Naili S, Vinet E, Saliba F, Lemoine A. In situ hypothermic perfusion of the liver versus standard total vascular exclusion for complex liver resection. Ann Surg. 2005;241:277-285. [PubMed] |
| 9. | Golzio M, Rols MP, Gabriel B, Teissie J. Optical imaging of in vivo gene expression: a critical assessment of the methodology and associated technologies. Gene Ther. 2004;11:S85-91. [PubMed] |
| 10. | Wu J, Nantz MH, Zern MA. Targeting hepatocytes for drug and gene delivery: emerging novel approaches and applications. Front Biosci. 2002;7:d717-725. [PubMed] |
| 11. | Jenks S. Gene therapy death-"everyone has to share in the guilt". J Natl Cancer Inst. 2000;92:98-100. [PubMed] |
| 12. | Cavazzana-Calvo M, Lagresle C, Hacein-Bey-Abina S, Fischer A. Gene therapy for severe combined immunodeficiency. Annu Rev Med. 2005;56:585-602. [PubMed] |
| 13. | Luo D, Woodrow-Mumford K, Belcheva N, Saltzman WM. Controlled DNA delivery systems. Pharm Res. 1999;16:1300-1308. [PubMed] |
| 14. | Rochlitz CF. Gene therapy of cancer. Drugs Today(Barc). 2000;36:619-629. [PubMed] |
| 15. | Wen SY, Wang XH, Lin L, Guan W, Wang SQ. Preparation and property analysis of a hepatocyte targeting pH-sensitive liposome. World J Gastroenterol. 2004;10:244-249. [PubMed] |
| 16. | Yin C, Ying L, Zhang PC, Zhuo RX, Kang ET, Leong KW, Mao HQ. High density of immobilized galactose ligand enhances hepatocyte attachment and function. J Biomed Mater Res A. 2003;67:1093-1104. [PubMed] |
| 17. | Yang DY, Lu FG, Tang XX, Zhao SP, Ouyang CH, Wu XP, Liu XW, Wu XY. Study on relationship between expression level and molecular conformations of gene drugs targeting to hepatoma cells in vitro. World J Gastroenterol. 2003;9:1954-1958. [PubMed] |
| 18. | Fallon RJ, Danaher M, Saxena A. The asialoglycoprotein receptor is associated with a tyrosine kinase in HepG2 cells. J Biol Chem. 1994;269:26626-26629. [PubMed] |
| 19. | Braun JR, Willnow TE, Ishibashi S, Ashwell G, Herz J. The major subunit of the asialoglycoprotein receptor is expressed on the hepatocellular surface in mice lacking the minor receptor subunit. J Biol Chem. 1996;271:21160-21166. [PubMed] |
| 20. | Brannon-Peppas L, Blanchette JO. Nanoparticle and targeted systems for cancer therapy. Adv Drug Deliv Rev. 2004;56:1649-1659. [PubMed] |
| 21. | Chalfie M, Tu Y, Euskirchen G, Ward WW, Prasher DC. Green fluorescent protein as a marker for gene expression. Science. 1994;263:802-805. [PubMed] |
| 22. | Paris S, Sesboue R. Metastasis models: the green fluorescent revolution. Carcinogenesis. 2004;25:2285-2292. [PubMed] |
| 23. | Cheng L, Fu J, Tsukamoto A, Hawley RG. Use of green fluorescent protein variants to monitor gene transfer and expression in mammalian cells. Nat Biotechnol. 1996;14:606-609. [PubMed] |