修回日期: 2005-01-16
接受日期: 2005-01-20
在线出版日期: 2005-03-15
目的: 探讨肝细胞癌(HCC)合并的肝动脉门静脉分流(HAPVS)、肝动脉肝静脉分流(HAHVS)的多层CT(MSCT)表现, 并评价在介入栓塞治疗中的意义.
方法: 分析经数字减影血管造影证实的86例HCC合并HAPVS和/或HAHVS的MSCT表现, 包括门静脉、肝静脉、肠系膜上静脉、脾静脉、HCC病灶、肝实质及脾脏的增强表现.
结果: 在83例HAPVS中48例门静脉主干和/或1级分支增强早于肠系膜上或脾静脉; 27例门静脉主干和/或1级分支显影密度大于肠系膜上或脾静脉; 5例门静脉2级及以下分支增强早于门静脉主干, 4例门静脉2级及以下分支显影密度大于门静脉主干, HCC病灶周围短暂片状或楔形强化. 3例HAPVS HCC病灶内粗大迂曲引流静脉汇集至左肝静脉, 左肝静脉提早增强浓密显影. 77例重中度分流者肝实质强化程度增加, 脾脏强化程度降低. HCC病灶强化程度均降低. 49例门静脉主干和/或1级分支癌栓形成, 1例左肝静脉和下腔静脉上端有癌栓.
结论: HCC合并的HAPVS主要MSCT表现为门静脉提早增强和/或浓密显影; HAHVS主要为HCC病灶内粗大迂曲引流静脉汇集至肝静脉, 肝静脉提早增强浓密显影. 认识这些表现对于介入栓塞具有重要指导意义, 提高治疗的安全性、有效性.
引文著录: 罗明月, 林云崖, 胡冰, 张建生, 李露芳, 黄惠卿. 肝细胞癌两种类型动静脉分流的多层CT表现在介入栓塞中的意义. 世界华人消化杂志 2005; 13(6): 755-759
Revised: January 16, 2005
Accepted: January 20, 2005
Published online: March 15, 2005
AIM: To investigate the multislice CT (MSCT) appearances of hepatic artery-portal venous shunt (HAPVS) and hepatic artery-hepatic venous shunt (HAHVS) accompanied with hepatocelluar carcinoma (HCC), and to evaluate their clinical significance in interventional embolism.
METHODS: Thin-slice and dynamic enhancement MSCT was performed on 86 patients with arteriovenous shunts complicated with HCC, which were confirmed by digital subtract angiography. The appearances of the portal vein, hepatic vein, superior mesenteric vein, splenic vein, HCC foci, liver parenchyma, spleen, and thrombosis in portal vein, hepatic veins and inferior vena cava were retrospectively analyzed.
RESULTS: In 83 HAPVS, MSCT revealed earlier enhancement of the main portal trunks and/or the first order branches than that of superior mesenteric veins or splenic veins (n = 48), stronger opacification of main portal trunks and/or the first order branches than that of superior mesenteric veins or splenic veins (n = 27), earlier enhancement of the second order and smaller branches of portal veins than that of main portal trunks (n = 5), stronger opacification of the second order and smaller branches of portal veins than that of main portal trunks (n = 4), with transient patchy (n = 4) or wedge-shaped (n = 5) enhancement peripheral to HCC foci in late hepatic arterial phase. As for 3 HAPVS, thick and tortuous drainage veins within HCC foci were converged into left hepatic veins, which had earlier enhancement and stronger opacification. Enhancement degree of the liver parenchyma was increased, whereas the spleen was decreased in 77 patients with severe or moderate shunts. Enhancement degree of HCC foci was all decreased. There were thromboses in main portal trunks and/or the first order branches (n = 49), and in left hepatic vein and upper part of inferior vena cava (n = 1).
CONCLUSION: The main MSCT appearance of HAPVS accompanied with HCC is earlier enhancement and/or stronger opacification of portal veins. HAHVS is primarily displayed as thick and tortuous drainage veins within HCC foci being converged into hepatic veins, which have earlier enhancement and stronger opacification. Understanding of these appearances can provide important guidance for interventional embolism of the disease, which will improve the safety and effect of treatment.
- Citation: Luo MY, Lin YY, Hu B, Zhang JS, Li LF, Huang HQ. Clinical significance in interventional embolism of multislice CT appearances of two types of hepatic arteriovenous shunts accompanied with hepatocelluar carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 755-759
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/755.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.755
肝细胞癌(hepatocelluar carcinoma, HCC)容易侵犯肝脏的静脉系统而形成动静脉分流(arteriovenous shunt, AVS), 包括肝动脉门静脉分流(hepatic artery-portal venous shunt, HAPVS)、肝动脉肝静脉分流(hepatic artery-hepatic venous shunt, HAHVS)2种类型. AVS常导致和/或加重门静脉高压, 引起顽固性腹水、腹泄、食管胃底静脉曲张破裂出血和肝性脑病, 加速HCC的肝内播散和肝外转移, 治疗具有一定的难度和危险[1-2]. HCC合并的HAPVS、HAHVS的治疗方式不同于单纯的化疗栓塞, 如果处理不当不但不能完成对肿瘤的超选择性栓塞, 反而会引起肺栓塞等严重后果. 认识HAPVS、HAHVS 的CT表现对于其治疗将具有重要的临床意义. 新近推出的多层CT(multislice CT, MSCT)提高了扫描速度和图像质量, 有利于HCC合并的HAPVS, HAHVS的诊断[3-4]. 我们将探讨HCC合并的HAPVS, HAHVS的MSCT表现, 并评价其在介入栓塞治疗中的意义.
HCC合并AVS 86例, 男75例, 女11例, 年龄28-76(平均45.6)岁. 活检病理证实8例, 根据特征性影像学表现和血清AFP水平作出诊断78例, 均符合全国抗癌协会制订的HCC诊断标准.
MSCT检查使用GE公司LightSpeed QX/i MSCT机平扫后进行肝动脉早期、肝动脉晚期和门静脉期薄层增强扫描, 延迟时间分别为15, 25和65 s. 对比剂Iopromide 300 g/L或 Iopamiro 300 g/L, 剂量1.5 mL/kg, 注射速度3.5 mL/s, 由肘前静脉经高压注射器快速团注. MSCT检查后2 wk以内使用Toshiba公司1000 MAX DSA机进行DSA检查. 采用Seldinger技术经皮右股动脉穿刺后行腹腔动脉干(9例)或肝固有动脉(77例)造影. 对比剂Iopromide 300 g/L或Iopamiro 300 g/L, 总量40 mL, 注射速度5.0 mL/s. 分别摄取肝动脉期、实质期图像. 由2位在腹部影像诊断方面有丰富经验的影像科医生在不知道DSA检查结果的情况下独立进行图像分析, 二者意见不一致时互相讨论, 以得出的一致性结果为准, 包括门静脉主干和/或1级分支与肠系膜上静脉、脾静脉增强时间、显影密度的差别, 门静脉2级及以下分支与门静脉主干增强时间、显影密度的差别, 肝静脉的增强时间、显影密度; AVS的分流类型及程度; 肝实质、脾脏的增强表现; HCC的部位、大体病理类型和增强表现; 有无门静脉、肝静脉、下腔静脉癌栓形成.
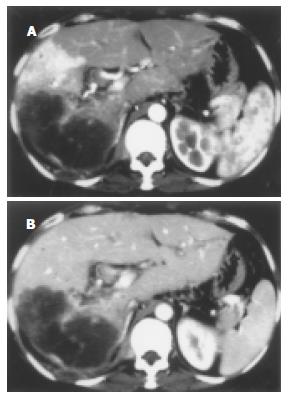
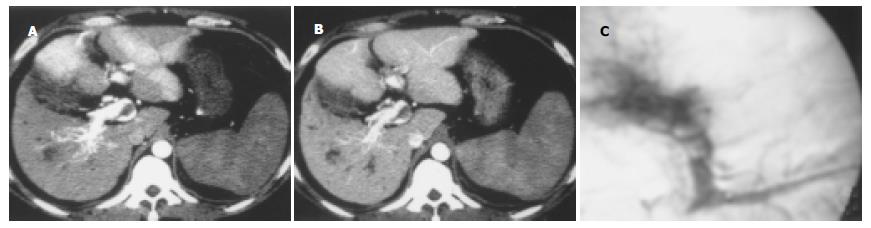
根据出现时间的差异, HAPVS表现为三种分流程度. 轻度分流9例, 肝动脉晚期, 门静脉2级及以下分支显影, HCC病灶周围4例短暂片状强化、5例短暂楔形强化, 门静脉期变为等密度(图1). 中度分流10例, 肝动脉晚期, HCC处于增强中后期, 门静脉主干和/或1级分支显影. 重度分流65例, 肝动脉早期, HCC未增强或处于增强早期, 门静脉主干和/或1级分支显影(表1). 按分流部位的不同, 有3种类型的表现.9例为周围型, HAPVS位于周围肝实质, 其中5例门静脉2级及以下分支增强早于门静脉主干, 4例门静脉2级及以下分支显影密度大于门静脉主干.72例为中央型, HAPVS位于肝门部, 其中45例门静脉主干和/或1级分支增强早于肠系膜上静脉或脾静脉, 27例门静脉主干和/或1级分支显影密度大于肠系膜上静脉或脾静脉.3例为混合型, 既有门静脉2级及以下分支增强早于门静脉主干、肝动脉晚期HCC病灶周围短暂片状强化, 又有门静脉主干提早增强、浓密显影(图2).
| MSCT表现 | 流类类型 | 分流程度 | ||||
| 中央型 | 周围型 | 混合型 | 重度 | 中度 | 轻度 | |
| 门静脉主干和/或1级分支增强早于肠系膜上或脾静脉 | 45 | 0 | 31 | 48 | 0 | 0 |
| 门静脉主干和/或1级分支显影密度大于肠系膜上或脾静脉 | 27 | 0 | 0 | 17 | 10 | 0 |
| 门静脉2级及以下分支增强早于门静脉主干 | 0 | 5 | 0 | 0 | 0 | 5 |
| 门静脉2级及以下分支显影密度大于门静脉主干 | 0 | 4 | 0 | 0 | 0 | 4 |
| 肝静脉提早增强、浓密显影, 密度接近增强的腹主动脉 | 32 | 0 | 0 | 32 | 0 | 0 |
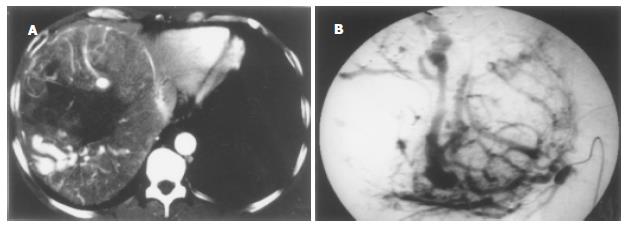
肝动脉早期, HCC未增强或处于增强早期, HCC病灶内有粗大迂曲的引流静脉汇集至左肝静脉, 使左肝静脉提早增强、浓密显影, 密度接近增强的腹主动脉, 属于重度分流、中央型AVS, 共3例(图3). 其中1例同时有门静脉主干和1级分支显影早于肠系膜上静脉, 即HAHVS合并HAPVS(表1).
HCC合并AVS既有复杂的解剖基础, 又有多种病理因素. 解剖上肝动脉和门静脉各自分支汇入肝窦, 经肝窦进入中央静脉, 再经肝静脉进入体循环, 因此肝动脉和门静脉、肝静脉之间有丰富的吻合支. 在病理因素的作用下这些吻合支开放而形成AVS[5-7]. HCC压迫侵犯周围的肝静脉分支, 使肝静脉回流受阻, 肝窦压力增高. 当肝窦压力超过门静脉压力时所属门静脉就成为引流静脉, 直接接受肝动脉供血, 形成肝窦性HAPVS. 门静脉成为引流静脉时该区域功能性门静脉血流减少, 肝动脉血流代偿性增多, 加剧肝窦性HAPVS的形成. 肿瘤血管缺乏肌层, 通过血管壁收缩功能调节血流量的能力较差, HCC周围正常肝动脉分支就会先获取因肝静脉回流受阻而代偿性增多的肝动脉血流, 使肝窦性HAPVS进一步加剧. 肝窦性HAPVS在MSCT上表现为轻度分流, 肝动脉晚期门静脉2级及以下分支增强早于门静脉主干(本组5例), 或门静脉2级及以下分支显影密度大于门静脉主干(本组4例), HCC病灶周围短暂片状或楔形强化. 本组周围型9例, 混合型3例有这种改变.
HCC压迫门静脉1级分支或门静脉1级分支癌栓形成, 使门静脉血流障碍, 位于肝脏中央部分较大胆管周围的血管丛代偿性增生, 作为顺肝方向的侧支循环而开放, 形成血管丛性AVS. MSCT上表现为中度分流, 肝动脉晚期门静脉主干和/或1级分支显影密度大于肠系膜上静脉或脾静脉. 本组10例表现为这种类型. 邻近肝门的HCC直接侵犯破坏门静脉或肝静脉, 在静脉内形成癌栓或沿静脉壁生长, 癌栓被静脉壁周围的肝动脉分支滋养血管网血管化并不断生长, 增粗扩张的肝动脉分支成为主要的供血动脉, 血流直接引流到门静脉或肝静脉, 门静脉或肝静脉作为癌栓的输出静脉, 形成血管性AVS. 这是HCC合并AVS的主要形成机制. 这种血管性AVS分流量大, 属重度分流, MSCT上表现为肝动脉早期门静脉主干和/或1级分支显影, 早于肠系膜上静脉或脾静脉(本组48例), 或门静脉主干和/或1级分支显影密度大于肠系膜上静脉或脾静脉(本组17例), 或肝静脉提早增强、浓密显影, 密度接近增强的腹主动脉(本组3例); 肝脏、脾脏因AVS的"窃血"而处于缺血状态, HCC因此不强化或强化不明显, 脾脏强化程度降低(本组68例).86例AVS中63例病灶邻近第一肝门, 3例病灶邻近第二肝门, 门静脉主干和/或1级分支、或肝静脉明显受侵犯, 在第一或第二肝门附近可见迂曲扩张不规则排列的网状动脉, DSA证实为AVS的供血动脉, 即上述增粗扩张的肝动脉分支滋养血管网.
经导管肝动脉造影(包括DSA)一直是诊断HCC合并AVS的金标准, 可显示AVS的分流部位、类型和程度, 但本法有诸多缺点. (1)需用Seldinger技术经股动脉将导管置于腹腔动脉干或肝固有动脉行腹腔动脉或选择性肝动脉造影, 为创伤性检查, 有一定的痛苦, 可能产生并发症; (2)肝动脉解剖变异较多, 检查不一定成功; (3)第2或第3肝段的病灶可因肝动脉显影不满意而漏诊; (4)轻度分流周围型AVS, 特别是巨块型HCC合并的轻度分流周围型AVS, 可能因分流量小而漏诊; (5)可能会受设备条件、检查技术和费用的限制. 因此临床工作中相当一部分患者不可能接受经导管肝动脉造影检查而致AVS漏诊, 丧失治疗机会[8-9]. MSCT是影像医学检查技术的新突破, 能同时进行多层面图像数据采集, 大大减少了容积扫描时间. 此外图像分辨率和清晰度增加, 改进了图像质量. 因而能完成肝动脉早期、肝动脉晚期和门静脉期薄层动态增强扫描, 充分反映肝脏和上腹部其他脏器的血供特征及AVS的血流动力学变化, 为HCC合并AVS提供便捷无创伤的新检查技术.
认识HCC两种类型AVS的MSCT表现并评估分流程度, 对于其介入栓塞治疗具有重要的指导意义, 有助于提高患者的生活质量、延长生存期. 分流量大的重度、中度AVS临床上表现为反复上消化道出血、大量腹水、顽固性腹泄、消化不良、肝功能差, 应及时进行栓塞以降低门静脉高压、缓解临床症状, 使患者度过危险期. 如果此时贸然进行碘油栓塞, 栓塞剂主要流至正常肝组织的门静脉内, 不仅不能栓塞病灶反而会加重肝损害[10-13]. 本组86例患者在MSCT提供的影像学信息指导下, 选用4.0 F或3.0 F导管行超选择性肝动脉插管, 77例重度、中度分流应用无水乙醇及弹簧钢圈联合栓塞, 9例轻度分流应用无水乙醇栓塞, 均达到了AVS的安全栓塞, 栓塞效果良好, 食管胃底静脉曲张出血、顽固性腹水及腹泻等均得到了及时控制, 多次MSCT复查未发现复发、再通, 提高了介入栓塞治疗的安全性、有效性.
总之, HCC合并的HAPVS主要表现为门静脉提早增强和/或浓密显影; HAHVS主要为HCC病灶内粗大迂曲引流静脉汇集至肝静脉, 肝静脉提早增强、浓密显影. 认识这些表现对于介入栓塞具有重要的指导意义, 提高治疗的安全性、有效性.
编辑: 张海宁 电编: 潘伯荣
| 1. | Tang ZY. Hepatocellular carcinoma梒ause, treatment and metastasis. World J Gastroenterol. 2001;7:445-454. [PubMed] |
| 2. | Guo WP, Zhang HX, Wang ZM, Wang YQ, Ni DH, Li WX, Guan Y. DSA analysis of hepatic arteriovenous fistula concurrent with hepatic cancer and its clinical significance. World J Gastroenterol. 2000;6:872-876. [PubMed] |
| 3. | Takahashi S, Murakami T, Takamura M, Kim T, Hori M, Narumi Y, Nakamura H, Kudo M. Multi-detector row helical CT angiography of hepatic vessels: depiction with dual-arterial phase acquisition during single breath hold. Radiology. 2002;222:81-88. [PubMed] |
| 4. | Mortele KJ, McTavish J, Ros PR. Current techniques of computed tomography. Helical CT, multidetector CT, and 3D reconstruction. Clin Liver Dis. 2002;6:29-52. [PubMed] |
| 5. | Luo MY, Shan H, Jiang ZB, Li LF, Huang HQ. Study on hepatocellular carcinoma-associated hepatic arteriovenous shunt using multidetector CT. World J Gastroenterol. 2003;9:2455-2459. [PubMed] |
| 6. | Kim TK, Choi BI, Han JK, Chung JW, Park JH, Han MC. Nontumorous arterioportal shunt mimicking hypervascular tumor in cirrhotic liver: two-phase spiral CT findings. Radiology. 1998;208:597-603. [PubMed] |
| 7. | Nagino M, Nimura Y, Kamiya J, Kanai M, Hayakawa N, Yamamoto H. Immediate increase in arterial blood flow in embolized hepatic segments after portal vein embolization: CT demonstration. Am J Roentgenol. 1998;171:1037-1039. [PubMed] |
| 8. | Chen JH, Chai JW, Huang CL, Hung HC, Shen WC, Lee SK. Proximal arterioportal shunting associated with hepatocellular carcinoma: features revealed by dynamic helical CT. Am J Roentgenol. 1999;172:403-407. [PubMed] |
| 9. | Chen JH, Huang CL, Hwang JI, Lee SK, Shen WC. Dynamic helical biphasic CT emerges as a potential tool for the diagnosis of proximal arterioportal shunting. Hepatogastroenterology. 1999;46:1791-1797. [PubMed] |
| 10. | Fan J, Wu ZQ, Tang ZY, Zhou J, Qiu SJ, Ma ZC, Zhou XD, Ye SL. Multimodality treatment in hepatocellular carcinoma patients with tumor thrombi in portal vein. World J Gastroenterol. 2001;7:28-32. [PubMed] |
| 11. | Li L, Wu PH, Li JQ, Zhang WZ, Lin HG, Zhang YQ. Segmental transcatheter arterial embolization for primary hepatocellular carcinoma. World J Gastroenterol. 1998;4:511-512. [PubMed] |