修回日期: 2005-01-01
接受日期: 2005-01-20
在线出版日期: 2005-03-01
目的: 探讨MAGE-A1, -A4基因在大肠肿瘤中的表达及临床意义.
方法: 采用免疫组化S-P法, 检测正常人大肠黏膜38例, 大肠腺瘤31例, 大肠腺癌组织83例中MAGE-A1, -A4蛋白的表达和定位特点.
结果: MAGE-A1蛋白定位于胞质, MAGE-A4蛋白定位于胞质及胞核; 二者在正常大肠黏膜组织中几乎均不表达, 在大肠肿瘤(大肠腺瘤、大肠腺癌)中均有较高水平的表达; 但在大肠腺瘤与大肠腺癌中的表达差异均无显著性; 二者在大肠腺瘤中的表达与患者的性别、年龄、组织学类型、是否复发及癌变之间差异均无显著性; 二者在大肠腺癌中的表达均与患者的性别、年龄、组织学分级、侵袭深度、有无肝转移之间无统计学意义, 均与有无淋巴结转移之间有统计学意义(P<0.01), 且均呈正相关关系(PA1<0.01, rsA1=0.287; PA4<0.01, rsA4= 0.312). 在有淋巴结转移的大肠腺癌中, MAGE-A1与A4蛋白表达呈正相关关系(P<0.05, rs=0.247).
结论: MAGE-A1, -A4基因可能在大肠肿瘤的发生、发展(尤其是淋巴结转移)中起作用, 有望成为诊断大肠肿瘤及其发生淋巴结转移的分子生物学标记物之一.
引文著录: 梁锐, 王芳, 王开昕, 高倩, 王志强, 杨耘. MAGE-A1, -A4基因在大肠肿瘤中的表达及临床意义. 世界华人消化杂志 2005; 13(5): 657-661
Revised: January 1, 2005
Accepted: January 20, 2005
Published online: March 1, 2005
AIM: To explore the expression and clinical significance of MAGE-A1, MAGE-A4 genes in human colorectal neoplasm.
METHODS: MAGE-A1, MAGE-A4 were detected by streptavidin-peroxidase (S-P) immunohistochemistry in 38 normal colorectal mucosal tissues, 31 colorectal adenoma tissues and 83 colorectal adenocarcinoma tissues.
RESULTS: MAGE-A1 was located in cytoplasm, whereas MAGE-A4 was observed in both cytoplasm and nucleus. While hardly detected in normal colorectal mucosal tissues, their expression was significantly increased in colorectal neoplasm tissues (P<0.01). However, there was no difference between colorectal adenoma and colorectal adenocarcinoma. The expression of both genes had no relationship with sex, age, histological type, recurrence and malignant transformation of colorectal adenoma, or histological grade, depth of wall invasion and liver metastasis of colorectal adenocarcinomas. However, the expression of both genes was significantly correlated with regional lymph node metastasis in colorectal adenocarcinoma (PA1<0.01, rsA1 = 0.287, PA4<0.01, rsA4 = 0.312). There was correlation between the expression of MAGE-A1 and MAGE-A4 in colorectal adenocarcinoma with regional lymph node metastasis (P<0.05, rs = 0.247).
CONCLUSION: MAGE-A1 and -A4 genes may play important roles in the occurrence of colorectal neoplasm and the progression of colorectal adenocarcinoma, especially the lymph nodes metastasis. So they could be regarded as two molecular markers for early diagnosis of colorectal neoplasm as well as prediction of regional lymph node metastasis of colorectal adenocarcinoma.
- Citation: Liang R, Wang F, Wang KX, Gao Q, Wang ZQ, Yang Y. Expression and Clinical Significance of MAGE-A1, -A4 Genes in Human Colorectal Neoplasms. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 657-661
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/657.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.657
MAGE这个术语源于黑色素瘤抗原(Melanoma antigen-encoding), Van der Bruggen et al[1-2]1987年在研究黑色素瘤时首次发现了MAGE-1抗原(MZ2-E). 随着研究的不断深入, 目前已找到23个MAGE家族成员, 他们均位于人X染色体上[3]. 根据其在染色体上分布的区域不同, 将MAGE家族分为A, B, C, D, E, F六个亚家族[4]. 其中, MAGE-A亚家族包括12个成员, 均位于人染色体Xq28. 大肠癌是常见的严重威胁人类健康的恶性肿瘤之一, 其发病率和死亡率均较高. 尤其是近年, 由于人们饮食结构的变化, 其发病率正在逐渐增加[5-8]. 目前, 国内还未见在大样本大肠肿瘤组织中关于MAGE基因与肿瘤发生、发展(侵袭和转移)关系的研究报道, 尤其是大肠腺瘤, 国内外均未见报道. 为此, 我们采用免疫组化技术, 应用MAGE-A1, -A4蛋白在组织切片上高度特异的mAb MA454和57B[9-12], 检测人正常大肠黏膜、大肠腺瘤、大肠腺癌组织中二者的表达和定位特点, 探讨二者与大肠肿瘤发生、发展之间的关系, 以期进一步阐明大肠癌转移的分子生物学机制, 寻找早期预测大肠癌转移的分子生物学标记物, 为大肠癌的早期诊治提供一定的参考依据.
昆明医学院病理学教研室和第三附属医院外科手术切除、大肠黏膜活检及尸体解剖中临床资料完整的存档蜡块152例. 其中, 正常大肠黏膜组织38例均取自有淋巴结转移大肠腺癌手术切除标本的切缘, 切缘经组织学观察证实没有癌组织浸润、没有腺瘤样结构; 大肠腺瘤31例均为内窥镜活检取出标本; 大肠癌标本83例均为大肠癌手术切除的腺癌标本, 包括无淋巴结转移45例和有淋巴结转移38例的腺癌标本, 其中大肠癌标本中剔除了黏液腺癌和印戒细胞癌, 所有患者术前均未进行放疗和化疗. 所有标本均经40 g/L中性甲醛固定, 常规石蜡包埋, 4 μm连续切片, 做常规HE染色, 两位病理学专家观察切片, 按照2000年WHO肠道肿瘤组织学分型标准对大肠肿瘤的诊断、分级进行修订, 诊断意见统一.
免疫组化染色采用S-P法(链霉菌抗生物素蛋白-过氧化酶连接法). mAb 57B由瑞士Spagnoli GC教授惠赠[13]. 浓缩型mAb MA454、即用型Ultra SensitiveTM-S-P试剂盒、液体DAB酶底物显色试剂盒、PBS粉剂、1 mmol/L的EDTA抗原修复液(pH 8.0)、10 mmol/L的柠檬酸抗原修复液(pH 6.0)以及抗体稀释液均为美国Maxin公司产品, 购自福州迈新生物技术有限公司, 步骤按试剂盒说明进行. 一抗MA454按1: 400浓度稀释, 抗原修复采用EDTA抗原热修复法(水浴法)[9-10,14]; 57B按1: 20浓度稀释, 抗原修复采用柠檬酸缓冲液高温高压抗原修复法[14-17]. 每次实验均以人睾丸组织切片作阳性对照[18], 以PBS代替一抗作阴性对照[19], 每例均设有HE切片作对照观察. 请两位病理学专家双盲法观察组织切片, 采用半定量积分法[20-21]判断结果. 具体操作如下: 首先确定阳性定位, 然后按照下面的标准进行评分: (1)阳性细胞数: ≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >76%为4分; (2)阳性强度: 无色为0分, 淡黄色为1分, 黄色为2分, 棕黄色为3分. 将(1)(2二者积分相乘, 0分为阴性(-), 1-4分为弱阳性(+), 5-8分为阳性(++), 9-12分为强阳性(+++), 若两位专家结果相差3分则重新判定.
统计学处理 应用SPSS11.0统计软件包, 计数资料采用Nonparametric Tests方法, 相关性分析采用Correlate中的Bivariate方法.
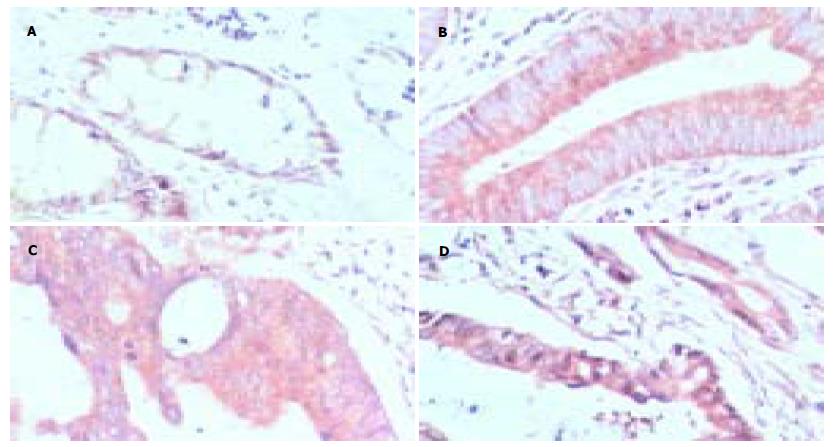
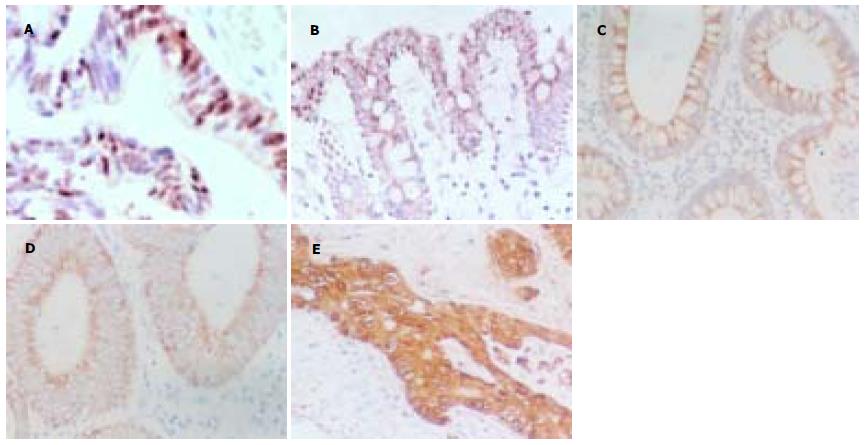
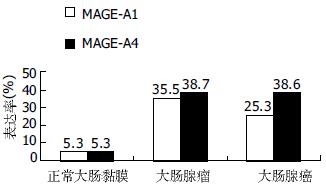
MAGE-A1蛋白表达的阳性信号定位于胞质; 在正常大肠黏膜组织中, 阳性信号为浅黄色细颗粒(图1A); 在大肠腺瘤和腺癌组织中, 阳性信号均为黄色-棕黄色粗颗粒(图1B-D). 而MAGE-A4蛋白主要定位于胞质, 偶伴有胞核着色(图2A); 在正常大肠黏膜组织中, 阳性信号为淡黄色-黄色细颗粒(图2B); 在大肠腺瘤和腺癌组织中, 阳性信号均为黄色-棕黄色粗颗粒(图2C-E). MAGE-A1, -A4在正常大肠黏膜和大肠肿瘤(大肠腺瘤、大肠腺癌)组织中的表达差异均有显著性(P<0.01), 但在大肠良、恶性肿瘤中的表达差异均无统计学意义(图3, 表1).
| 蛋白 | 分组 | 正常大肠黏膜 | 大肠腺瘤 | 大肠腺癌 |
| MAGE-A1 | 正常大肠黏膜 | - | bP<0.01 | bP<0.01 |
| 大肠腺瘤 | bP<0.01 | - | ||
| 大肠腺癌 | bP<0.01 | - | ||
| MAGE-A4 | 正常大肠黏膜 | - | dP<0.01 | dP<0.01 |
| 大肠腺瘤 | dP<0.01 | - | ||
| 大肠腺癌 | dP<0.01 | - |
二者在大肠腺瘤中的表达均与患者的性别, 年龄, 组织学类型(管状、绒毛状、混合性腺瘤), 是否复发及癌变之间差异无统计学意义, 亦未见明显的相关性.
二者在大肠腺癌中的表达均与患者的性别、年龄、组织学分级、侵袭深度、有无肝转移之间差异无显著性, 但均与患者有无淋巴结转移之间差异有显著性(P<0.01). 二者在大肠腺癌中的表达均与患者有无淋巴结转移呈正相关关系(PA1 = 0.007, rsA1 = 0.287; PA4 = 0.003, rsA4 = 0.312), 而均与侵袭深度、有无肝转移之间无明显相关性(表2). 在有淋巴结转移的大肠腺癌中, MAGE-A1与A4蛋白表达呈正相关关系(P = 0.032, rs = 0.247, 表3).
| 比较项目 | 分组 | MAGE-A1 | MAGE-A4 | ||||||||
| - | + | ++ | +++ | P值及rs值 | - | + | ++ | +++ | P值及rs值 | ||
| 侵袭深度 | 黏膜肌层以内 | 8 | 2 | 1 | 0 | 7 | 4 | 0 | 0 | ||
| 黏膜肌层以外 | 54 | 9 | 8 | 1 | 44 | 19 | 3 | 6 | |||
| 淋巴结转移 | - | 39 | 3 | 3 | 0 | bP<0.01 | 34 | 9 | 0 | 2 | bP<0.01 |
| + | 23 | 8 | 6 | 1 | rs = 0.287 | 17 | 14 | 3 | 4 | rs = 0.312 | |
| 肝转移 | - | 49 | 9 | 6 | 1 | 41 | 17 | 1 | 6 | ||
| + | 13 | 2 | 3 | 0 | 10 | 6 | 2 | 0 | |||
MAGE-A1, -A4基因均为MAGE-A亚家族的成员, 均定位于人染色体Xq28. Dhodapkar et al[14]的实验显示, MA454的阳性信号定位于胞质; 57B的阳性信号主要定位于胞质, 但也能见到胞核着色. 这一结果与我们实验中MAGE-A1, -A4蛋白的定位是一致的. 我们检测了MAGE-A1, -A4蛋白在38例正常大肠黏膜中的表达情况, 结果显示, 绝大多数标本不着色, 但有2例表现为MA454着色(+), 还有2例表现为57B着色(+). 这一结果与国内、外的报道均不一致, 许多文献显示, 除了睾丸组织和胎盘组织, MAGE-A亚家族在正常组织中是不表达的, 而表达于以黑色素瘤为主的多种肿瘤组织中[11,14,22-24]. 考虑到我们实验中所选的38例正常大肠黏膜均取自有淋巴结转移的大肠腺癌手术切除标本的切缘, 我们认为产生这一差异的原因可能为这些着色(+)的标本已有癌变早期的改变(如癌肿局部区域的一些肿瘤相关分子的浓度发生了改变).
有关MAGE-A1, -A4在大肠腺瘤中的表达情况, 尚不曾见到国内、外文献中报道. 我们的实验显示, 二者在大肠腺瘤组织中均有较高的表达, 阳性率分别为35.5%(11/31)和38.7%(12/31), 阳性信号均为黄色-棕黄色粗颗粒, 且二者在大肠腺瘤中的表达均与患者的性别、年龄、组织学类型、是否复发及癌变之间差异无统计学意义, 亦未见明显的相关性. 其表达与大肠腺瘤的预后没有相关性, 这与我们预期的设想不同, 其原因可能与样本例数不足, 存在部分失访等因素有关. Hasegawa et al[25]对80例大肠癌标本进行RT-PCR研究, 发现MAGE-A1-mRNA的阳性率为22.5%(18/80); Miyashiro et al[26]的实验也发现MAGE-A1-mRNA在大肠癌组织中的表达率为25%(3/12); 其结果与我们进行的免疫组化MA454的着色率25.3%(21/83)相一致. Park et al[27]对38例大肠癌患者进行RT-PCR研究, 发现MAGE-A4-mRNA的阳性率为15.8%(6/38), 其表达率低于我们进行的免疫组化57B的着色率38.6%(32/83), 其原因可能与样本例数、检测方法的敏感性、mAb57B对MAGE-A4的特异程度等因素有关. 总的来说, MAGE-A亚家族的多数成员在黑色素瘤[15]、原发性肝癌[28]、食管癌[29-30]、小细胞肺癌[17,30]中的表达率要高于大肠癌.
我们的实验显示MAGE-A1, -A4在大肠腺瘤、大肠腺癌中均高表达, 且均在正常大肠黏膜中几乎不表达, 提示二者在大肠肿瘤的发生过程中具有一定的作用, 有可能作为大肠肿瘤发生的标记物. 我们的实验还表明, MAGE-A1, -A4在大肠腺癌中的表达与患者的年龄、性别、组织学分级、侵袭深度、肝转移之间的差异均无显著性, 但均与患者有无淋巴结转移之间的差异有统计学意义(P<0.01), 且均呈正相关关系(PA1 = 0.007, rsA1 = 0.287; PA4 = 0.003, rsA4 = 0.312); 提示二者在大肠腺癌的转移中起重要作用, 有望成为大肠癌发生淋巴结转移的标记物. 此外, 在发生了淋巴结转移的大肠腺癌组织中, MAGE-A1与A4蛋白表达呈正相关关系(P = 0.032, rs = 0.247), 提示二者在大肠腺癌淋巴结转移的过程中具有协同作用. 二者不仅有望用于大肠肿瘤及其转移的诊断, 其制备的肿瘤疫苗也有望用于大肠癌的免疫治疗[31].
编辑: 张海宁 电编: 潘伯荣
| 3. | Yakirevich E, Sabo E, Dirnfeld M, Sova Y, Spagnoli GC, Resnick MB. Morphometrical quantification of spermatogonial germ cells with the MA454 anti-MAGE-A4 antibody in the evaluation of testicular biopsies for Azoospermial. Appl Immunohistochem Mol Morphol. 2003;11:37-44. [PubMed] |
| 4. | 马 鸣, 俞 莉章, 那 彦群. 肿瘤特异性抗原MAGE基因的表达及意义. 国外医学泌尿系统分册. 2003;23:526-529. |
| 8. | Wang Z, Wang F, Wang WQ, Gao Q, Wei WL, Yang Y, Wang GY. Correlation of N-myc downstream-regulated gene 1 overexpression with progressive growth of colorectal neoplasm. World J Gastroenterol. 2004;10:550-554. [PubMed] |
| 9. | Jungbluth AA, Antonescu CR, Busam KJ, Iversen K, Kolb D, Coplan K, Chen YT, Stockert E, Ladanyi M, Old LJ. Monophasic and biphasic synovial sarcomas abundantly express cancer/testis antigen NY-ESO-1 but not MAGE-A1 or CT7. Int J Cancer. 2001;94:252-256. [PubMed] |
| 10. | Jungbluth AA, Stockert E, Chen YT, Kolb D, Iversen K, Coplan K, Williamson B, Altork N, Busam KJ, Old LJ. Monoclonal antibody MA454 reveals a heterogeneous expression pattern of MAGE-A1 antigen in formalin-fixed paraffin embedded lung tumours. Br J Cancer. 2000;83:493-497. [PubMed] |
| 11. | Landry C, Brasseur F, Spagnoli GC, Marbaix E, Boon T, Coulie P, Godelaine D. Monoclonal antibody 57B stains tumor tissues that express gene MAGE-A4. Int J Cancer. 2000;86:835-841. [PubMed] |
| 12. | Rimoldi D, Salvi S, Schultz-Thater E, Spagnoli GC, Cerottini JC. Anti-MAGE-3 antibody 57B and Anti-MAGE-1 antibody 6C1 can be used to study different proteins of the MAGE-A family. Int J Cancer. 2000;86:749-751. [PubMed] |
| 14. | Dhodapkar MV, Osman K, Teruya-Feldstein J, Filippa D, Hedvat CV, Iversen K, Kolb D, Geller MD, Hassoun H, Kewalramani T. Expression of cancer/testes (CT)antigens MAGE-A1, MAGE-A3, MAGE-A1, CT-7, and NY-ESO-1 in malignant gammopathies is heterogeneous and correlates with site, stage and risk status of disease. Cancer Immun. 2003;3:9. [PubMed] |
| 15. | Busam KJ, Iversen K, Berwick M, Spagnoli GC, Old LJ, Jungbluth AA. Immunoreactivity with the anti-MAGE antibody 57B in malignant melanoma: frequency of expression and correlation with prognostic parameters. Mod Pathol. 2000;13:459-465. [PubMed] |
| 16. | Sarcevic B, Spagnoli GC, Terracciano L, Schultz-Thater E, Heberer M, Gamulin M, Krajina Z, Oresic T, Separovic R, Juretic A. Expression of cancer/testis tumor associated antigens in cervical squamous cell carcinoma. Oncology. 2003;64:443-449. [PubMed] |
| 17. | Bolli M, Kocher T, Adamina M, Guller U, Dalquen P, Haas P, Mirlacher M, Gambazzi F, Harder F, Heberer M. Tissue microarray evaluation of Melanoma antigen E (MAGE)tumor-associated antigen expression: potential indications for specific immunotherapy and prognostic relevance in squamous cell lung carcinoma. Ann Surg. 2002;236:785-793. [PubMed] |
| 18. | Resnick MB, Sabo E, Kondratev S, Kerner H, Spagnoli GC, Yakirevich E. Cancer-testis antigen expression in uterine malignancies with an emphasis on carcinosarcomas and papillary serous carcinomas. Int J Cancer. 2002;101:190-195. [PubMed] |
| 19. | Kocher T, Zheng M, Bolli M, Simon R, Forster T, Schultz-Thater E, Remmel E, Noppen C, Schmid U, Ackermann D. Prognostic relevance of MAGE-A4 tumor antigen expression in transitional cell carcinoma of the urinary bladder: a tissue microarray study. Int J Cancer. 2002;100:702-705. [PubMed] |
| 20. | 曹 立宇, 张 洪福, 龚 西, 孟 刚. 大肠肿瘤中p53和bcl-2蛋白的表达. 临床与实验病理学杂志. 2000;16:214-216. |
| 22. | Jungbluth AA, Busam KJ, Kolb D, Iversen K, Coplan K, Chen YT, Spagndi GC, Old LJ. Expression of MAGE-antigen in normal tissues and cancer. Int J Cancer. 2000;85:460-465. [PubMed] |
| 23. | Sadanga N, Nagashima H, Mashino K, Tahara K, Yamaguchi H, Ohta M, Fujie T, Tanaka F, Inoue H, Takesako K. Dendritic cell vaccination with MAGE peptide is a novel therapeutic approach for gastrointestinal carcinomas. Clin Cancer Res. 2001;7:2277-2284. [PubMed] |
| 24. | Schultz ES, Zhang Y, Knowles R, Tine J, Traversari C, Boon T, van der Bruggen P. A MAGE-3 peptide recognized on HLA-B35 and HLA-A1 by cytolytic T lymphocytes. Tissue Antigens. 2001;57:103-109. [PubMed] |
| 25. | Hasegawa H, Mori M, Haraguchi M, Ueo H, Sugimachi K, Akiyoshi T. Expression spectrum of melanoma antigen-encoding gene family members in colorectal carcinoma. Arch Pathol Lab Med. 1998;122:551-554. [PubMed] |
| 26. | Miyashiro I, Kuo C, Huynh K, Iida A, Morton D, Bilchik A, Giuliano A, Hoon DS. Molecular strategy for detecting metastatic cancer with use of multiple tumor-specific MAGE-A genes. Clin Chem. 2001;47:505-512. [PubMed] |
| 27. | Park MS, Park JW, Jeon CH, Lee KD, Chang HK. Expression of melanoma antigen-encoding genes(MAGE)by common primers for MAGE-A1 to -A6 in colorectal carcinomas among Koreans. J Korean Med Sci. 2002;17:497-501. [PubMed] |
| 28. | Zhao L, Mou DC, Leng XS, Peng JR, Wang WX, Huang L, Li S, Zhu JY. Expression of cancer-testis antigens in hepatocellular carcinoma. World J Gastroenterol. 2004;10:2034-2038. [PubMed] |
| 30. | Weiser TS, Ohnmacht GA, Guo ZS, Fischette MR, Chen GA, Hong JA, Nguyen DM, Schrump DS. Induction of MAGE-3 expression in lung and esophageal cancer cells. Ann Thorac Surg. 2001;71:295-301. [PubMed] |
| 31. | Xiao J, Chen HS. Biological functions of melanoma-associated antigens. World J Gastroenterol. 2004;10:1849-1853. [PubMed] |