修回日期: 2004-12-11
接受日期: 2004-12-21
在线出版日期: 2005-03-01
目的: 探讨LN-R在判断胃腺癌浸润转移及预后中的作用.
方法: 应用免疫组织化学S-P法检测76例胃腺癌组织和10例正常胃组织中LN-R的表达水平, 比较LN-R的不同表达率与生存率的关系.
结果: LN-R在胃腺癌组织中阳性表达率为51.3%, 较正常组织(10.0%)显著增高(P<0.05), 与分化程度、Borrmann分型、浸润深度、肿块大小、淋巴结转移程度比较关系显著(χ2=10.606、9.979、6.838、7.611、12.509, P<0.05), LN-R阳性表达者的生存时间较阴性者短(χ2 = 9.980, P<0.05).
结论: LN-R是判断胃腺癌浸润转移及预后的重要指标.
引文著录: 刘丽华, 王士杰, 单保恩, 郝国桢, 高建国, 张召. 胃腺癌组织层粘连蛋白受体表达的意义. 世界华人消化杂志 2005; 13(5): 644-647
Revised: December 11, 2004
Accepted: December 21, 2004
Published online: March 1, 2005
AIM: To determine the expression of laminin receptor (LN-R) in gastric adenocarcinoma and its clinicopathological significance.
METHODS: Immunohistochemical staining was performed on 76 cases of paraffin-embedded gastric adenocarcinoma tissues and 10 normal gastric mucosa tissues with mouse-anti-human LN-R polyclonal antibodies.
RESULTS: The expression of LN-R in gastric adenocarcinoma was significantly higher than that in normal gastric mucosa tissues (P<0.05). The expression was significantly associated with differentiation degree, Borrmann stage, invasion depth, tumor size and lymphatic node metastasis (χ2 = 10.606, 9.979, 6.838, 7.611, 12.509, P<0.05). The positive expression was negatively correlated with the survival time (χ2 = 9.980, P<0.05).
CONCLUSION: LN-R might act as an important index for judging the invasiveness, metastasis and prognosis of gastric adenocarcinoma.
- Citation: Liu LH, Wang SJ, Shan BE, Hao GZ, Gao JG, Zhang Z. Expression and significance of laminin receptor in gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 644-647
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/644.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.644
侵袭和转移是恶性肿瘤患者的主要死亡原因. 层粘连蛋白(laminin, LN)是细胞外基质中重要的成分之一[1]. 做为基膜的骨架成分, 他可促进血管内皮细胞的形成, 而同时成熟的血管内皮细胞亦分泌LN构成基底膜成分, 上皮性肿瘤转移首先要突破基底膜, LN在其中发挥重要作用, LN通过层粘连蛋白受体(laminin receptor, LN-R)在体内外发挥生物活性[2]. 正常情况下, LN-R只分布在良性细胞的基底面, 而在恶性肿瘤组织中却分布在癌细胞的整个表面, 使癌细胞更容易与基底膜黏附, 以利于其侵袭和转移. 我们应用免疫组化方法检测LN-R在胃腺癌组织中的表达情况, 探讨其在胃腺癌浸润、转移及预后中的作用.
我院1997/1998年未经放化疗手术切除的胃腺癌病理标本76例, 男52例, 女24例, 年龄20-78(中位54)岁.高分化10例, 中分化23例, 低分化43例; Borrmann I型11例, II型17例, III型40例, IV型8例; 肿瘤浸润黏膜层(M)和黏膜下层(Sm)8例, 固有肌层(Pm)28例, 浆膜下(SS)和穿透浆膜层(Se)40例; 肿块大小: 直径≥3 cm 45例, 直径<3 cm 31例; 淋巴结转移: 阳性44例, 阴性32例. 对照组为10例正常胃黏膜组织. 判断标准参照《WHO1997年国际胃癌肿瘤组织学分类》[2]. 所有标本常规石蜡包埋, 连续切片厚5 μm. 均有术后5 a随访资料.鼠抗人LN-R购自北京中山生物技术公司.
采用S-P法免疫组化染色如下: 石蜡切片脱蜡、水化; 30 ml/L过氧化氢孵育; 抗原修复; 滴加一抗(LN-R原液1: 80稀释); 滴加生物素标记的二抗; 加辣根过氧化物酶标记的链霉卵白素工作液; DAB显色, 苏木素复染, 透明, 封片. 以PBS代替一抗, 其他步骤不变作为阴性对照. 以乳腺癌标本作为阳性对照. 细胞膜或细胞质中出现棕黄色颗粒, 着色细胞数≥ 10%为阳性, 着色细胞数<10%为阴性.
统计学处理 应用SPSS10.0软件进行数据处理, χ2检验用于比较计数资料, 用Kaplan-Meier法作生存分析, Logrank法比较患者生存率. 生存时间的计算是从手术日期起到随访日期或由于复发、转移而死亡的日期为止.
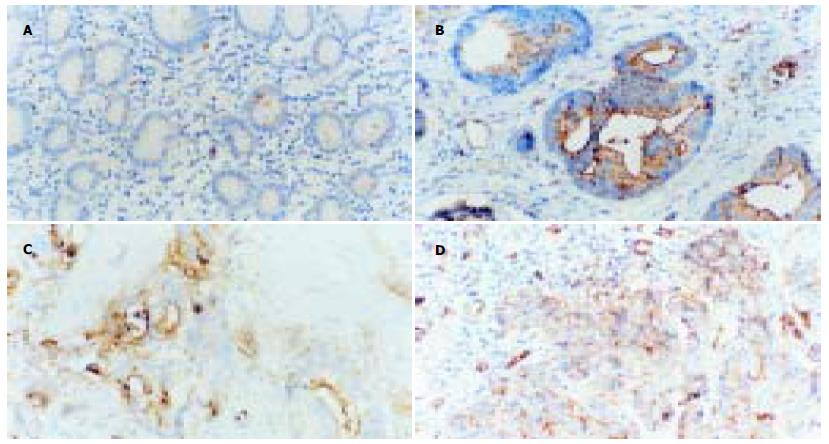
LN-R阳性表达于癌细胞的表面, 呈黄色颗粒状, 与阴性细胞比较差别明显(图1).76例胃腺癌组织中LN-R阳性表达39例(51.3%), 10例正常胃组织LN-R阳性表达1例(10.0%), LN-R在胃腺癌组织的表达明显高于正常胃组织(P<0.05). LN-R在胃腺癌组织中的表达水平与分化程度、Borrmann分型、浸润深度、肿块大小、淋巴结转移情况均有明显的关系(P<0.05, 表1).
| 肿瘤特征 | n | 阳性表达(%) | χ2 | P | |
| 分化程度 | 高 | 10 | 2(20.0) | ||
| 中 | 23 | 13(56.5) | 10.606 | 0.014 | |
| 低 | 43 | 24(55.8) | |||
| Borrmanna | Ⅰ | 11 | 2(18.2) | ||
| 分型 | Ⅱ | 17 | 6(35.3) | 9.979 | 0.019 |
| Ⅲ | 40 | 26(65.0) | |||
| Ⅳ | 8 | 5(62.5) | |||
| 浸润深度 | M、Sm | 8 | 2(25.0) | ||
| Pm | 28 | 11(39.3) | 6.838 | 0.033 | |
| SS、Se | 40 | 26(65.0) | |||
| 肿块大小 | <3 cm | 31 | 10(32.3) | ||
| ≥3 cm | 45 | 29(64.4) | 7.611 | 0.006 | |
| 淋巴结 | Negative | 32 | 9(28.1) | ||
| 转移 | <30% | 15 | 9(60.0) | 12.509 | 0.002 |
| ≥30% | 29 | 21(72.4) |
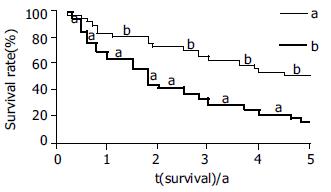
LN-R阳性表达者的生存时间明显短于阴性表达者(用Logrank分析χ2 = 9.980, P<0.05), 随着LN-R表达程度的增高生存时间缩短(图2).
LN-R又称为层粘连蛋白结合蛋白, 是LN发挥作用的媒介. LN是细胞外基质中非胶原糖蛋白中最重要的成分之一, 与IV型胶原结合形成基底膜骨架, 影响细胞黏附、运动, 调节细胞生长、分化, 并与肿瘤的浸润、转移等有关, 通过LN-R在体内外发挥重要生物学活性. 正常上皮及良性组织细胞仅在其基底膜面可被LN-R抗体着染, 而癌细胞则在整个细胞表面可见阳性反应. 在本组研究中, LN-R在胃腺癌组织与正常胃组织的表达相比有显著性差异(P<0.05). 正常上皮的LN-R极化在基低膜表面, 而恶性肿瘤中LN-R可扩散到整个细胞, 癌细胞表面有更多的未结合LN-R, 为恶性肿瘤粘着于基低膜并进一步侵袭创造了条件. 在癌细胞转移过程中, 涉及到多种因素, 而癌细胞与基膜的作用是关键性步骤. 癌细胞在转移过程中至少要三次穿过基膜: 突破癌细胞下基膜而浸润结缔组织, 穿过脉管基膜而进入脉管, 再穿出脉管基膜, 转移进入靶组织. Liotta报道[3], 高度恶性肿瘤细胞表面较低度恶性肿瘤细胞有更多未结合的LN-R, 并认为瘤细胞表面LN-R的多少直接影响LN促进转移的能力. 如人浸润性乳腺癌细胞质膜特异性结合LN的能力较正常或良性乳腺瘤高50倍[4], 提示LN-R不仅数量增加, 而且其结合的活性也提高, 这为恶性肿瘤细胞粘着于基膜创造了条件. 张鸿来 et al[5]应用PCR技术扩增LN-R cDNA, 然后将其受体单克隆抗体处理肿瘤细胞, 结果肿瘤细胞浸润和转移能力受到抑制, 进一步证明了LN-R的表达数量与生物活性在胃腺癌浸润转移中的作用.
本研究还表明, LN-R与胃腺癌的分化程度、Borrmann分型相关, 随着肿瘤分化程度减低、肿块体积增大、浸润深度增加, LN-R表达增高, 提示LN-R与浸润、转移有关. LN-R还与胃腺癌的淋巴结转移密切相关. 在这方面国内外报道很少, 李晓玲 et al[6]对胃癌的研究表明67 KD-LR在印戒细胞癌中的表达率最高, 弥漫性生长的胃癌具有较高的浸润转移能力, 提示67 KD-LR阳性表达的细胞具有较高侵袭力, 且与胃癌病期进展密切相关. Fujita[7]对早期胃癌的研究表明LN表达的减少或消失是判断肿瘤侵袭基低膜或决定肿瘤浸润生长方式的重要指标. 有人用ELISA检测血清中LN水平结果表明, 胃癌组显著高于正常组, 淋巴结转移组高于无淋巴结转移组, 肝转移组高于肝无转移组. Daneker et al[8]对结肠癌的研究证实癌细胞分化越低, 合成LN的能力就越低, 而低分化的癌细胞及其组织内多种细胞分泌蛋白水解酶的水平却较高. 张林et al[9]用免疫组化S-P法检测胃腺癌组织中LN的表达结果表明, 在胃癌组织中LN的表型与分化程度有关: 分化型癌多呈连续线状型、间断线状型或碎片状型, 而未分化型癌则呈完全缺失型或碎片状型, LN表达类型还与胃癌的浸润深度及淋巴结转移有明显关系, 因而认为LN是胃癌浸润转移的指标. LN-R通过结合LN能促进肿瘤细胞IV型胶原酶的释放[10]. LN-R利于癌的血源性转移可能有两种途径: (1)如果癌细胞表面的LN-R是未被占据而呈游离状态, 癌细胞可借助LN-R直接结合到宿主的LN; (2)如果LN-R被占据而呈饱和状态, 则癌细胞借助其结合的LN为桥梁, 连接到基膜中的IV型胶原上. 瘤细胞对LN的亲合性成为影响肿瘤细胞浸润和转移的重要因素之一. 他不与组织来源有关, 而与转移能力有关. 对可转移的细胞无论癌或肉瘤, 都可选择性地与IV型胶原组织粘着. 而不转移的肉瘤细胞偏爱I型胶原(存在于结缔组织基质). 因此, LN-R可能通过增加IV型胶原蛋白的形式来促进LN与其结合, 促进细胞转移、浸润. 由此可见, LN-R在胃腺癌浸润、转移中起重要作用, 反映了肿瘤的恶性行为, 是一个有意义的指标. 通过对患者生存时间进行随访, 比较二者的关系, 我们发现LN-R与生存时间呈负相关. 因此LN-R可作为胃腺癌的预后指标之一.
编辑: 张海宁 电编: 潘伯荣
| 1. | Kibbey MC, Yamamura K, Jun SH, Grant DS, Kleinman HK. Enhancement of tumor growth by basement membrance: modulate of growth and angiogenesis by laminin-derived synthetic peptides. Cancer Treat Res. 1994;71:267-275. [PubMed] |
| 3. | Liotta LA. Tumor invasion and metastasis-role of the extracelluer matrix: Rhoads memorial award lecture. Cancer Res. 1986;46:1-9. [PubMed] |
| 7. | Fujita J. Correlation between laminin and fibronectin on the basement membrance and tumor progression in early gastric cancer: an immunohistochemical study. Hokkaido Lgaku Zasshi. 2000;75:25-34. [PubMed] |
| 8. | Daneker GW Jr, Mercurio AM, Guerra L, Wolf B, Salem RR, Bagli DJ, Steele GD Jr. Laminin-expression in colorectal carcinomas varying in degree of differention. Arch Surg. 1987;122:1470-1474. [PubMed] |
| 10. | Turpeenniemi-Hujanen T, Thorgeirsson UP, Rao CN, Liotta LA. Laminin increased the release of type IVcollagenase from malignant cells. J Biol Chem. 1986;261:1883-1889. [PubMed] |